组蛋白H3K36me3与缺血再灌注诱导小鼠急性肾损伤的相关性研究*
2020-04-03徐卫卫伍聪聪王笑笑简久莹杨又璇刘丽荣
徐卫卫, 伍聪聪, 王笑笑, 简久莹, 杨又璇, 张 妮, 郭 兵, 刘丽荣△
(1贵州医科大学医学检验学院临床血液学教研室, 贵州 贵阳 550004; 2贵阳市第一人民医院输血科, 3贵州医科大学贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025)
急性肾损伤(acute kidney injury,AKI)是临床上危重症常见的严重并发症,发生率和死亡率均较高,并有逐年增高趋势[1-2]。AKI由多种病因造成,其中缺血再灌注(ischemia/reperfusion,IR)引起AKI是临床上最常见的发病原因之一[3]。尽管经过多年研究,目前对IR引起的AKI仍缺乏有效的预防和治疗措施。因此,进一步研究IR诱导AKI的发病机制及有效的治疗措施至关重要。
据文献报道,表观遗传学参与了肾脏疾病的发生与发展过程,在基因转录调控中起重要作用[4-5]。组蛋白甲基化是目前研究较广泛深入的表观遗传修饰方式之一,是指组蛋白在组蛋白甲基转移酶的作用下发生甲基化修饰的过程,通过影响组蛋白与DNA的亲和性来改变染色体空间结构及状态,调控基因的表达[6]。组蛋白不同位点的甲基化由不同的甲基转移酶催化完成[7],如组蛋白H3第36位赖氨酸(histone H3 lysine 36,H3K36)可由N-赖氨酸甲基转移酶SMYD2(SET and MYND domain containing 2)催化发生三甲基化(H3K36me3)。在常染色体显性多囊肾患者和小鼠的肾上皮细胞中,SMYD2催化组蛋白H3K36和多种信号蛋白甲基化参与了肾囊肿生成和细胞凋亡[8]。组蛋白甲基转移酶Set2介导的H3K36me3在DNA双链断裂(DNA double-strand break,DSB)处富集,促进DSB修复,减轻组织或细胞损伤[9],但H3K36me3是否参与AKI的发生与发展目前尚无相关文献报道。研究发现,多种表观遗传修饰参与了AKI的发生与发展[10],故本研究通过观察H3K36me3在IR诱导的AKI小鼠肾组织中的表达变化,分析其与肾组织SMYD2及肾损伤程度的相关性,旨在探讨H3K36me3在IR-AKI中的作用及其可能机制。
材 料 和 方 法
1 材料
1.1实验动物 健康雄性ICR小鼠,体重18~20 g,周龄8周,购买于斯贝福(北京)生物技术有限公司,许可证号为SCXK(京)2016-0002,适应性喂养1周,自由饮水、摄食。
1.2主要器械、仪器及试剂 双垂直电泳仪(北京六一,DYCZ-24DN);全波长酶标仪(BIO-RAD,V111584);高速离心机(BECKMAN Allegra X-30R Centrifuge);自动生化分析仪(Cobas, c702);旋涡振荡器(杭州米欧,MIX-28+);光学显微镜(耐博,M-30D)。蛋白提取试剂盒(Solarbio,R0010);BCA定量试剂盒(碧云天,P0010S);免疫组化试剂盒(Bioss,SP-0023);DAB显色试剂盒(Bioss;C02-04001)。抗体:β-actin(Bioss,bs-0061R);中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL;Boster,PB0641);H3K36me3(Abcam,ab9050);P53(Wanleibio,WL01919);p-P53(Wanleibio,WL02504);促凋亡因子Bax(Wanleibio,WL01637);抗凋亡因子Bcl-2(Wanleibio,WL01556);cleaved caspase-3(Santa,sc7272);信号转导和转录活化因子3(signal transducer and activator of transcripition 3,STAT3;Abcam,ab68153);p-STAT3(Abcam,ab76315);c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK;Abcam,ab179461);p-JNK1/2/3 (Abcam,ab124956)。
2 方法
2.1IR诱导AKI小鼠模型的构建 将30只ICR小鼠随机分为IR组和假手术(sham)组。术前禁食8 h,自由饮水。腹腔注射戊巴比妥钠(65 mg/kg)麻醉,固定、备皮、消毒,沿腹中线左右各0.5 cm分别作纵行切口,暴露双侧肾脏钝性剥离肾蒂。微动脉夹夹闭双侧肾蒂,1 min内可见肾脏由鲜红色变为紫黑色。夹闭45 min后,松开微动脉夹恢复血流灌注,观察肾脏颜色变为鲜红色,缝合腹腔。sham组仅钝性剥离肾蒂,其余与IR组做相同处理。
2.2标本收集 小鼠给予标准饲料喂养,自由饮水摄食24 h。乙醚麻醉后眼眦取血,分离血清检测肾功能指标。开腹留取双侧肾脏,1/2肾脏置于4%多聚甲醛中固定,用于肾组织病理分析;其余1/2肾脏置于-80 ℃冰箱中储存,用于提取总蛋白和后续检测。
2.3生化方法检测肾功能指标血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr) 将全血置于低速离心机4 000 r/min离心5 min,取上清,应用Cobas 702全自动生化分析仪检测各组小鼠BUN和Scr含量。
2.4HE染色观察肾组织病理学的改变 采用4%多聚甲醛固定肾组织,脱水浸蜡,石蜡包埋,制成3 μm厚的石蜡切片,脱蜡透明后行HE染色,光学显微镜下观察肾组织形态结构。
2.5免疫组织化学(immunohistochemistry,IHC)染色检测肾组织中NGAL和cleaved caspase-3的变化 石蜡切片,常规脱蜡至水,高压抗原修复,3% H2O2灭活组织内源性过氧化物酶20 min,正常山羊血清工作液封闭30 min,孵育 I 抗4 ℃过夜,室温复温30 min,室温孵育 II 抗30 min,DAB显色,显微镜观察,苏木素复染细胞核,自来水返蓝,脱水、透明、封片,光学显微镜下观察NGAL和cleaved caspase-3的变化情况。
2.6Western blot检测肾组织中NGAL、SMYD2、H3K36me3、p-P53、P53、Bax、Bcl-2、cleaved caspase-3、STAT3、p-STAT3、JNK和p-JNK1/2/3等蛋白水平的变化 称取0.020 g肾组织加入蛋白裂解液充分研磨裂解,4 ℃离心20 min取上清,应用BCA法测定蛋白浓度,配制蛋白样本。配制SDS-PAGE凝胶,上样、电泳、转膜、封闭。分别加入 I 抗:NGAL(1∶800)、SMYD2(1∶500)、H3K36me3(1∶1 000)、p-P53(1∶500)、P53(1∶500)、Bax(1∶750)、Bcl-2(1∶500)、cleaved caspase-3(1∶300)、p-STAT3(1∶2 000)、STAT3(1∶1 500)、JNK(1∶1 000)、p-JNK1/2/3(1∶1 000)和β-actin(1∶5 000),4 ℃摇床孵育过夜。TBST洗膜,孵育相应II抗,TBST洗膜,ECL显影曝光,Bio-Rad凝胶成像系统扫描,ImageJ 1.6软件进行分析各条带的灰度值,以β-actin为内参照,目的蛋白与β-actin的比值进行后续的统计学分析。
3 统计学处理
采用SPSS 23.0统计软件对数据进行统计学分析,数据以均数±标准差(mean±SD)表示,组间比较用独立样本t检验,相关性分析采用Pearson相关分析法。以P<0.05为差异具有统计学意义。
结 果
1 肾功能变化
与sham组相比,IR组的BUN和SCr水平显著升高(P<0.05),见表1。
表1 小鼠BUN和SCr水平
Table 1.The results of BUN and SCr in each group (Mean±SD.n=15)

GroupBUN (mmol/L)SCr (μmol/L)sham5.48±0.847.13±1.36IR65.02±6.22*157.50±9.07*
*P<0.05vssham group.
2 肾组织病理学改变
HE染色结果显示,sham组肾小球及肾小管结构清晰,肾小管上皮细胞未见明显水肿、脱落和坏死;IR组可见肾小管上皮细胞肿胀、脱落、坏死,肾小管上皮细胞刷状缘脱落,管腔内大量细胞碎屑残留,肾小球未见明显病变,见图1。
Figure 1.The pathophysiological changes in the kidney of mice (HE staining). The green arrow indicates edema of renal epithelial cells; the red arrow indicates the fragments of renal epithelial cells.
图1 小鼠肾组织病理学改变
3 肾组织中NGAL和cleaved caspase-3的变化
IHC染色结果显示,与sham组相比,IR组肾小管上皮细胞中NGAL和cleaved caspase-3明显增多,见图2。
4 肾组织NGAL、SMYD2、H3K36me3、p-P53、P53、cleaved caspase-3、Bax、Bcl-2、p-STAT3、STAT3、JNK和p-JNK1/2/3等蛋白水平的变化
Western blot结果显示,与sham组相比,IR组NGAL、SMYD2和H3K36me3的蛋白水平明显增加(P<0.05),见图3。IR组的p-P53、cleaved caspase-3和Bax的蛋白水平明显增加(P<0.05), Bcl-2表达水平明显下调(P<0.05),P53表达水平不变,见图4。IR组的STAT3、p-STAT3、JNK和 p-JNK1/2/3的蛋白水平均明显增加(P<0.05),见图5。
Figure 2.The expression of NGAL and cleaved caspase-3 proteins in the kidney of mice detected by immunohistochemical staining (×200).
图2 小鼠肾组织NGAL和cleaved caspase-3蛋白表达
5 肾组织 H3K36me3同SMYD2和NGAL相关性分析
相关性分析结果显示,肾组织H3K36me3同SMYD2和NGAL的变化水平均呈显著正相关,H3K36me3与SMYD2的相关系数r=0.946(P<0.05);H3K36me3与NGAL的相关系数r=0.887(P<0.05)。
讨 论
AKI作为各种大型手术和器官移植常见的严重并发症,如何有效的预防和治疗成为了国内外学者研究的热点。越来越多的研究表明[11],表观遗传修饰与AKI的发病机制密切相关,因此,进一步研究表观遗传修饰在AKI发生发展中的作用,将为AKI的防治提供新的方向。

Figure 3.The protein levels of NGAL, SMYD2 and H3K36me3 in the kidney of mice. Mean±SD.n=15.*P<0.05vssham group.
图3 小鼠肾组织中NGAL、SMYD2和H3K36me3蛋白水平的变化
研究表明,在肾IR 24 h后,肾组织中的NGAL表达明显增加,提示NGAL可作为AKI早期诊断的标志物[12]。本研究结果显示,在IR诱导AKI小鼠肾组织中NGAL表达明显增加(P<0.05),与国内外研究结果一致[13],同时结合本研究中小鼠肾功能及肾组织形态学改变结果提示,IR-AKI小鼠模型构建成功。研究发现,单侧输尿管结扎诱导肾脏纤维化的小鼠肾组织中H3K9me1表达上调[14],IR诱导的肾损伤小鼠肾组织中H3K4me3表达上调[15],提示组蛋白甲基化水平增高可能与肾脏疾病的发生发展密切相关。本研究发现,在IR诱导AKI小鼠肾组织中,H3K36me3和SMYD2表达明显增加,同时伴有小鼠肾功能障碍,肾小管上皮细胞坏死和细胞凋亡增加,提示H3K36me3表达上调可能参与了IR-AKI肾损伤的发生。目前关于H3K36me3在IR-AKI发生发展中的作用及机制尚未见其他研究报道。
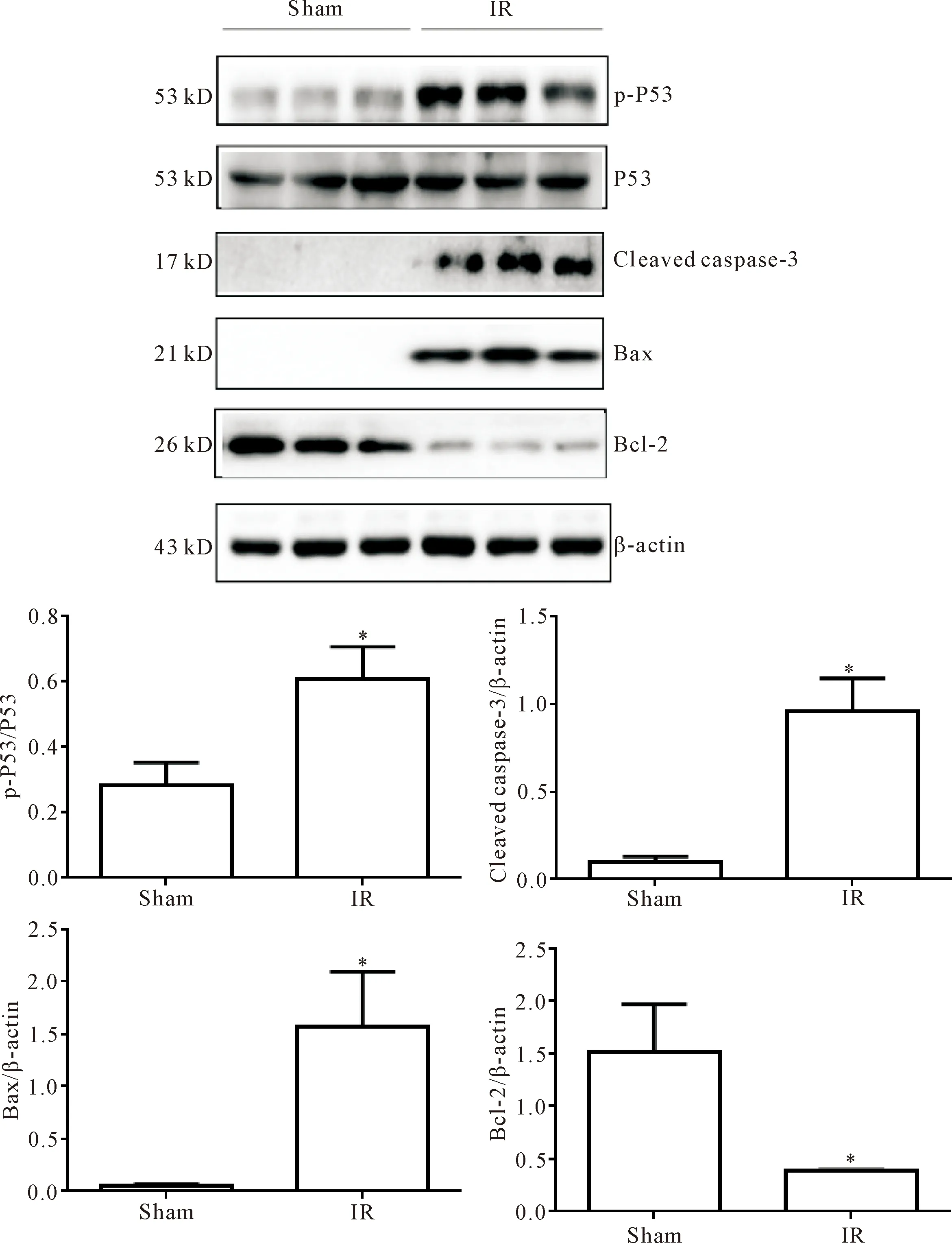
Figure 4.The protein levels of p-P53, P53, cleaved caspase-3, Bax and Bcl-2 in the kidney of mice. Mean±SD.n=15.*P<0.05vssham group.
图4 小鼠肾组织中p-P53、P53、cleaved caspase-3、Bax和Bcl-2蛋白水平的变化
AKI的发病机制复杂,参与因素和涉及事件众多,包括肾近端小管损伤、氧化应激反应和炎症反应[16]。肾近端小管损伤涉及不同的病理反应,主要包括炎症、细胞凋亡、坏死和线粒体功能障碍等[17]。本研究结果表明,sham组小鼠肾组织中未出现明显细胞凋亡,IR组小鼠肾组织中凋亡细胞明显增加,且伴有肾小管上皮细胞刷状缘脱落,管腔内大量细胞碎屑残留,肾组织损伤明显,提示肾IR损伤时,细胞凋亡明显增加,参与介导了AKI的发生。细胞凋亡受多种凋亡基因及凋亡蛋白的调控,P53是介导细胞凋亡重要的调控基因之一[18]。研究表明,在肾IR损伤时,P53蛋白表达增加,可激活凋亡相关蛋白Bax的表达,抑制抗凋亡相关蛋白BCL-2蛋白的表达,介导细胞凋亡的发生[19]。本研究结果表明,在IR-AKI小鼠肾组织中p-P53蛋白及凋亡相关蛋白cleaved caspase-3和Bax表达明显增加,抗凋亡蛋白BCL-2蛋白表达明显下降,提示IR-AKI时,肾组织中P53表达增加,可能参与介导了细胞凋亡的产生。
大量研究表明,当肾IR损伤时可激活一系列细胞凋亡信号通路[20-22],包括P53介导的细胞凋亡信号通路和非P53依赖的细胞凋亡信号通路。本研究结果表明,在肾IR损伤时,肾组织中p-P53、p-STAT3和p-JNK1/2/3的蛋白水平明显增加,提示IR-AKI时,肾组织中P53表达增加,可能同时激活了STAT3和JNK相关的细胞凋亡信号通路,介导了细胞凋亡。另外,Li LX等研究发现,SMYD2和H3K36me3的上调可导致STAT3在赖氨酸685处甲基化,然后磷酸化进而活化,以调节囊性肾上皮细胞凋亡,药物干预可减少细胞凋亡的发生[8],但H3K36me3在IR-AKI肾损伤及肾组织细胞凋亡中的作用目前尚无相关文献报道。本研究相关性分析结果显示,H3K36me3与SMYD2和NGAL的水平均呈明显正相关,结合上述结果,提示H3K36me3表达的上调可能受SMYD2的调控,其可能参与了STAT3或JNK介导的IR-AKI肾损伤及肾组织细胞凋亡的发生。

Figure 5.The protein levels of STAT3, p-STAT3, JNK and p-JNK1/2/3 in the kidney of mice. Mean±SD.n=15.*P<0.05vssham group.
图5 小鼠肾组织中STAT3、p-STAT3、JNK和p-JNK1/2/3蛋白水平变化
综上所述,在IR诱导小鼠AKI肾组织中H3K36me3表达上调,且与肾脏损伤及肾组织细胞凋亡的发生密切相关,H3K36me3可能与STAT3/JNK信号通路活化共同参与调控IR所致细胞凋亡发生进而导致AKI的发生过程,但具体调控机制仍需进一步研究。
