肺炎克雷伯杆菌荚膜多糖经EGFR途径诱导支气管上皮细胞分泌细胞因子*
2020-04-03曹二龙龙南彪曾赛丽
肖 非, 曹二龙, 龙南彪, 曾赛丽
(1邵阳学院医学检验学院, 湖南 邵阳 422000; 2南华大学附属第二医院呼吸内科, 湖南 衡阳 421001)
肺炎克雷伯菌(Klebsiellapneumoniae,KP)是一种革兰阴性致病菌,是引起医院获得性感染的主要病原体之一。KP能够在不同的环境中存活,并定植于人体各个部位引起包括重症肺炎、尿路感染、败血症以及伤口感染等在内的多种感染性疾病[1]。近年来,抗生素的使用不当以及KP持续接触不同抗菌药物,使得其产生了多种抗生素的耐药菌株[2]。临床研究显示,由多重耐药KP菌株引起的感染其死亡率在危重病人和器官移植的患者中高达40%以上[3]。多重耐药KP菌株的临床危害较大,但是目前并没有有效的治疗方案,因此,明确KP的致病以及耐药机制,对于有效预防、治疗KP感染至关重要。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一个170 kD的跨膜糖蛋白受体酪氨酸激酶,由表皮生长因子激活并调控细胞的生长和分化。EGFR的活化能够参与气道上皮细胞的修复和再生,同时其还与促炎细胞因子和趋化因子的分泌密切相关[4-5]。研究表明,呼吸道感染引起的炎性病变主要受细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和核因子κB(nuclear factor-kappa B,NF-κB)信号通路的调节,而EGFR则是其中一种重要的受体。尽管已有研究显示多种细菌或病毒病原体感染均能够激活EGFR[6-7],但其在KP感染引起炎性反应中的作用机制尚不清楚。因此,本研究探讨了EGFR在KP荚膜多糖(capsular polysaccharide,CPS)诱导人正常支气管上皮细胞产生炎症反应中的作用,并进一步明确了EGFR与ERK、NF-κB信号通路的关系。
材 料 和 方 法
1 菌株与细胞株
肺炎克雷伯菌(13883)购自ATCC;人正常支气管上皮细胞BEAS-2B购自中科院细胞库。
2 主要实验材料
抗EGFR、p-EGFR、ERK、p-ERK和p65抗体购自Abcam;EGFR抑制剂AG1478、ERK抑制剂PD98059和NF-κB抑制剂PDTC购自Sigma;人肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞介素8(interleukin-8, IL-8)ELISA Kit购自Invitrogen;细胞培养试剂购自上海生物工程股份有限公司。
3 主要方法
3.1肺炎克雷伯菌的培养与荚膜多糖提取 肺炎克雷伯菌于含100 mg/L氨苄青霉素或50 mg/L卡那霉素的LB培养基中培养。按照参考文献提供的方法提取CPS[8]:100 ℃加热含KP的培养基以释放其荚膜成分。随后加入丙酮沉淀CPS。经RNase B(30 mg/L)、DNase I(70 mg/L)及链霉蛋白酶溶液(含10 mmol/L Tris-HCl,pH 7.4,1 mmol/L CaCl2)消化后对样品透析、冻干。随后于TSK HW-65F柱上进一步纯化并采用苯酚-浓硫酸法测定CPS的浓度。刺激细胞前采用2-酮基-3-脱氧辛酸-硫代巴比妥酸法测定CPS中脂多糖(lipopolysaccharide,LPS)的含量以排除LPS污染。
3.2细胞培养与处理 BEAS-2B细胞中加入含10%胎牛血清的高糖DMEM培养基(含1 %的青霉素-链霉素混合液),并于37 ℃、5 % CO2的条件下培养。待细胞生长至对数期时,用胰蛋白酶消化细胞并进行细胞传代。将细胞按相应比例稀释后置于新的细胞瓶中,进行如下处理:(1)分别用浓度为1、5和10 mg/L的CPS刺激细胞12 h后收集细胞及上清待用;(2)10和30 μmol/L的EGFR抑制剂AG1478处理2 h后,10 mg/L CPS刺激细胞12 h,收集细胞及上清待用;(3)10和30 μmol/L的ERK抑制剂PD98059或NF-κB抑制剂PDTC预处理2 h后,再用10 mg/L CPS刺激细胞12 h,收集细胞上清待用。
3.3Western blot检测蛋白磷酸化 将上述细胞通过超声破碎仪收集细胞总蛋白。BCA法测定蛋白浓度后,通过稀释使各样本浓度保持一致。随后按照说明书要求进行SDS-PAGE。电泳完成后根据不同条件进行转膜,转膜完成后取出PVDF膜于封闭液中室温封闭2 h。随后加入稀释好的I抗[抗EGFR抗体(1∶1 000)、抗p-EGFR抗体(1∶1 000)、抗ERK抗体(1∶2 000)和抗p-ERK抗体(1∶2 000)]4 ℃孵育过夜。再用相应的IgG II 抗室温孵育2 h。最后进行ECL显影。
3.4ELISA测定TNF-α和IL-8的分泌 收集不同处理条件下的细胞上清,严格按照人TNF-α和IL-8 ELISA Kit说明书要求检测细胞上清中TNF-α和IL-8含量,并在酶标仪450 nm处测定各组样本的吸光度(A)值。每组实验重复3次。最后通过标准品检测制备的标准曲线计算各细胞上清中TNF-α和IL-8水平。
3.5间接免疫荧光检测p65核转位 BEAS-2B细胞经CPS处理后,在细胞中加入3.5%的多聚甲醛固定10~15 min;孵育完成后加入0.3%的Triton X-100,室温孵育20 min;随后用PBS洗涤细胞3次,加入稀释的抗p65抗体(1∶200)后4℃孵育过夜;PBS洗3遍后再加入稀释的IgG II抗(1∶400)避光孵育1.5 h;最后荧光显微镜下观察NF-κB p65的核转位情况。
4 统计学处理
所有数据均采用SPSS 16.0进行分析。计量资料以均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析及SNK-q检验。以P<0.05表示差异有统计学意义。
结 果
1 肺炎克雷伯菌CPS诱导支气管上皮细胞分泌TNF-α和IL-8
未经处理的BEAS-2B细胞上清中TNF-α和IL-8分泌水平较低,而当给予10 mg/L CPS刺激12 h后,TNF-α和IL-8分泌水平明显增多(P<0.05),见图1。

Figure 1.The effect ofKlebsiellapneumoniaeCPS on secretion of TNF-α and IL-8 in bronchial epithelial BEAS-2B cells. Mean±SD.n=3.*P<0.05vscontrol group (0 mg/L).
图1 肺炎克雷伯菌CPS对支气管上皮BEAS-2B细胞分泌TNF-α和IL-8的影响
2 肺炎克雷伯菌CPS激活支气管上皮细胞EGFR
未经处理的BEAS-2B细胞中EGFR磷酸化水平较低,当用10 mg/L CPS刺激细胞30 min后,可明显检测到EGFR磷酸化,且磷酸化水平可持续至120 min,见图2A。此外,分别用10和30 μmol/L EGFR抑制剂AG1478预处理2 h后再用CPS刺激细胞,细胞上清中TNF-α和IL-8的分泌水平明显减少(P<0.05),见图2B。
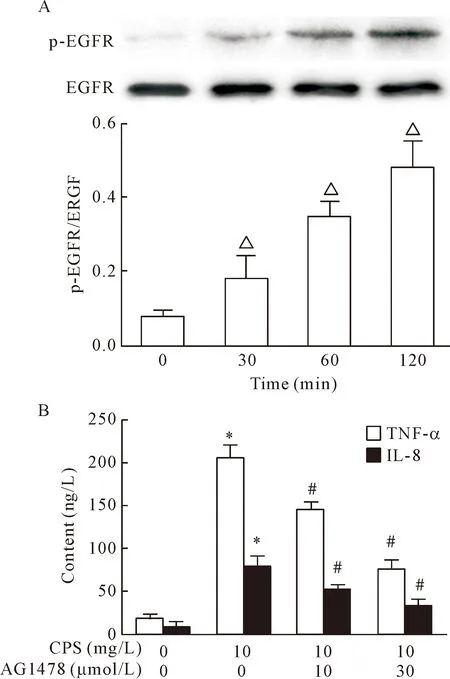
Figure 2.The effect ofKlebsiellapneumoniaeCPS on the activation of EGFR in bronchial epithelial BEAS-2B cells. A: EGFR phosphorylation was detected by Western blot; B: EGFR inhibitor AG1478 inhibited the secretion of TNF-α and IL-8. Mean±SD.n=3.△P<0.05vs0 min group;*P<0.05vscontrol group;#P<0.05vsCPS group.
图2 肺炎克雷伯菌CPS对支气管上皮BEAS-2B细胞EGFR活化的影响
3 肺炎克雷伯菌CPS经EGFR激活ERK通路诱导支气管上皮细胞分泌TNF-α和IL-8
10 mg/L CPS刺激30 min~2 h均可明显诱导ERK磷酸化,而30 μmol/L AG1478预处理2 h后,ERK磷酸化则明显降低(P<0.05),见图3A。此外,ELISA结果显示,在给予10和30 μmol/L ERK抑制剂PD98059预处理后,细胞上清中TNF-α和IL-8分泌水平均明显减少(P<0.05),见图3B。
4 肺炎克雷伯菌CPS经EGFR激活NF-κB通路诱导支气管上皮细胞分泌TNF-α和IL-8
BEAS-2B细胞经10 mg/L CPS孵育1 h后,细胞核内p65水平明显增多,并可持续到4 h,而用EGFR抑制剂AG1478预处理2 h后,细胞核内p65水平则出现明显降低,见图4A。此外,当给予10和30 μmol/L NF-κB抑制剂PDTC预处理后,细胞上清中的TNF-α和IL-8分泌水平也明显减少(P<0.05),见图4B。

Figure 3.The effect of ERK pathway on the secretion of TNF-α and IL-8 in bronchial epithelial BEAS-2B cells induced byKlebsiellapneumoniaeCPS. A: the phosphorylation level of ERK was determined by Western blot; B: ERK inhibitor PD98059 inhibited the secretion of TNF-α and IL-8. Mean±SD.n=3.△P<0.05vs0 h group;▲P<0.05vs120 min group;*P<0.05vscontrol group;#P<0.05vsCPS group.
图3 ERK通路对肺炎克雷伯菌CPS诱导支气管上皮BEAS-2B细胞分泌TNF-α和IL-8的影响
讨 论
国内外流行病学调查结果显示,由于各类抗菌药物使用不当,KP药物耐药性不断增加并出现了多重耐药菌株,临床治疗十分困难。尽管联合治疗包括粘菌素、磷霉素、替加环素以及氨基糖苷类药物在过去几年得到了广泛应用,但其治疗效果并不理想[9]。因此,明确其致病机制进而有效预防、治疗KP感染是目前的当务之急。本研究通过明确EGFR在KP CPS诱导支气管上皮细胞炎症反应中的作用,为临床KP的防治提供了理论依据。

Figure 4.The effect of NF-κB pathway on the secretion of TNF-α and IL-8 in bronchial epithelial BEAS-2B cells induced byKlebsiellapneumoniaeCPS. A: NF-κB p65 expression was detected by indirect immunofluorescence; B: NF-κB inhibitor PDTC inhibited the secretion of TNF-α and IL-8. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCPS group.
图4 NF-κB通路对肺炎克雷伯菌CPS诱导支气管上皮BEAS-2B细胞分泌TNF-α和IL-8的影响
EGFR是一种重要信号通路受体,在调控细胞存活以及炎性反应方面具有重要作用[10]。研究表明,EGFR可以通过交叉关联的信号通路被激活,其中就包括了Toll样受体(Toll-like receptors,TLRs)[11],而由于TLRs在上皮细胞中表达,可识别各种细菌、病毒和真菌的致病相关分子模式[12],因此EGFR与上皮细胞的炎症反应也存在一定联系。Beswick等[13]研究表明,在幽门螺杆菌感染的胃上皮细胞中,巨噬细胞迁移抑制因子和IL-8可诱导EGFR的磷酸化。此外,卡他莫拉菌同样可以在支气管上皮细胞中通过活化EGFR刺激产生IL-8[14]。本研中用10 mg/L KP CPS刺激支气管上皮细胞后,可在细胞内检测到明显的EGFR磷酸化,且在抑制EGFR表达后细胞上清中的炎性因子分泌水平显著降低,提示EGFR同样能够参与KP对支气管上皮细胞的致炎作用。
ERK是MAPK家族中的重要成员,它能够参与调控多种关键的细胞活动,包括细胞的凋亡与增殖[15]。EGFR被认为是ERK的主要激活因子,EGFR/ERK信号通路能够参与多种细胞先天免疫反应[16]。有研究表明,ERK异常激活将会导致呼吸道上皮的异常病变,主要包括黏液的过度分泌、细胞因子过表达以及炎症等[17]。本研究通过检测细胞中ERK的磷酸化水平发现,EGFR抑制剂预处理后细胞内的ERK磷酸化明显降低,而ERK抑制剂也能够显著减少细胞中TNF-α和IL-8的表达水平,充分说明EGFR能够激活ERK通路,并参与KP CPS诱导的炎症反应。
NF-κB信号通路在调节TNF-α和白细胞介素等多种促炎介质方面具有重要作用[18]。研究表明,在卡他莫拉菌引起的呼吸道上皮细胞炎症反应中,其可通过EGFR激活NF-κB信号通路促进IL-8的分泌[14]。为了分析NF-κB通路是否也参与了KP CPS诱导的炎症反应,本研究又检测了细胞中p65的磷酸化水平,结果发现使用EGFR抑制剂后细胞内p65磷酸化水平显著减少,而进一步使用NF-κB抑制剂也能够有效抑制细胞中TNF-α和IL-8的分泌,提示NF-κB也可通过EGFR参与KP CPS诱导的炎症反应。
