根据2013版肝脏影像报告与数据管理系统诊断肝脏病灶的一致性
2020-04-03余深平王昌新
王 影,余深平,刘 影,王昌新*
(1.中国科学技术大学附属第一医院 安徽省立医院影像科,安徽 合肥 230001;2.中山大学附属第一医院放射科,广东 广州 510080)
美国放射学会(American College of Radiology, ACR)于2008年发布了肝脏影像报告和数据管理系统(liver imaging reporting and data system, LI-RADS)[1],旨在标准化肝细胞癌(hepatocellular carcinoma, HCC)影像学征象和诊断结果[2]。LI-RADS较目前国内外广泛使用的中国抗癌协会肝癌专业委员会、亚太肝病研究学会(Asian Pacific Association for the Study of the Liver, APASL)、欧洲肝病协会(European Association for the Study of Liver, EASL)及美国肝病研究学会(American Association for the Study of Liver Disease, AASLD)等影像学诊断标准更为全面[3-6]。本研究探讨2013版LI-RADS[LI-RADS(2013)]对HCC发病高风险人群肝脏病灶诊断的一致性。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月—2012年12月于中山大学附属第一医院接受上腹部CT和/或MR检查的813例肝脏占位患者,男669例,女144例,年龄12~90岁,中位年龄53岁;共检出1 115个肝脏病灶,最大径3.00~222.00 mm,平均(52.43±1.41)mm。
纳入标准:有HCC发病风险,如乙型肝炎病毒或丙型肝炎病毒感染,酗酒,甲胎蛋白(α-fetoprotein, AFP)>400.00g/L等。同一患者存在多个病灶时,纳入符合以下标准者:①LI-RADS(LR)1、2级与LR3~5级病灶共存;②间距较远的LR3~5级病灶。排除标准:①LR1、2级病灶,无病理金标准诊断结果;②LR4、5级病灶,无病理诊断结果或病理无法明确定性,LR3级无病理诊断结果且随访病灶增大;③病理诊断为非HCC恶性肿瘤。
1.2 仪器与方法 采用Toshiba 64排螺旋CT机及Siemens Magnetom Trio/Verio 3.0T MR扫描仪。所有患者均接受CT检查,其中40例接受MR检查。
行常规上腹部CT平扫后,采用Medred双筒注射器经肘前静脉一次性注射80~100 ml优维显(300 mg/ml)及30 ml生理盐水,流率3~4 ml/s;于注射后30~35 s、60~65 s及180 s时分别进行动脉期、门静脉期双期或多期增强扫描。扫描参数:管电压120 kV,管电流300 mAs,准直32×1.0 mm,螺距0.906,矩阵512×512;原始数据重建层厚1.0 mm,间距0.5 mm;重建图像层厚5 mm,层距5 mm。MR检查前禁食、禁水6~8 h。嘱患者仰卧,采用8通道相控阵体部线圈,FOV 380 mm×380 mm,扫描范围自横膈顶至肝脏下缘,采集同反相位T1WI(TR/TE 225 ms/2.2 ms、225 ms/3.7 ms)及T2WI(TR/TE 1 600 ms/91 ms)。增强扫描对比剂为Gd-DTPA,注射剂量0.1 mmol/kg体质量,流率2 ml/s;以20 ml 0.9%氯化钠溶液冲洗导管,流率2 ml/s,分别于注射对比剂后15~25 s、50~60 s、95~120 s及180 s时行动脉期、门静脉期、平衡期及延迟期扫描。DWI采用呼吸门控单次激发平面回波成像(single-shot echo-plannar imaging, SS-EPI)序列(TR/TE 5 700 ms/82 ms),b值为50、400、800 s/mm2。
1.3 LI-RADS分级诊断标准及金标准 由2名具有2年腹部影像学诊断经验的放射科医师采用双盲法分别依据LI-RADS(v2013)、LI-RADS(v2012,第1版)[即LI-RADS(v1.0)]独立判读所有影像学资料,针对病灶直径及有无动脉期高强化、门静脉期/延迟期低强化及包膜3个主要征象进行分级诊断。LI-RADS(v1.0)分级诊断标准[2]见表1。LI-RADS(v2013)的分级诊断标准见图1,LR1、2、3、4、5级判定标准同LI-RADS(v1.0)。
各级病灶诊断标准:LR1、2级以临床随访病灶缩小/消失或至少2年无变化,或以病理结果为准;LR3、4级以病理结果或临床随访病灶缩小或消失为标准;LR5级均以病理结果为准。
1.4 数据处理与统计学分析 采用SPSS 20.0统计分析软件。采用组内相关系数(intraclass correlation coefficients, ICC)观察医师1、2测量病灶直径的一致性,采用Kappa系数及其95%CI表示主要征象、分级诊断结果(对于同时接受CT、MR检查者,分级诊断结果以MR为准)的一致性。判读标准[7]:Kappa系数0.01~0.20判定为一致性微弱,0.21~0.40为较弱,0.41~0.60为适中,0.61~0.80为显著,0.81~0.99为最佳。2名医师间分级诊断结果不同时,经协商达成一致;采用Kappa系数及其95%CI分析最终分级诊断结果与金标准诊断结果的一致性。将LR1、2级病灶判定为阴性,LR3~5级为阳性,计算LI-RADS(v2013)诊断阳性病灶敏感度、特异度、阳性预测值(positive predictive value, PPV)及阴性预测值(negative predictive value, NPV)。采用配对χ2检验比较LI-RADS(v2013)与LI-RADS(v1.0)诊断阳性病灶的差异。P<0.05为差异有统计学意义。
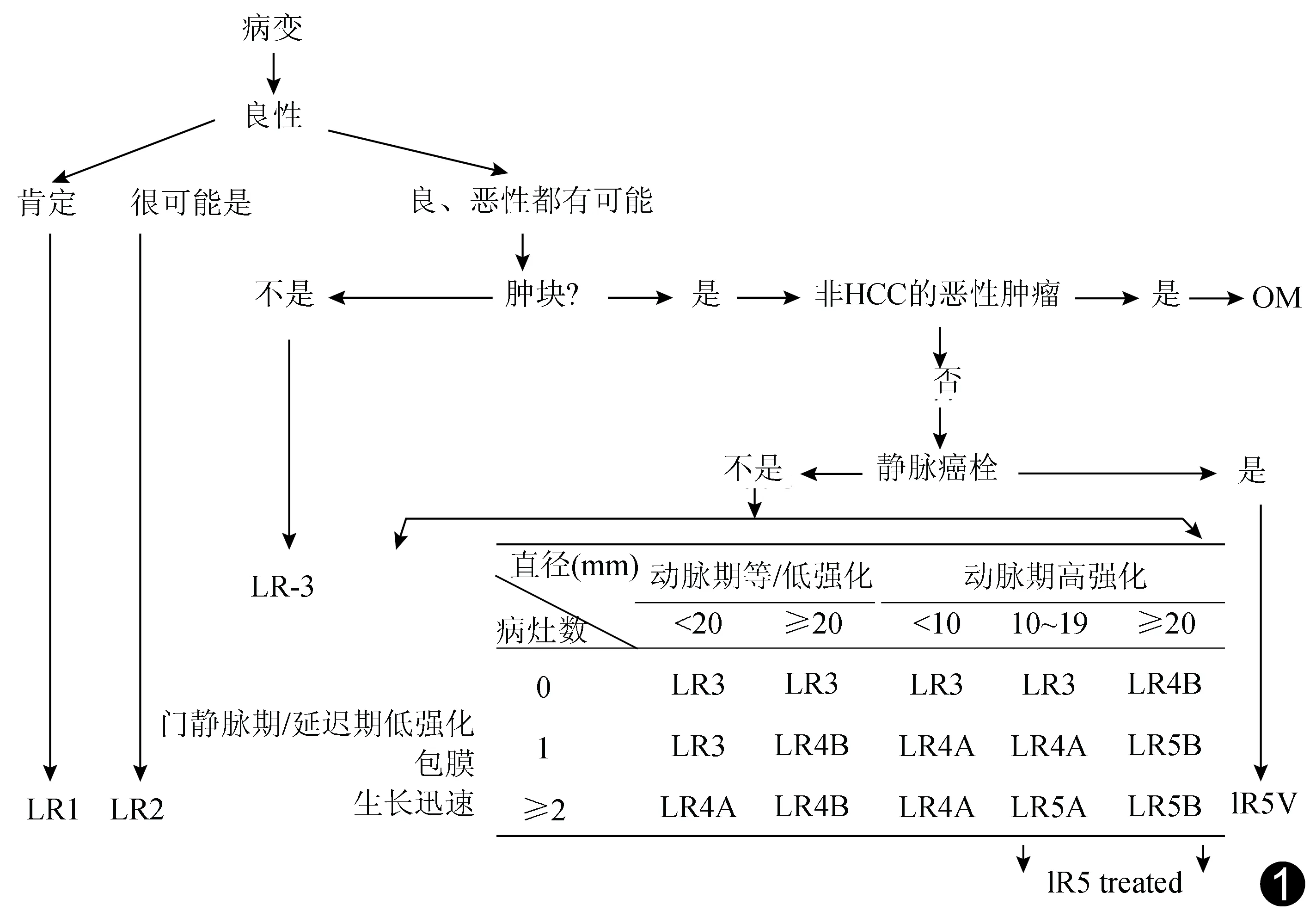
图1 LI-RADS(v2013)分级诊断标准
2 结果
2.1 医师1、2测量病灶直径和评价主要征象的一致性 医师1、2测量病灶直径的ICC为0.998;对动脉期高强化、门静脉期/延迟期低强化的一致性均最佳(Kappa系数=0.87、0.86),判断包膜的一致性为显著(Kappa系数=0.72)。见表2。
2.2 医师1、2根据LI-RADS(v2013)进行分级诊断结果的一致性 医师1、2根据LI-RADS(v2013)分级诊断结果的Kappa系数及95%CI为0.85(0.83,0.87)。见表3。

表1 肝脏病灶LI-RADS(v1.0)分级诊断标准
注:其他主要征象包括门静脉期/延迟期低强化(廓清)及1年内直径增加至少10 mm

表2 医师1、2测量病灶直径及评价主要征象的一致性
注:直径以±s表示,一致性以ICC及其95%CI表示;主要征象以百分比表示,一致性以Kappa系数及其95%CI表示

表3 医师1、2根据LI-RADS(v2013)进行分级诊断结果的一致性(个)

图2 患者男,70岁,HCC,LR5A级病灶(箭) A.CT平扫示肝脏S6段约16 mm×17 mm×17 mm低密度结节; B.增强扫描动脉期见全瘤明显均匀高强化,密度高于周围肝实质; C.增强扫描门脉期示结节边缘环形稍高强化,中央大部分低强化,密度低于周围肝实质; D.增强扫描延迟期结节边缘呈薄环形稍高强化,内部低强化,密度低于周围肝实质
2.3 LI-RADS(v2013)的诊断效能 医师1、2协商后最终分级诊断结果与金标准对照见表4,其与金标准的一致性最佳,Kappa系数及95%CI为0.85(0.82,0.88);敏感度、特异度、PPV和NPV分别为100%(757/757)、80.17%(287/358)、91.43%(757/828)、100%(287/287)。287个LR1、2级病灶,金标准证实均为良性,NPV为100%(287/287);121个LR3级,其中82个病理为HCC,PPV为67.77%(82/121);139个LR4级,其中117个病理为HCC,PPV为84.17%(117/139);568个LR5级(图2),其中558个病理为HCC,PPV为98.24%(558/568)。
2.4 LI-RADS(v2013)、LI-RADS(v1.0)诊断HCC比较 对757个金标准诊断的LR3~5级(阳性)病灶,LI-RADS(v2013)与 LI-RADS(v1.0)诊断差异有统计学意义(χ2=16.575,P<0.001),见表5。

表4 LI-RADS(v2013)分级诊断结果与金标准对照(个)
注:LR1、2级病灶判定为阴性,LR3~5级为阳性

表5 LI-RADS(v2013)与LI-RADS(v1.0)诊断LR3~5级比较(个)
3 讨论
尽早诊断并治疗HCC可提高患者长期存活率[7-8],为此,中国抗癌协会肝癌专业委员会、APASL、EASL及AASLD等均提出HCC临床实践指南[4-6,9],但有其局限性[10]:①诊断HCC只强调特征性强化方式,对病灶大小、数目等细节描述存在差异;②诊断结果仅分为HCC和非HCC,不能报告可疑病灶;③缺乏描述影像学征象的专业术语、影像报告的统一性及CT/MR检查的最佳技术参数,不利于临床及科研工作。LI-RADS旨在制订全面、标准化及规范化的影像诊断和管理系统,有利于弥补上述不足。
本研究结果显示医师间对LI-RADS(v2013)测量直径、动脉期高强化、门静脉期/延迟期低强化及分级诊断结果的一致性均最佳,判断包膜一致性显著,优于既往报道[11-12]。分析可能原因:①样本量及分布不同,BASHIR等[11]和DAVENPORT等[12]的样本量分别为200例(肝脏富血供占位,未分类)、100例(LR1~5级各20例),而本研究样本量较大,以LR1、2级(287个)及LR5级(568个)病灶为主,且影像学表现典型者居多,而LR3级(121个)和LR4级(139个)偏少,分布存在偏倚;②病灶类型不同,BASHIR等[11]仅针对肝脏富血供结节,而本组包含HCC高危人群的多种肝脏良恶性病灶,如囊肿、血管瘤、异常灌注、局灶性结节增生、炎性假瘤及不典型增生结节等;③观察者对LI-RADS的熟悉程度不同,本研究中2名医师具有6个月以上应用LI-RADS经验,而DAVENPORT等[12]研究中的观察者仅有30 min应用LI-RADS经验。
本研究中LI-RADS(v2013)与LI-RADS(v1.0)诊断LR3~5级阳性病灶差异有统计学意义, LI-RADS(v2013)诊断阳性病灶的敏感度、特异度、PPV和NPV分别为100%、80.17%、91.43%、100%,与PETRUZZI等[13]的结果相符,提示LI-RADS(v2013)对诊断HCC具有较高价值。
LI-RADS(v2013)、LI-RADS(v1.0)仅针对以常用对比剂所行增强扫描,2014版还适用于普美显等肝细胞特异性对比剂,可用于判断病灶是否具有正常肝细胞成分[14];2017版及2018版更加完善,辅助征象增多,并支持根据良性或HCC辅助征象进行升/降级,分级诊断更为精确。 MRI软组织分辨率高,利于显示辅助征象,纳入辅助征象有利于提高MRI对HCC的诊断效能。本研究选择2010年1月—2012年12月的资料,故采用2013版LI-RADS标准,略显陈旧,但主要征象并无变化,对观察一致性无明显影响,而对分级诊断结果可能存在一定影响;但本研究中CT检查者占多数,且以影像学表现典型的LR1、2、5级病灶为主,参照辅助征象进行升降级者相对较少,故对分级诊断结果的影响较小。本组813例患者均接受CT检查,仅40例同时接受MR检查,故未对CT、MR受检者进行亚组分析,有待进一步完善。此外,LR3、4级病灶影像学表现不典型,诊断及鉴别诊断困难,是临床关注的重点和热点,但本组LR3、4级病例较少,有待进一步观察。
