Cr6+暴露对红树蚬卵巢中氧化应激和生殖基因表达的影响
2020-04-03郭云鹏
程 遂,逯 峰,黄 勃①,郭云鹏
(1.海南大学海洋学院,海南 海口 570228;2.南海海洋资源利用国家重点实验室,海南 海口 570228;3.教育部热带生物资源重点实验室,海南 海口 570228)
红树蚬(Polymesodaerosa)隶属于软体动物门(Mollusca)双壳纲(Bivalvia)帘蛤目(Veneroida)蚬科(Corbiculidae)红树蚬属(Polymesoda),广泛分布于热带、亚热带红树林和滩涂,是红树林生态系统中特有的双壳贝类,在我国海南、广西、广东和台湾等主要红树林区均有分布[1]。红树蚬体型较大,生长快,是红树林周边居民采集的主要经济贝。台湾地区自20世纪末开展红树蚬养殖,现已初具规模,而广东和广西地区也已开始小规模养殖[2]。由于红树蚬分布地域特殊,对红树蚬的研究主要集中在生态学方面,如栖息环境、生活习性、生长繁殖和种群结构等[3-4]。
当前,我国海洋污染状况严重,由于双壳贝类种群数量大,分布范围广,移动性差,营滤食生活,对重金属和有机物的富集能力比其他生物更强,其作为指示物种已被广泛用于海洋环境污染的生物监测[5],目前关于重金属富集对双壳贝类的影响研究主要集中在牡蛎、扇贝等经济贝类[6-7],而对红树蚬的相关研究则较少[8]。
重金属Cr是造成海洋环境污染的重要原因之一,Cr6+在参与生物体氧化还原反应时可以产生活性氧自由基(ROS),造成氧化胁迫,而水生生物体内含有大量多元不饱和脂肪酸,对氧化反应十分敏感[9],因此其体内Cr6+富集易造成过氧化代谢产物积累,从而对各器官产生毒性效应[10]。卵黄蛋白的合成与否表示卵母细胞的发育是否完善[11],而双壳贝类卵黄蛋白原由雌激素受体er基因和特异存在于成熟雌性动物体中卵黄蛋白原vtg基因进行调控[12],因此这2种基因表达量在一定程度上能够说明红树蚬卵巢发育的健康和成熟情况。通过分析不同剂量Cr6+暴露下红树蚬卵巢性腺指数(GSI)和2种氧化逆境标志物活性及其介导基因表达量的变化情况,研究Cr6+暴露对红树蚬的生殖毒性效应,可为探究重金属对红树蚬生殖毒性机制、保护贝类种质资源和开展海洋生态环境监测提供科学依据。
1 材料与方法
1.1 供试材料
于2019年7月,红树蚬繁殖旺季,在海南省文昌市八门湾海区霞场村附近海域(19°37′28.02″ N、110°47′38.84″ E)采集红树蚬。经形态判别后挑选大小相近的红树蚬300个用于试验并测量生物学性状,样本平均壳长为(49.85±3.42) mm,平均壳宽为(26.74±1.58) mm,平均壳高为(45.83±3.57) mm,平均湿重为(35.62±4.31) g。运回试验室后用自来水刷洗贝壳表面游泥后,擦干表面水分,并在5个100 cm×80 cm×90 cm的养殖箱中培养5 d,养殖条件:海水盐度为30‰,温度为(27±1) ℃,pH值为8.0。
1.2 试验方法
1.2.1暴露试验方法
配制5组不同质量浓度Cr6+溶液:0(对照)、0.25(低浓度)、1(中浓度)、4(较高浓度)和8 mg·L-1(高浓度)。将300个红树蚬随机分为5组,每组60个。试验期间,每组持续充氧,每天将养殖用水全部更换一次,早、晚各投喂足量螺旋藻粉。每组分别于暴露试验0、5、10和15 d时随机取样,挑选并解剖5个雌性红树蚬用于指标测定。
1.2.2雌性红树蚬性腺指数的测定
称量各雌性红树蚬软体部质量,然后分离性腺,将其用生理盐水冲洗后用滤纸吸去水分,GSI为生物性腺湿重与软体部湿重的比值[13]。
1.2.3氧化逆境标志物的提取与酶活性的测定
切取部分性腺组织用于制备酶液。每1 g组织样品用预冷双蒸水3 mL混合,匀浆5 min,外置冰块降低温度。然后将匀浆液倒入离心管中,在0 ℃条件下按20 000 r·min-1(离心半径为10 cm)离心20 min,取上清液测定红树蚬性腺组织抗氧化酶活性,重复3次。抗氧化功能测定指标选择过氧化氢酶(CAT)、谷胱甘肽转移酶(GST)和过氧化代谢产物丙二醛(MDA)。各项指标均使用南京建成生物工程研究所生产的相应试剂盒进行测定,具体操作参见产品说明书。
1.2.4基因表达的分析
为了研究高浓度与低浓度Cr6+对红树蚬卵巢中过氧化氢酶基因cat、谷胱甘肽S-转移酶基因gst、雌激素受体基因er和卵黄蛋白原基因vtg表达量影响的差异,除对照外,另外选取低浓度处理(0.25 mg·L-1)与高浓度处理(8 mg·L-1)进行测定。
基因表达量采用荧光定量聚合酶链式反应(qPCR)方法进行检测。使用Eastep©Super总RNA提取试剂盒(上海普洛麦格生物产品有限公司)从样品中提取总RNA,具体操作参见产品说明书。经分光光度计(岛津 UV-2450)检测总RNA纯度(OD260/OD280)后,取1 μg总RNA进行逆转录。从红树蚬转录组文库[14]中经功能注释后挑选目的基因序列,并使用Primer 5软件设计引物序列(表1),合成操作由生工生物工程(上海)股份有限公司完成。
表1 qPCR引物序列
Table 1 Primers used for qPCR
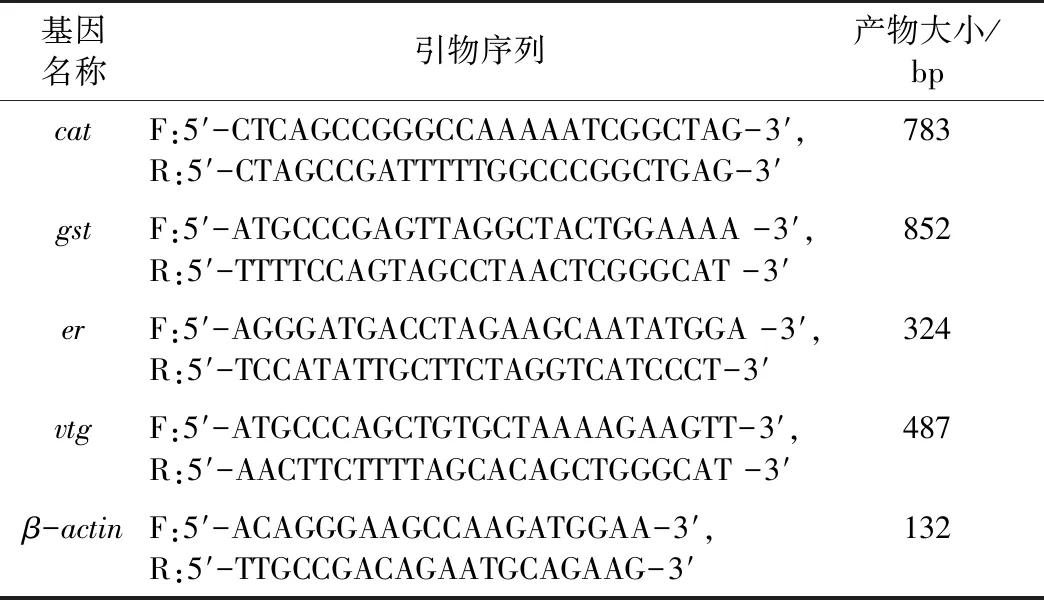
基因名称引物序列产物大小/bpcatF:5′-CTCAGCCGGGCCAAAAATCGGCTAG-3′,R:5′-CTAGCCGATTTTTGGCCCGGCTGAG-3′783gstF:5′-ATGCCCGAGTTAGGCTACTGGAAAA -3′,R:5′-TTTTCCAGTAGCCTAACTCGGGCAT -3′852erF:5′-AGGGATGACCTAGAAGCAATATGGA -3′,R:5′-TCCATATTGCTTCTAGGTCATCCCT-3′324vtgF:5′-ATGCCCAGCTGTGCTAAAAGAAGTT-3′,R:5′-AACTTCTTTTAGCACAGCTGGGCAT -3′487β-actinF:5′-ACAGGGAAGCCAAGATGGAA-3′,R:5′-TTGCCGACAGAATGCAGAAG-3′132
qPCR反应体系为10 μL,包含SYBR Premix Ex TaqTM5 μL,10 μmol·L-1正反向引物各0.4 μL,10倍稀释的cDNA 模板1 μL,RNasefree H2O 3.2 μL。qPCR扩增条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。选取β-actin作为内参基因[15],试验样本与对照样本目标基因的相对表达水平采用2-ΔΔCt(Livak)法计算,并绘图。
2 结果与分析
2.1 不同浓度Cr6+胁迫下雌性红树蚬性腺指数
GSI值越大,说明红树蚬性腺发育越好。不同浓度Cr6+对红树蚬卵巢性腺指数的影响见图1。由对照组红树蚬卵巢GSI变化趋势可知,试验所用红树蚬处于成熟期后期。在Cr6+胁迫下,随暴露时间和暴露浓度的增加,各浓度处理红树蚬GSI均呈下降趋势,且暴露时间越长,下降程度越明显。试验前、中期(5和10 d),低浓度处理(0.25 mg·L-1)红树蚬GSI与对照相比无显著差异(P>0.05);在整个试验期,较高和高浓度处理(4和8 mg·L-1)GSI显著小于低、中浓度处理(0.25和1 mg·L-1)(P<0.05);8 mg·L-1处理暴露15 d时GSI最小,比对照0 d时下降64%。
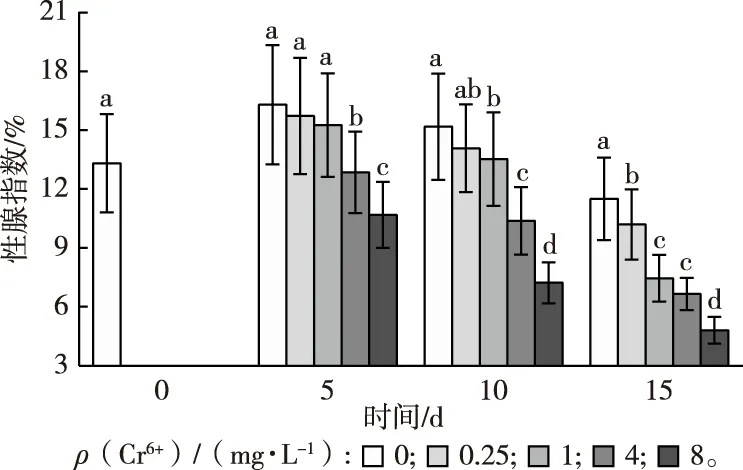
直方柱上方英文小写字母不同表示同一暴露时间不同处理间性腺指数差异显著(P<0.05)。
2.2 卵巢氧化逆境标志物活性、含量和基因表达水平变化
2.2.1卵巢CAT和GST活性变化
不同浓度Cr6+胁迫后,红树蚬卵巢CAT和GST活性变化见图2。如图2所示,中、低浓度处理红树蚬卵巢CAT活性在试验前期(5 d时)即受到诱导,且诱导效果显著(P<0.05),但在10 d后其与对照相比无显著差异(P>0.05)。除8 mg·L-1处理外,其他处理CAT活性在试验前期(5 d时)达到最大值后,随暴露时间增加呈下降趋势。Cr6+浓度越高,红树蚬卵巢CAT活性恢复越难,两者呈负相关。

同一分图中,直方柱上方英文小写字母不同表示同一暴露时间不同处理间某种酶活性差异显著(P<0.05)。
如图2所示,试验过程中,对照处理红树蚬卵巢GST活性变化不显著,表明没有Cr6+干扰条件下,红树蚬性腺GST活性相对稳定。各胁迫组GST活性均随暴露时间的增加呈先上升后下降趋势。在试验前期(5 d时),除0.25 mg·L-1处理外,其他处理GST活性均比对照显著升高(P<0.05),其中8 mg·L-1处理GST活性为对照的2.2倍。与对照相比,除8 mg·L-1处理外,其他处理GST活性在试验中期(10 d时)均显著受到诱导(P<0.05)。8 mg·L-1处理GST活性在试验前期(5 d时)上升最明显,但随后迅速降低,15 d时显著小于对照(P<0.05)。
2.2.2卵巢过氧化氢酶基因cat和谷胱甘肽转移酶基因gst表达量变化
红树蚬卵巢cat和gst基因表达水平见图3。如图3所示,红树蚬卵巢cat基因表达量受到显著诱导出现在试验前、中期(5和10 d时)。与高浓度处理相比,低浓度处理更容易促进红树蚬性腺cat基因的表达,在5 d时上调幅度显著(P<0.05),为对照的5.9倍,随后cat基因表达量逐渐降低,15 d时恢复至正常水平(P>0.05)。在试验前、中期(5和10 d时),高浓度处理会显著抑制cat基因的表达(P<0.05),15 d时高浓度处理cat表达量仅为对照的30%。
如图3所示,3个处理红树蚬卵巢gst基因表达量都呈先升高后降低趋势。5 d时,与同时期对照相比,8 mg·L-1处理gst表达量显著上升7.6倍(P<0.05),随后急剧降低。0.25 mg·L-1处理gst基因表达量变化趋势则较为平缓,其最大值仅为对照的3.2倍。
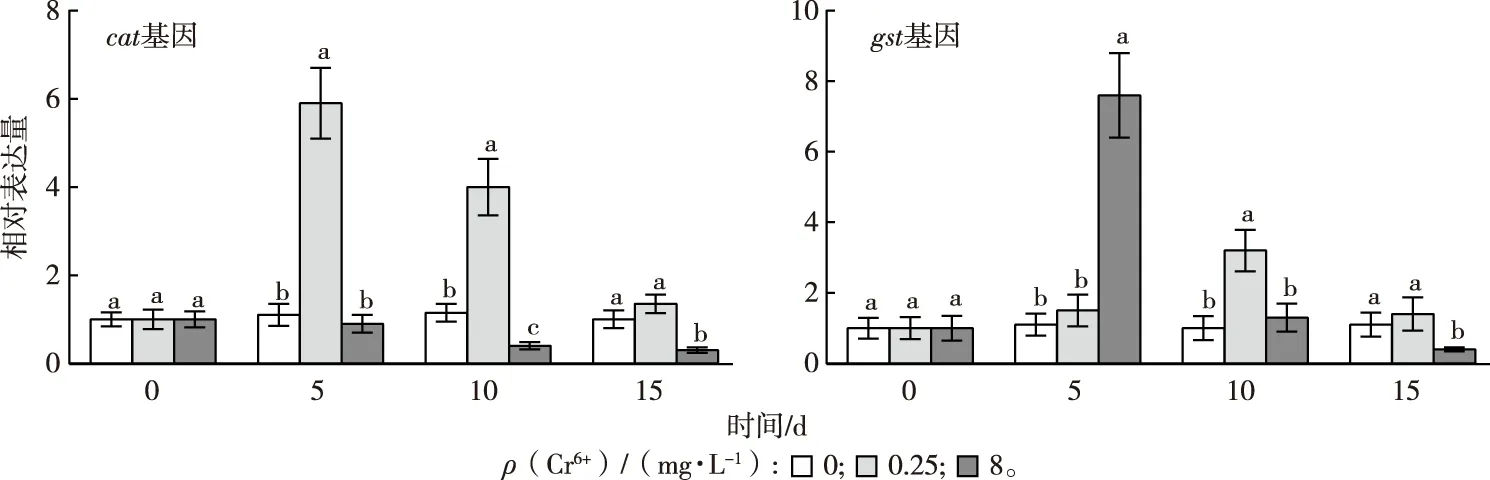
同一分图中,直方柱上方英文小写字母不同表示同一暴露时间不同处理间某种基因相对表达量差异显著(P<0.05)。
2.2.3卵巢MDA含量变化
不同浓度Cr6+胁迫后,红树蚬性腺MDA含量随时间变化见图4。

直方柱上方英文小写字母不同表示同一处理不同暴露时间之间MDA含量差异显著(P<0.05)。
如图4所示,对照处理红树蚬性腺MDA含量相对稳定。除0.25 mg·L-1处理外,其他处理MDA含量在前期(5 d时)均受到显著诱导(P<0.05),其中4和8 mg·L-1处理诱导程度更为强烈,与对照相比,其MDA含量增加1.7~3.1倍。随着暴露时间增加,0.25 mg·L-1处理MDA含量逐渐恢复至对照水平,而1、4和8 mg·L-1处理红树蚬性腺MDA含量恢复能力则与Cr6+胁迫浓度呈负相关。
2.3 卵巢雌激素受体er基因和卵黄蛋白原vtg基因表达量变化
红树蚬卵巢er和vtg基因表达水平见图5。在试验期间,各处理红树蚬er和vtg基因表达量总体呈先升高后降低趋势。对照er和vtg基因表达量在试验前期(5 d时)均出现明显上调,分别为0 d时的3.5和2.8倍,这表明红树蚬正处于成熟期后期。不同浓度Cr6+胁迫处理均显著抑制2个基因的表达(P<0.05),0.25 mg·L-1处理er和vtg基因表达量峰值分别为0 d时的3.2和1.9倍;而8 mg·L-1处理er和vtg基因表达量峰值则仅为0 d时的1.2倍和90%。在试验中、后期(10、15 d时),8 mg·L-1处理2个基因表达量均显著低于对照(P<0.05),这说明Cr6+浓度越高,其对er和vtg基因表达的抑制作用越明显。

同一分图中,直方柱上方英文小写字母不同表示同一暴露时间不同处理间某种基因相对表达量差异显著(P<0.05)。
3 讨论
近年来我国海洋环境污染日益严重,尤以重金属污染问题较为突出,而海洋贝类属于滤食性生物,其生活习性和生理特点决定贝类易于累积重金属[16]。部分海域一些贝类Cd和As污染的健康风险超出可接受水平[17];厦门养殖贝类中,只有牡蛎没有受到污染,缢蛏、毛蚶、文蛤和花蛤均受到轻度Pb、Hg和Cu污染以及严重As污染,花蛤和文蛤还受到轻度Cr污染[18]。
性腺指数GSI又称生殖腺指数,是反映性成熟度的一个指标,常用来表示卵巢发育或睾丸发育来衡量动物的性成熟程度[19]。笔者研究发现,Cr6+暴露会对红树蚬性腺发育和功能产生一定干扰,不同浓度Cr6+胁迫对红树蚬性腺指数产生影响的程度不同,其中,较高和高浓度(4和8 mg·L-1)Cr6+胁迫对红树蚬GSI造成的影响更为显著(P<0.05)。各处理GSI均随试验时间的增加而逐渐降低,这表明Cr6+在性腺中的累积可能影响红树蚬卵巢发育,并损伤其正常组织。
CAT和GST活性以及MDA含量是研究生物对各种胁迫影响效应中受到密切关注的生理指标[20]。抗氧化酶CAT可以清除氧自由基保护机体,能间接反映生物体内自由基含量变化,GST具有解毒和抑制脂质过氧化作用[21]。笔者研究发现,0.25和1 mg·L-1处理红树蚬性腺CAT活性在Cr6+暴露前期(5 d时)达到最大值,且较0 d时显著上升(P<0.05),而4和8 mg·L-1处理对CAT活性的诱导作用有限,甚至随着试验时间的增长而产生抑制作用。随着暴露时间的增长,低浓度Cr6+处理酶活性比高浓度处理更快恢复到对照水平。Cr6+胁迫浓度越高,红树蚬卵巢CAT活性恢复就越困难,Cr6+胁迫浓度与CAT活性恢复力呈负相关。在试验前、中期(5和10 d时),0.25 mg·L-1处理卵巢cat基因表达水平比对照显著提高(P<0.05),随后恢复至对照水平,但Cr6+胁迫浓度越高,其表达水平就越难恢复。红树蚬卵巢GST活性变化较CAT有一定滞后性,0.25 mg·L-1处理GST活性在试验前期(5 d时)无明显变化,而除8 mg·L-1处理外,其他处理GST活性在试验中期皆受到显著诱导(P<0.05),且最大值出现在4 mg·L-1处理的试验中期(10 d时)。当红树蚬卵巢GST活性较低时,CAT会表现出一定活性,以维持产生氧自由基与保护抗氧化防御系统之间的平衡,此与赖廷和等[8]研究结果相似。有研究[22]认为超氧化物歧化酶(SOD)催化O2-的歧化反应不是CAT底物H2O2的唯一来源,H2O2也可能来自氨基酸或细胞色素P450氧化酶的激活,这可能是初期CAT活性较高的原因。在笔者试验后期,8 mg·L-1处理CAT和GST活性受到显著抑制(P<0.05),而同时卵巢cat和gst基因表达水平与对照相比显著降低(P<0.05),这可能是由于高浓度Cr6+暴露下,红树蚬卵巢内产生过多H2O2,超出了机体清除能力,从而抑制了相关基因的表达,这表明性腺组织已受到Cr6+的严重破坏。
MDA是脂质过氧化的产物,对细胞膜有很强的破坏作用,其含量可反映机体内自由基产生量及对机体的影响程度。BEBIANNO等[23]提出高MDA含量是抗氧化防御机能丧失的结果。生物体在Cr6+胁迫后会导致组织MDA含量增加,进而造成肝脏和肾脏硫代巴比妥酸反应产物(TBARS)水平升高,损伤肝、肾功能[24]。笔者试验发现,与其他处理不同,8 mg·L-1处理红树蚬卵巢gst基因表达量最大值出现在试验前期(5 d时),且此时GST活性也显著高于对照(P<0.05),这表明机体可能通过加强gst基因表达产生更多GST,以便清除迅速积累的自由基和脂质过氧化产生的有毒物质,此与ZHANG等[25]的研究结果相似。MDA含量峰值出现在8 mg·L-1处理15 d时,并且在整个试验过程中,高浓度Cr6+处理MDA含量显著高于低浓度处理,这表明过高浓度的Cr6+已破坏生物体抗氧化系统,导致机体活性氧迅速累积,从而加剧膜脂过氧化作用。另外,受到Cr6+胁迫后,红树蚬卵巢MDA含量无法恢复至最初水平,说明Cr6+对红树蚬MDA含量产生不可逆影响。
卵黄蛋白原(VTG)常被用作检测内分泌干扰物的生物标志物[26]。OSADA等[12]研究发现双壳贝类VTG在卵巢中合成并且在er和vtg基因的介导下由雌二醇(E2)调控,因此er和vtg基因表达量在生物体生殖发育中发挥重要作用。笔者试验发现,对照er和vtg基因表达量在试验初期(5 d时)均出现明显上调,分别为0 d时的3.5和2.8倍,这表明红树蚬正处于成熟期后期,er基因表达量变化与性腺发育相吻合,这与MATSUMOTO等[27]对牡蛎和扇贝卵巢的研究结果相似。在整个试验中,8 mg·L-1处理vtg和er基因表达量显著低于0.25 mg·L-1和对照处理。这可能是由于高浓度Cr6+进入红树蚬体内后,能够通过影响性腺激素含量进而影响激素调控的er和vtg等相关基因的表达,而er基因含量的变化又会导致依赖er基因介导的一系列基因的表达发生变化,最终对红树蚬产生明显生殖毒性效应。
4 结论
以红树蚬为试验对象,研究了不同浓度Cr6+暴露下红树蚬卵巢中氧化逆境标志物及生殖基因表达的变化。研究结果表明,Cr6+对红树蚬卵巢具有组织损伤和代谢干扰效应,并且高浓度Cr6+能对红树蚬造成明显生殖毒害作用。红树蚬由于其分布地域的特殊性,目前对该物种的研究与其他双壳贝类相比还较少,该研究可为进一步研究Cr6+对红树蚬生殖毒性机制提供科学数据。下一步将开展Cr6+暴露对雄性红树蚬性腺的影响研究。
