抗虫-耐除草剂转基因玉米种植对根际土壤细菌和真菌群落的影响
2020-04-03周丰武吴少松钟文辉
洪 鑫,韩 成,孔 帆,周丰武,吴少松,钟文辉①,刘 标
(1.南京师范大学地理科学学院江苏省物质循环与污染控制重点实验室,江苏 南京 210023;2.南京师范大学环境学院,江苏 南京 210023;3.生态环境部南京环境科学研究所国家环境保护生物安全重点实验室,江苏 南京 210042)
复合性状转基因作物包含多个外源基因的转入,外源基因间或其与植物原有基因间可能存在关联、非关联和代谢等作用,改变蛋白质的表达水平,对生物产生不利影响或导致其他非预期反应,加大复合性状转基因作物对农田生态系统的潜在风险[1]。姜伟丽等[2]研究发现抗虫耐除草剂转基因棉花田中刺吸式害虫数量显著低于Bt棉田害虫数量。在转基因作物生长过程中,外源基因表达产物主要通过植株残体(含花粉)和根系分泌物进入土壤[3]。植物根系生长伴随整个作物季,外源基因表达产物将会直接与根际土壤环境接触,吸附或结合在黏土颗粒、腐殖质组分或有机矿物复合物表面并在土壤中积累,从而影响土壤微生物群落变化[4]。江帆等[5]研究发现,抗虫耐除草剂转基因玉米雄穗的CP4 EPSPS蛋白表达量比耐除草剂玉米显著高31.6%,而抗虫玉米叶片中Cry1Ac蛋白表达量比抗虫耐除草剂玉米显著高129%,在喷施多倍草甘膦的条件下,抗虫耐除草剂玉米与耐除草剂玉米株高无显著差异,但是均显著高于抗虫玉米。可见,转基因作物种植可能会对土壤生态系统产生影响。另外,多种外源基因转入可改变作物代谢途径,其根系分泌物组成及含量也会发生变化,并影响根际微生物群落。据报道,转Bt+CpTI基因棉花比亲本棉花能分泌更多的赖氨酸和甲硫氨酸,而转Bt基因棉花与其亲本相比,根系分泌物组成相同,但是酪氨酸、亮氨酸等含量有显著差异[6]。目前,大部分研究者主要集中关注单一性状转基因作物对土壤根际微生物的影响[7],复合性状转基因作物如何影响根际土壤微生物群落的报道鲜见。
土壤酶活性与土壤微生物活性密切相关,在催化有机质分解和养分循环中发挥重要作用,常常被用作衡量微生物活性和土壤肥力的指标[8]。荧光素二乙酸酯(FDA)水解酶是土壤中能催化水解FDA的一类非专一性酶,包括蛋白酶、酯酶和脂肪酶等,其与土壤微生物活性、土壤各养分指标均显著相关,能够很好地反映土壤微生物活性和有机质转化[9],因而被广泛应用于土壤质量评价。以往报道常采用平板培养[10]、变性梯度凝胶电泳[11]等技术研究转基因作物对土壤微生物的影响;而平板培养技术仅能研究土壤微生物中的极少部分,变性梯度凝胶电泳技术也有检出限低的缺点,不能全面评价微生物群落。近年来,定量聚合酶链式反应(PCR)技术具有实时、准确等特点,高通量测序技术能全面解析复杂土壤样品中微生物群落,在土壤微生物学和生物安全研究领域得到广泛应用[12]。
该研究基于温室微区实验,采集抗虫耐除草剂复合性状转基因玉米“双抗12-6”及其非转基因亲本玉米“郑单958”拔节期和成熟期根际土壤,测定土壤FDA水解酶活性以表征土壤微生物活性,采用定量PCR、Illumina Hiseq高通量测序技术分析根际土壤细菌和真菌群落丰度、组成和多样性,研究抗虫耐除草剂复合性状转基因玉米对根际土壤细菌和真菌群落的影响。上述研究结果可为抗虫耐除草剂转基因玉米风险评估提供实验数据支持。
1 材料与方法
1.1 玉米微区种植及根际土壤采集
选用转cry1Ab/cry2Aj和G10evo-spsps基因抗虫耐除草剂玉米“双抗12-6”(GM)及非转基因玉米品种“郑单958”(CK),种植于南京师范大学仙林校区温室微区内,微区由1 m×1 m×0.5 m混凝土筑成,处理间留有0.5 m隔离带,各重复之间设置0.1 m厚隔层,每个处理设置4个重复,每个微区种植4株玉米,微区内随机填充旱地土壤。供试土壤填充前采用风干、粉碎、机械研磨和机械混匀等方式确保土壤均匀,并采用四分法采集4份土壤测定土壤基本理化性质,保存于-20 ℃条件下。供试土壤预处理前所测理化性质、微生物活性及数量的变异系数范围为0.3%~4.8%,土壤均一性较好。玉米种植期为2018年5月至8月,以玉米幼苗破土记为0 d,共生长105 d。温室内设置降温系统,控制室温为18~35 ℃。玉米种植前每个微区施基肥(包括发酵后鸡粪1 kg,复合肥60 g)并混匀,生长期根据每周玉米长势施肥(共施复合肥240 g、尿素390 g),平均每2 d浇水1次。于玉米幼苗破土10 d后,使用试剂盒(QuickStixTMKIT forCry1AbCorn Leaf & Seed, EnviroLogix,USA)法检测玉米苗外源蛋白表达状况,确保供试转基因玉米具有外源蛋白表达且非转基因玉米无外源蛋白表达。
于玉米生长60 d时拔节期(营养生长代表时期,S1)、105 d时成熟期(生殖生长代表时期,S2)选取长势一致的玉米植株进行破坏性采样,收集根际土壤[13]。土壤样品及时分离过筛,一部分土壤存于4 ℃条件下,用于土壤理化性质和微生物活性指标测定;一部分土壤于-80 ℃条件下保存,用于微生物群落测定。
1.2 土壤理化性质和FDA水解酶测定
土壤pH按w(土)∶V(水)=1∶2.5摇匀静置后测定;土壤有效磷含量采用碳酸氢钠浸提-钼锑抗分光光度法测定;土壤速效钾含量采用乙酸铵-原子吸收法测定;土壤全氮含量采用开氏消煮法[12]测定;土壤有机碳和可溶性有机碳含量采用TOC自动分析仪(Shimadzu TOC-L,Japan)[14]测定。FDA水解酶采用荧光素比色法[15]测定。
1.3 土壤总DNA提取及微生物丰度测定
每个土壤样品称取0.5 g鲜土,采用试剂盒(FastDNA®Spin Kit for Soil,MP,Biomedicals, USA)法提取土壤总DNA。采用NanoDrop 2000分光光度计(Thermo,USA)测定DNA溶液的纯度和浓度,DNA溶液于-80 ℃条件下保存备用。采用实时荧光定量PCR技术测定土壤细菌16S rRNA基因和真菌ITS基因丰度分别表征细菌和真菌群落丰度。细菌16S rRNA基因扩增采用引物对515F(5′-GTGNCAGCMGCCGCGGTAA-3′)/926R(5′-CCGYCAATTYMTTTRAGTTT-3′)[16],反应体系体积为20.0 μL,包含10.0 μL 2 × SYBR Premix Ex Taq、0.3 μL上下游引物、1.0 μL稀释10倍后DNA样品和8.4 μL灭菌超纯水。反应程序为:95 ℃预变性,3 min;40个循环(95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸20 s),每轮循环结束后采集荧光数据,并采用溶解曲线分析扩增产物的特异性;采用含有16S rRNA基因的浓度为6.53×102~6.53×108copies·μL-1的标准质粒构建标准曲线,扩增效率为85.3%(R2为0.994)。真菌ITS基因扩增采用引物对ITS1F(CTTGGTCATTTAGAGGAAGTAA)/ITS2R(GCTGCGTTCTTCATCGATGC)[17],反应体系体积为20.0 μL,包含10.0 μL 2 × SYBR Premix Ex Taq、0.3 μL上下游引物、1.0 μL稀释10倍后DNA样品和8.4 μL灭菌超纯水。反应程序为:95 ℃预变性,5 min;40个循环(95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s),每个循环结束后采集荧光数据,并采用溶解曲线分析扩增产物的特异性;采用含有ITS基因的浓度为1.83×102~1.83×108copies·μL-1的标准质粒构建标准曲线,扩增效率为101.5%(R2为0.994)。每个样品共3个技术重复并设置阴性对照。
1.4 高通量测序分析
采用515F/926R和ITS1F/ITS2R分别对细菌16S rRNA基因V4 + V5区和真菌ITS基因ITS1区进行扩增,并委托广东美格基因科技有限公司完成高通量测序。测序采用Illumina Hiseq 2500测序平台,利用双末端测序Paire-end方法,从每条序列的5′和3′端产生250 bp的reads,对原始数据进行处理获得有效数据;将PE reads拼接成Tags,再次过滤获得目标片段,通过QIIME[18]平台在97%相似水平上对OTU进行分类,并基于Silva[19]和UNITE[20]数据库分别对16S rRNA基因和ITS基因进行OTU分类注释。
细菌样品共获得411 226条有效序列数,CK处理S1和S2时期各获得22 695~28 405和23 266~36 758条有效序列数,GM处理S1和S2时期分别获得16 007~25 165和21 634~29 628条有效序列数。真菌样品共获得1 519 764条有效序列数,CK处理S1和S2时期分别获得75 391~105 131和94 265~133 401条有效序列数,GM处理S1和S2时期分别获得70 194~90 973和86 665~104 663条有效序列数。选取细菌和真菌群落的门、属数量以及Chao1、Shannon指数分别表征细菌和真菌群落的α多样性;采用Bray-Curtis距离和多变量统计学方法主坐标分析(principal coordinates analysis,PCoA)比较不同样品间细菌群落结构差异;选取门、属水平上相对丰度大于1%的细菌和真菌群落分析其群落组成。
1.5 数据处理
采用SPSS 18.0软件(IBM,USA)进行数据分析,采用单因素方差(Tukey检验,P<0.05,n=4)分析比较不同样品间土壤理化性质、微生物活性、丰度和多样性的差异;采用双因素方差(Tukey检验)分析比较玉米品种或生长时期对土壤理化性质、微生物群落活性、多样性和门水平上群落组成差异的影响力大小。采用独立样本t检验分析比较玉米品种或生长时期属水平上微生物群落组成的差异。
2 结果与分析
2.1 抗虫耐除草剂转基因玉米对根际土壤理化性质、微生物活性及数量的影响
根际土壤pH约为7.2,呈中性。单因素方差分析显示,GM处理S2时期根际土壤DOC含量比GM处理S1时期显著高40.1%(P<0.05),S1时期GM和CK处理土壤C/N比值比S2时期2个处理显著提高17.2%和19.3%(P<0.05),与CK处理相比,GM处理均未显著影响土壤C/N比值和DOC含量;4个处理间根际土壤pH,TOC、TN、AP和AK含量均无显著差异。双因素方差分析显示,玉米品种未显著影响土壤理化性质,但生长时期显著影响根际土壤DOC(P< 0.01)、TN含量(P<0.01)和C/N比值(P<0.001);根际土壤AP含量(P<0.05)显著受到玉米品种和生长时期的交叉影响。根际土壤FDA水解酶活性为5.24~6.81 μg·g-1·h-1,细菌16S rRNA基因丰度为6.26×1010~7.65×1010copies·g-1,真菌ITS基因丰度为2.72×108~5.20×108copies·g-1。单因素方差分析显示,根际土壤FDA水解酶活性、细菌16S rRNA基因和真菌ITS基因丰度在各处理间均无显著差异。双因素方差分析显示,细菌16S rRNA基因丰度显著受生长时期影响(P<0.05),FDA水解酶活性和真菌ITS基因丰度未显著受到玉米品种或生长时期的影响(表1)。
表1 玉米根际土壤理化性质、微生物活性和数量
Table 1 Maize rhizospheric soil physicochemical properties, microbial activity and community abundance
数据为平均值±标准误差(n=4)。同一列数据后英文小写字母不同表示2个生长时期不同处理间某指标显著差异,ND表示未测定,分析方法为单因素方差分析(Tukey检验),P<0.05,n=4。采用双因素方差分析(Tukey检验)对不同品种处理和不同时期之间做比较分析,其中,F为膨胀系数,表示影响力大小。*表示P<0.05,**表示P<0.01,***表示P<0.001。A为丰度,B为细菌16S rRNA基因,C为真菌ITS基因,D为FDA水解酶活性。
2.2 抗虫耐除草剂转基因玉米对根际土壤细菌及真菌群落α多样性的影响
细菌群落在门和属水平上分类的有效数量分别为27~29和251~264。单因素方差分析显示,CK处理S1时期细菌群落门、属水平上的数量均显著高于GM处理S2时期(P<0.05);GM处理S1时期Shannon指数显著高于CK处理S2时期(P<0.05);细菌群落Chao1指数在各处理间无显著差异。双因素方差分析显示,细菌群落门(P<0.01)和属(P<0.05)水平上的数量、Chao1指数(P<0.05)、Shannon指数(P<0.01)均显著受生长时期的独立影响。真菌群落在门和属水平上分类的有效数量分别为6~7和156~179。单因素方差分析显示,真菌群落门和属水平上的数量、Chao1指数以及Shannon指数在各处理间均无显著差异。双因素方差分析显示,真菌群落门和属水平上的数量、Chao1指数以及Shannon指数均未显著受玉米品种或生长时期的影响(表2)。
2.3 抗虫耐除草剂转基因玉米对根际土壤细菌和真菌群落β多样性的影响
细菌群落PCoA分析见图1(a)。第1和2主坐标解释度分别为55.27%和13.59%,样品在第1、2主坐标排序中聚成2组,GM处理S1时期和CK处理S1时期聚成1组,GM处理S2时期和CK处理S2时期聚成1组,2组的Bray-Curtis相似度指数分别为0.178和0.180(P>0.05),说明GM处理S1时期和CK处理S1时期之间、GM处理S2时期和CK处理S2时期之间群落结构相似。GM处理S1和S2时期、CK处理S1和S2时期的Bray-Curtis相似度指数分别为0.420和0.556(P< 0.05),说明GM处理S1和S2时期之间、CK处理S1和S2时期之间的群落结构差异显著。真菌群落PCoA分析见图1(b)。第1、2主坐标解释度分别为60.70%和12.02%,样品在第1、2主坐标排序中均没有聚类,S1时期GM和CK处理、S2时期GM和CK处理、CK处理S1和S2时期以及GM处理S1和S2时期的Bray-Curtis相似度指数分别为0.277、0.081、0.126和0.213(P>0.05),说明各处理真菌群落结构相似。
表2 玉米根际土壤细菌和真菌群落α多样性
Table 2 Community diversity of bacteria and fungi in maize rhizosphere soils

处理细菌16S rRNA基因真菌ITS基因PGChao1指数Shannon指数PGChao1指数Shannon指数GM_S129±0ab256±2ab1 567±34a7.56±0.18a6±0a179±5a936±26a5.03±0.63aCK_S128±0a264±3a1 572±26a7.43±0.21ab6±0a156±11a865±38a3.67±0.81aGM_S227±0b251±3b1 479±60a5.95±0.64ab6±0a158±8a902±41a3.65±0.76aCK_S227±0ab253±1ab1 431±50a5.73±0.43b7±0a170±9a863±37a4.39±0.54a品种0.2733.3660.2470.1780.4290.4022.2980.199时期11.000∗∗8.087∗6.588∗16.232∗∗0.4290.1200.2640.229品种×时期0.0911.0180.3570.0103.8574.0720.1912.292
数据均为平均值±标准误差(n=4)。同一列数据后英文小写字母不同表示2个生长时期不同处理间某指标显著差异,分析方法为单因素方差分析(Tukey检验),P<0.05,n=4。采用双因素方差分析(Tukey检验)对不同品种处理和不同时期之间做比较分析,其中,F为膨胀系数,表示影响力大小。*表示P<0.05,**表示P<0.01,***表示P<0.001。P和G为门水平上和属水平上分类的有效数量。
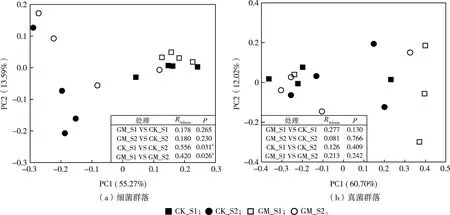
RAdonis为非参数多因素方差分析(nonparametric MANOVA)指数,基于Bray-Curtis距离计算得到;*表示2个处理间差异显著。
2.4 抗虫耐除草剂转基因玉米对根际土壤细菌和真菌群落组成的影响
共获取12个门水平上相对丰度大于1%的细菌类群,有奇古菌门(Thaumarchaeota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria) 5个优势细菌群落,占总细菌群落的80%以上〔图2(a)〕。其中,奇古菌门相对丰度最高,占总细菌群落的13.9%~44.6%。其次是变形菌门,其相对丰度占总细菌群落的17.9%~31.0%。双因素方差分析显示,放线菌门显著受玉米品种或生长时期的独立影响;奇古菌门、变形菌门、酸杆菌门等均显著受生长时期的独立影响。共获取3个门水平上相对丰度大于1%的真菌类群,其中,子囊菌门(Ascomycota)相对丰度占总真菌群落的38%~73%〔图2(b)〕。双因素方差分析显示,子囊菌门、担子菌门(Basidiomycota) 未显著受玉米品种或生长时期的独立影响;接合菌门(Zygomycota)受玉米品种和生长时期的交叉影响。
选取细菌属水平上相对丰度大于1%且变化量绝对值总和位居前10位的物种进行独立样本t检验分析(表3)。表3显示,S1时期GM处理Candidatus_Nitrososphaera相对丰度比CK处理显著降低0.98%;S2时期GM处理Candidatus_Nitrososphaera相对丰度比CK处理显著降低6.02%;其中,Marmoricola是放线菌门属水平上相对丰度变化最大的物种,在S1和S2时期,GM处理Marmoricola相对丰度分别比CK处理高1.46%和1.03%。CK处理S2时期Candidatus_Nitrocosmicus、Candidatus_Nitrososphaera相对丰度分别比S1时期显著升高20.76%和6.09%,而CK处理S2时期MND1、Sphingomonas、Flavisolibacter等相对丰度显著低于S1时期。
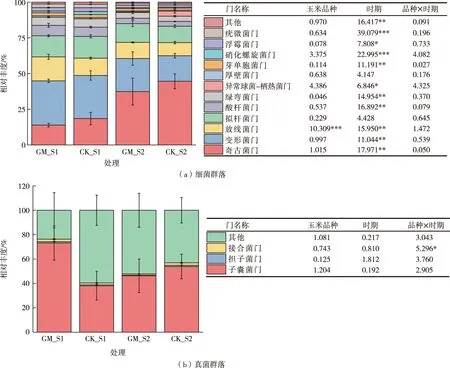
*表示P<0.05,**表示P<0.01,***表示P<0.001。
表3 属水平上细菌和真菌相对丰度变化量
Table 3 Changes in relative abundance of bacterial and fungal taxa at the genus level
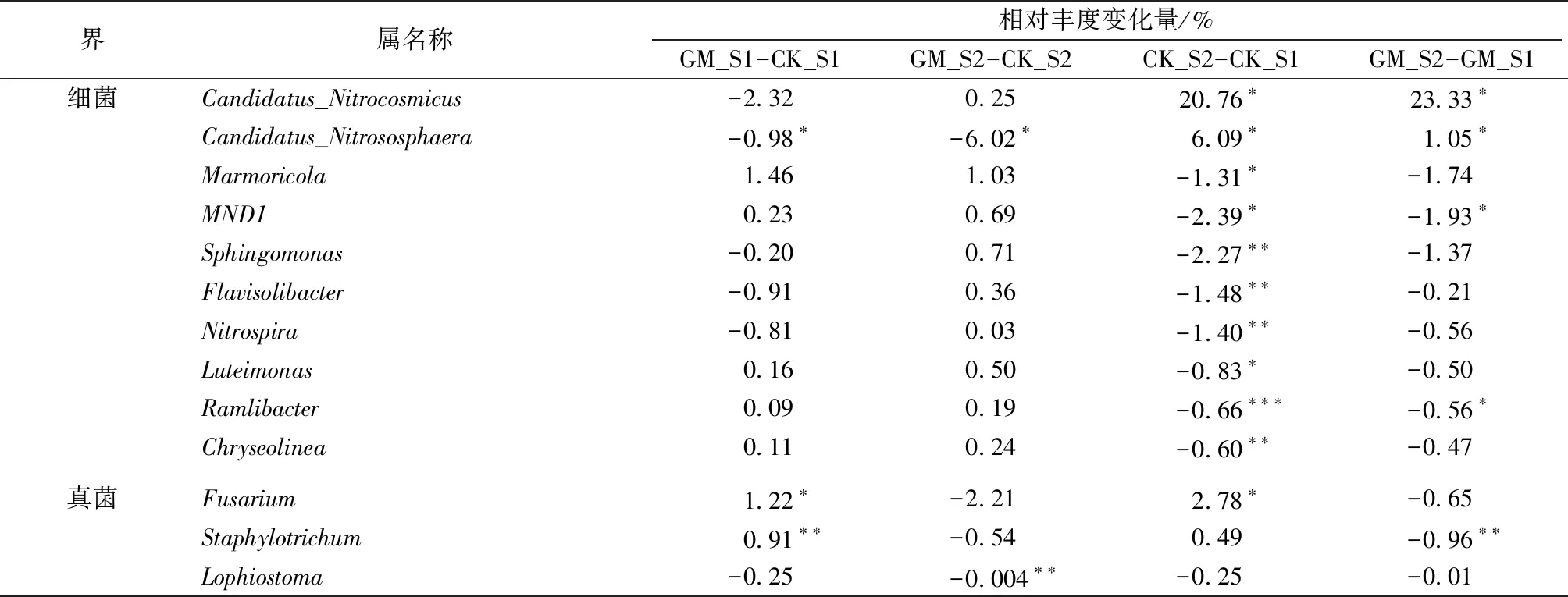
界属名称相对丰度变化量/%GM_S1-CK_S1GM_S2-CK_S2CK_S2-CK_S1GM_S2-GM_S1细菌Candidatus_Nitrocosmicus-2.320.2520.76∗23.33∗Candidatus_Nitrososphaera-0.98∗-6.02∗6.09∗1.05∗Marmoricola1.461.03-1.31∗-1.74MND10.230.69-2.39∗-1.93∗Sphingomonas-0.200.71-2.27∗∗-1.37Flavisolibacter-0.910.36-1.48∗∗-0.21Nitrospira-0.810.03-1.40∗∗-0.56Luteimonas0.160.50-0.83∗-0.50Ramlibacter0.090.19-0.66∗∗∗-0.56∗Chryseolinea0.110.24-0.60∗∗-0.47真菌Fusarium1.22∗-2.212.78∗-0.65Staphylotrichum0.91∗∗-0.540.49-0.96∗∗Lophiostoma-0.25-0.004∗∗-0.25-0.01
采用独立样本t检验对各处理做比较分析,*表示P<0.05,**表示P<0.01,***表示P<0.001。如GM_S1-CK_S1表示S1时期GM处理属水平相对丰度减去CK处理属水平相对丰度。
GM处理S2时期Candidatus_Nitrocosmicus、Candidatus_Nitrososphaera相对丰度分别比S1时期显著升高23.33%和1.05%,而GM处理S2时期MND1、Ramlibacter相对丰度显著低于S1时期。选取真菌属水平上相对丰度大于1%的物种进行独立样本t检验分析(表3)。S1时期GM处理Fusarium、Staphylotrichum相对丰度显著高于CK处理。S2时期GM处理Lophiostoma相对丰度显著低于CK处理。CK处理S2时期Fusarium相对丰度显著高于S1时期。GM处理S2时期Staphylotrichum相对丰度显著低于S1时期。
3 讨论
3.1 抗虫耐除草剂转基因玉米对根际土壤微生物活性的影响
FDA水解酶能够很好地反映土壤微生物活性和土壤质量变化,是土壤生物学重要指标之一[21]。笔者研究发现,抗虫耐除草剂转基因玉米未显著改变根际土壤理化性质和FDA水解酶活性,成熟期根际土壤可溶性有机碳和全氮含量显著高于拔节期根际土壤(表1)。孙彩霞等[22]通过短期种植转Bt基因水稻和棉花,发现转基因性状均未显著影响土壤全碳、全氮和速效磷等理化性质,笔者研究结果与之相似。景小鹏等[23]研究发现与非转基因玉米相比,转Bt基因玉米未显著影响根际土壤全氮含量,但是在特定时期会显著影响根际土壤有机质、全磷等其他理化性质。SUN等[4]研究指出转Bt基因棉花组织可能会刺激土壤微生物活性,从而使土壤脲酶、转化酶、纤维素酶活性普遍提高。SHEN等[24]研究表明转基因棉花和非转基因棉花的根际土壤脲酶和蛋白酶活性等没有显著差异,笔者研究结果与之有相似之处。笔者研究认为在玉米种植过程中追施尿素和复合肥,可能是导致玉米成熟期根际土壤可溶性有机碳和全氮含量显著高于拔节期的主要原因。
3.2 抗虫耐除草剂转基因玉米对根际土壤细菌群落的影响
细菌最多可占土壤微生物总量的90%,是土壤微生物组成中最大的类群,对土壤生态系统的作用至关重要[25]。根际土壤细菌群落非常敏感,可能受作物种类、植株生长时期和耕种管理方式等生物和非生物因素的影响[26]。笔者研究发现,抗虫耐除草剂转基因玉米未显著影响根际土壤细菌群落丰度和多样性,而生长时期对细菌群落丰度和多样性有显著影响(表1)。刘凯等[27]研究发现转Bt基因玉米未显著影响根际土壤细菌、氨化细菌和好氧性固氮菌数量。BARRIUSO等[28]发现转Bt基因玉米与亲本玉米根际细菌丰度和丰富度均无显著差异,对细菌群落结构的影响较小,而植物生长时期或环境因素可能对微生物群落产生更显著的影响。GRIFFITHS等[29]研究发现转Bt基因玉米对土壤微生物有一定影响,但是受土壤类型和植株生长时期的影响更大,这可能是因为不同玉米株系间自然变异所致,笔者研究结果与之相似。
笔者研究发现奇古菌门、变形菌门、放线菌门、拟杆菌门和酸杆菌门是细菌群落的优势种群,抗虫耐除草剂转基因玉米对土壤细菌放线菌门有显著影响(图2)。放线菌广泛存在于土壤中,对土壤有机物矿化有着重要作用[30]。笔者研究中GM处理土壤样品总有机碳(TOC)含量在2个时期均高于CK处理,其中在S1时期达到显著水平(t检验,P<0.05),环境因子的微小变化可能对土壤微生物有显著影响,这可能是GM处理放线菌门相对丰度显著高于CK处理的原因(图2)。对细菌同时期不同处理属水平上物种进行分析,GM处理Candidatus_Nitrososphaera相对丰度在2个时期分别比CK处理显著低0.98%和6.02%,GM处理Marmoricola相对丰度在2个时期分别比CK处理高1.46%和1.03%(表3),这可能是造成放线菌门产生品种差异的主要物种。土壤可溶性有机碳(DOC)可直接被土壤微生物利用,笔者研究中S2时期根际土壤DOC含量显著高于S1时期,这可能是S2时期2个处理放线菌门相对丰度显著高于S1时期的主要原因。BARRIUSO等[28]连续4 a种植转Bt基因玉米,发现根际土壤细菌中优势种群主要是变形菌门、酸杆菌门和放线菌门,笔者研究与之有所不同。奇古菌门主要组成部分是氨氧化古菌,与土壤硝化作用密切相关[31]。笔者研究中各处理奇古菌门相对丰度较高,可能是由于在玉米生长过程中多次施肥导致,S2时期根际土壤全氮含量显著高于S1时期(P<0.01),这可能是S2时期2个处理奇古菌门相对丰度显著高于S1时期的主要原因。对细菌同一处理不同时期属水平上差异物种变化进行分析,S2时期Candidatus_Nitrocosmicus和Candidatus_Nitrososphaera相对丰度分别比S1时期显著增加20.76%~23.33%和1.05%~6.09%(表3),S2时期根际土壤细菌Chao1指数(P<0.05)和Shannon指数(P<0.01)均显著低于S1时期,说明大量施加氮肥会增加物种丰度,降低物种多样性,笔者研究结果与之相符。
3.3 抗虫耐除草剂转基因玉米对根际土壤真菌群落的影响
真菌是土壤微生物区系的重要组成部分,具有较高的生物活性[32]。根际真菌群落的组成和功能具有很强的动态性,受植物生长阶段、土壤类型、年际和品种类型的影响较小[33]。笔者研究发现,抗虫耐除草剂转基因玉米未显著影响根际土壤真菌群落丰度、多样性和门水平上群落组成。LEE等[34]发现转基因水稻根际真菌群落丰度和多样性与亲本水稻间无显著差异,笔者研究结果与之相似。王敏等[35]研究发现转Bt基因玉米未显著影响根际土壤真菌数量,Bt玉米对根际细菌群落的影响大于真菌群落,笔者研究结果与之相似。LI等[36]研究发现转Bt基因棉花未显著影响根际土壤真菌群落丰度和多样性,真菌群落多样性显著受生长时期的影响,根系微环境会显著影响真菌群落结构。目前大多数关于土壤真菌群落的研究表明,转基因作物对土壤真菌的影响与其亲本相似。通过对真菌属水平上差异物种变化进行研究发现,仅Fusarium、Staphylotrichum和Lophiostoma属有显著差异。相较于细菌,各处理真菌属水平物种变化量较小,此与前人研究结果相似。
4 结论
近年来,由于转基因作物在世界范围内的释放以及对传统作物的替代,转基因作物对环境和人类健康的潜在风险一直备受关注,许多风险评估都集中于转基因作物对土壤微生物的影响。笔者研究发现,抗虫耐除草剂转基因玉米未显著影响根际土壤真菌群落,对细菌群落有一定程度的影响,但是受植株生长时期的影响更显著。目前,转基因作物使用的基因种类繁多,尚无通用的风险评估标准,研究转基因作物对土壤生态系统的影响还需要长期连续监测,确定外源基因导入所带来的影响,为转基因作物推广提供实验数据。
