Regesi再生硅、Bio-Oss骨粉对成骨细胞增殖、 成骨分化作用的影响
2020-04-02贾琰张保荣
贾琰 张保荣


Regesi再生硅、Bio-Oss骨粉對成骨细胞增殖、
成骨分化作用的影响
贾 琰1 张保荣2
1.潍坊医学院口腔医学院,山东潍坊 261053;2.航空总医院口腔诊疗中心,北京 100012
[摘要] 目的 观察小鼠成骨细胞(MC3T3-E1)分别在Regesi再生硅和Bio-Oss骨粉材料上的生长情况,分析Regesi再生硅材料、Bio-Oss骨粉对小鼠成骨细胞增殖、成骨分化的影响。 方法 将实验分为3组,分别为Regesi再生硅实验组、Bio-Oss骨粉实验组和对照组,将两种材料分别放置于24孔板中,对照组为空白,将细胞分别接种在各组24孔板上,培养1、4、7 d时倒置显微镜观察细胞生长情况;培养1、4、7 d时MTT检测细胞的增殖活性;培养7 d时碱性磷酸酶(ALP)试剂盒测定成骨细胞的OD值来分析ALP活性;培养7 d时Rt-PCR方法测定3组细胞的Runx2和Osterix(OSX)基因表达情况。 结果 显微镜下观察,各组细胞随着时间增加而数量增加;培养7 d时与对照组比较,Regesi再生硅组细胞增殖水平升高(P < 0.05),ALP活性、Runx2、OSX mRNA表达水平升高(P < 0.05),培养7 d时Bio-Oss骨粉组细胞增殖水平降低(P < 0.05),ALP活性、Runx2、OSX mRNA的表达差异无统计学意义(P > 0.05)。结论 Regesi再生硅能促进MC3T3-E1细胞的增殖、分化水平;Bio-Oss骨粉能减缓细胞增殖,但成骨分化能力与单纯成骨细胞无明显差异。
[关键词] 增殖;成骨分化;Regesi再生硅;Bio-Oss骨粉;MC3T3-E1细胞
[中图分类号] R318 [文献标识码] A [文章编号] 1673-7210(2020)01(c)-0013-04
Effect of Regesi regeneration silicon and Bio-Oss bone meal on proliferation and osteogenic differentiation of osteoblasts
JIA Yan1 ZHANG Baorong2
1.Oral Medicine School, Weifang Medical College, Shandong Province, Weifang 261053, China;2.Oral Clinic, Aviation General Hospital, Beijing 100012, China
[Abstract] Objective To observe the growth of mouse osteoblast (MC3T3-E1) on Regesi regeneration silicon and Bio-Oss bone powder, and to analyze the effects of Regesi regeneration silicon materials and Bio-Oss bone powder on mouse osteoblast proliferation and osteogenic differentiation. Methods The experiment was divided into three groups, respectively Regesi regeneration silicon group, Bio-Oss bone powder group and control group. The two materials were placed in 24-well plates, while the control group was blank. Cells were inoculated on 24-well plates in each group, and the cell growth was observed by inverted microscope at 1, 4 days, and 7 days of culture; MTT was used to detect cell proliferation activity at 1, 4 days, and 7 days of culture; OD value of osteoblasts was determined by alkaline phosphatase (ALP) kit at 7 d culture to analyze ALP activity. Rt-PCR method was used to determine Runx2 and Osterix(OSX) gene expression in 3 groups of cells at 7 days of culture. Results Under the microscope, the number of cells in each group increased with time. The proliferation level of cells in Regesi group increased (P < 0.05), and the ALP activity elevated,the expression levels of Runx2 and OSX mRNA increased at 7 days of culture(P < 0.05). The proliferation level of cells in the bio-Oss bone meal group was decreased at 7 days of culture(P < 0.05), and there was no significant difference in the ALP activity, and the expression levels of Runx2 and OSX mRNA (P > 0.05). Conclusion Regesi regenerated silicon can promote the proliferation and differentiation of MC3T3-E1 cells. Bio-Oss bone powder can decrease cell proliferation, while there is no significant difference between osteogenic differentiation ability and osteoblasts alone.
[Key words] Proliferation; Osteogenesis differentiation; Regesi regeneration silicon; Bio-Oss bone meal; MC3T3-E1 cells
口腔颌面部骨组织结构是支撑面型的重要基础,因各种原因造成的骨组织缺损[1],极大地影响了患者的健康和生活。如何更好地修复骨缺损,是临床醫生亟待解决的问题和难题。硅已被证实能够增加各种材料的生物活性,且不影响他们的机械性能或诱导细胞毒性[2],本研究通过试验一种新材料-Regesi再生硅对小鼠成骨细胞增殖、成骨分化作用的影响,分析Regesi再生硅的生物学性能。
1 材料与方法
1.1 实验材料与设备
MC3T3-E1细胞株;Regesi再生硅(幸福益生公司,中国,批号:2019041605);Bio-Oss骨粉[盖思特利商贸(北京)有限公司,批号:81700762];四甲基偶氮唑蓝(MTT);碱性磷酸酶(ALP)试剂盒(南京建成,中国,批号:201907 13);倒置显微镜(奥林巴斯IX51,日本);酶标仪(德国);RNA提取试剂盒[宝生物工程(大连)有限公司,批号:AJ31039A];One Step TB Green?誖PrimeScriptTM Rt-PCR Kit(Perfect Real Time)[宝生物工程(大连)有限公司,批号:AJ11126A];PCR引物(北京天一辉远生物科技有限公司);荧光定量PCR仪(ABI7500,美国)。
1.2 实验方法
1.2.1 细胞培养 将MC3T3-E1细胞株培养于α-MEM培养基(含1%双抗混合液、10%FBS)中,细胞培养箱内5%CO2、37℃常规培养,3~4 d传代1次,待细胞进入对数生长期后进行实验。
1.2.2 实验分组 将实验分为3组:Regesi再生硅实验组、Bio-Oss骨粉实验组、对照组。将各组材料灭菌后固定于24孔细胞培养板中,每孔约0.2 g,将成骨细胞接种到预湿后的材料上,放于培养箱中培养,隔天换液。
1.2.3 倒置显微镜观察各组材料的细胞生长情况 在细胞复合培养至第1、4、7天,在倒置显微镜下分别观察3组细胞生长情况。
1.2.4 MTT试验检测细胞增殖情况 在细胞与材料接种培养至第1、4、7天时进行MTT实验,取3组细胞各8孔,每孔加入配制5 mg/mL MTT溶液100 μL,继续放入培养箱4 h后取出培养板,吸弃孔中培养液,再每孔加入DMSO 750 μL后移入96孔板中。置于37℃摇床震荡15 min以充分溶解结晶物。然后从每孔吸取200 μL放入酶标仪中在490 nm单波长处测定各孔吸光度值(OD值)。
1.2.5 碱性磷酸酶测定盒测定ALP活性 当细胞在材料上培养至第7天,取3组细胞各8孔,吸弃培养孔中培养液,PBS缓冲液冲洗3遍后每孔加入1%TritonX-100细胞裂解液100 μL冰上裂解30~40 min。再按照ALP活性测定试剂盒操作说明书测定在520 nm波长处的吸光度值。
1.2.6 Rt-PCR测定3组中Runx2和OSX基因表达情况 当细胞在材料上培养至第4天时,加入矿化诱导液(含50 μg/mL维生素C、10 mmol/L β-甘油磷酸钠和10%FBS的α-MEM培养基),再培养7 d后,采用RT-PCR技术测定Runx2(Runt related transcription factor 2)和Osterix(OSX)基因表达量。反转录引物名称及序列如下。OSX上游引物序列:5′-GCTCGTCTGACTGCCTGCCTAGTGT-3′,下游引物序列5′-ACC-TGGTGAGATGCCTGCGTGGAT-3′;Runx2上游引物序列:5′-CCTTCCAGACCAGCAGCACTCCAT-3′,下游引物序列5′-TCCGTCAGCGTCAACACCATCATTCT-3′;β-actin上游引物序列5′-GAAGATCAAGATCAT-TGCTTCC-3′,下游引物序列5′-TACTCCTGCTTGCTGATCCA-3′。Rt-PCR反应:取3组细胞各4孔,采用RNA提取试剂盒提取总RNA,-80℃保存待用。按照One Step TB Green?誖PrimeScriptTMRt-PCR Kit(perfect real time)说明书加入反应液,反转录总RNA合成cDNA及进行PCR扩增。程序设置按照试剂盒说明书。反应条件:42℃ 5 min;95℃ 10 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。反应结束后,用2-△△Ct法进行数据分析。
1.3 统计学方法
采用SPSS 24.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多个样本均数采用单因素方差分析,两两比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果
2.1 荧光倒置显微镜观察各组材料的细胞生长情况
随着时间的增加,各组细胞数量增加。见图1。
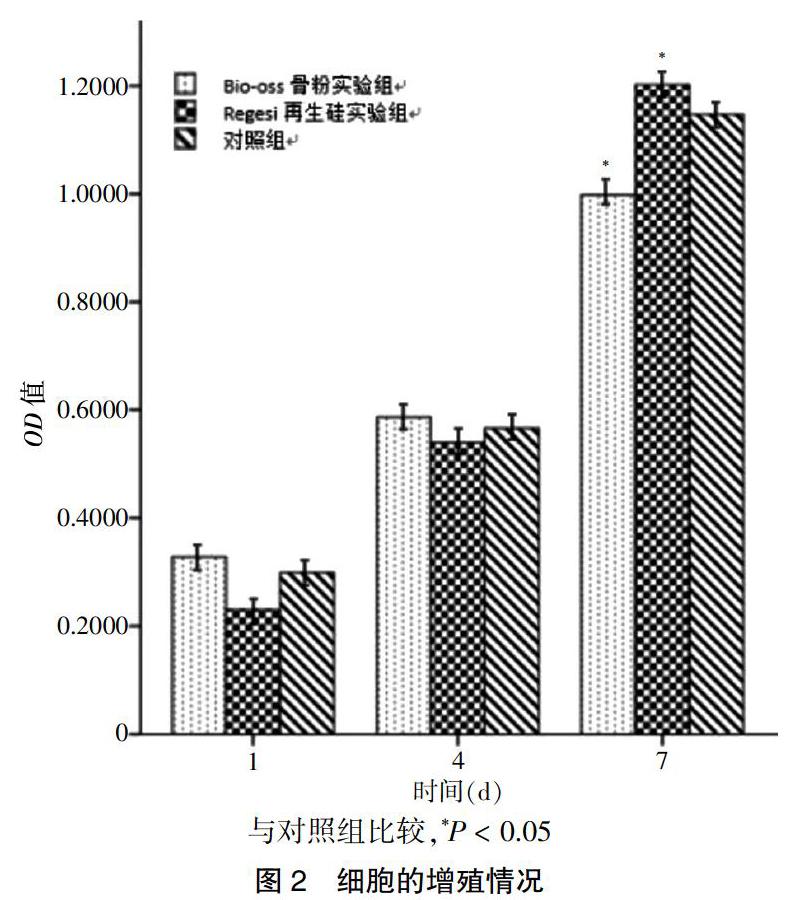
2.2 MTT法检测Regesi再生硅、Bio-OSS骨粉分别对MC3T3-E1细胞增殖的影响
各组MC3T3-E1细胞的增殖活性随培养时间的增加而升高,在培养7 d时,与对照组比较,Bio-oss骨粉实验组细胞增殖水平降低(P < 0.05);Regesi再生硅实验组细胞增殖水平升高(P < 0.05)。见图2。
2.3 ALP活性
在培养7 d时,与对照组比较,Regesi再生硅组ALP活性升高(P < 0.05),Bio-oss骨粉实验组ALP活性差异无统计学意义(P > 0.05)。见图3。
2.4 Rt-PCR检测Runx2、OSX基因的表达
对照组比较,Regesi再生硅组成骨相关基因Runx2、OSX mRNA的表达升高(P < 0.05);Bio-oss骨粉实验组成骨相关基因Runx2、OSX mRNA的表达差异无统计学意义(P > 0.05)。见图4~5。
3 讨论
寻找更好的骨组织再生修复材料,为患者再造健康,是生物医用材料研究的前沿和热点[3-5]。Regesi再生硅材料是由溶胶-凝胶法[6-8]制备而成的一种新型生物活性玻璃,目前还没有在临床得到应用。
成骨细胞经历了增殖、细胞外基质分化与成熟、细胞外基质矿化等阶段成骨[9-10]。本研究选用的MC3T3-E1细胞系具有极好的成骨分化潜能,是体外研究骨细胞增殖、分化与矿化的细胞模型。在细胞的生命活动中,细胞增殖与细胞分化是两个重要的方面[11]。本研究中,采用MTT法检测细胞的增殖情况,结果显示Regesi再生硅能促进成骨细胞的增殖活性,Bio-oss骨粉减弱成骨细胞的增殖活性。
在分化阶段,ALP是成骨细胞分化时分泌的酶,是成骨分化早期的标志性蛋白[12]能较客观的反映成骨细胞的分化情况[13];Runx2和Osterix是成骨细胞分化的关键转录因子,在骨发育的不同阶段发挥重要作用。Runx2是骨形成过程中最早和最具特征性的标志[14],在成骨细胞成熟早期阶段发挥作用[15]。OSX是另一个重要的成骨细胞转录因子,影响成骨细胞的最终成熟,受Runx2的调控[16-17],OSX只在发育中的骨组织中特异性表达,是成骨细胞分化和骨形成过程中所必需的转录因子[18]。Runx2和OSX在成骨细胞增殖、分化、转录调控过程中发挥重要作用,并且参与许多骨组织相关疾病的发生、发展[19-20]。本研究中,ALP活性检测及荧光定量PCR的结果显示:Regesi再生硅组细胞比对照组细胞ALP活性增加,可以上调成骨相关基因Runx2、OSX mRNA的表达,与对照组比较差异有明显统计学意义(P < 0.05);Bio-oss組细胞与对照组细胞分化差异无统计学意义(P > 0.05)。
综上所述,本研究发现,与对照组比较Bio-oss骨粉会减弱成骨细胞的增殖,成骨分化能力与单纯成骨细胞培养差异不明显(P > 0.05),是目前临床应用中的较理想的支架材料;Regesi再生硅能促进小鼠成骨细胞的增殖、成骨分化,但尚未进行动物实验,在细胞水平无法准确显示Regesi再生硅对人体骨缺损的修复作用,还需要通过动物体内实验进一步验证。
[参考文献]
[1] He B,Yuan X,Wu J,et al. Self-Assembling peptide nanofiber scaffolds for bone tissue engineering [J]. S Advanced Mater,2015,7(7):1221-1232.
[2] 章筛林,成翔宇,纪斌.硅在生物材料领域的应用:增加材料生物活性不影响其机械性能[J].中国组织工程研究,2017,21(2):296-302.
[3] 强巴单增,刘晓兰.多孔纳米羟基磷灰石/聚酰胺复合骨修复材料的制备[J].中国组织工程研究,2016,20(3):392-396.
[4] 廖建国,李艳群,段星泽,等.纳米羟基磷灰石/聚合物复合骨修复材料[J].化学进展,2015,27(2):220-228.
[5] 陈冬,白轶,李蓉,等.新型骨修复材料修复种植牙骨缺损的前瞻性临床研究[J].口腔医学研究,2015,31(11):1129-1132.
[6] Kaur G,Pickrell G,Sriranganathan N,et al. Review and the state of the art:Sol-gel and melt quenched bioactive glasses for tissue engineering [J]. J Biomed Mater Res B Appl Biomater,2016,104(6):1248-1275.
[7] Chen XF,Lei B,Wang YJ,et al. Morphological control and in vitro bioactivity of nanoscale bioactive glasses [J]. J Non-Crystalline Solids,2009,355(13)791-796..
[8] Chen XF,Guo CL,Zhao N. Preparation and characterization of the sol-gel nano-bioactive glasses modified by the coupling agent gamma-aminopropyltriethoxysilane [J]. Applied Surface Science,2008,255(2):491-499.
[9] Zheng MH,Wood DJ,Papadimitriou JM. What′s new in the role of cytokines on osteoblast proliferation and differentiation? [J]. Pathol Res Pract,1992,188(8):1104-1121.
[10] Chung SL,Leung KS,Cheung WH. Low-magnitude high-frequency vibration enhances gene expression related to callus formation,mineralization and remodeling during osteoporotic fracture healing in rats [J]. J Orthop Res,2014,32(12):1572-1579.
[11] 戴永国,蔡立飞,杨洋,等.磷酸肌酸对小鼠前成骨细胞MC3T3-E1增殖、分化及矿化的影响[J].大连医科大学学报,2018,40(4):296-300,306.
[12] 唐林,林珠,李永明,等.不同大小机械牵张力对成骨细胞增殖及碱性磷酸酶的影响[J].解放军医学杂志,2006, 31(6):580-581.
[13] 邵華英,张一弓,杨雪,等.抑菌浓度米诺环素对成骨细胞增殖、分化和矿化的影响[J].华西口腔医学杂志,2018, 36(2):140-145.
[14] Kumar Y,Kapoor I,Khan K,et al. E3 Ubiquitin Ligase Fbw7 Negatively Regulates Osteoblast Differentiation by Targeting Runx2 for Degradation [J]. J Biolo Chem,2015, 290(52):471-474.
[15] Bruderer M,Richards RG,Alini M,et al. Role and regulation of RUNX2 in osteogenesis [J]. Eur Cells Mater,2014,28(28):269-286.
[16] Nakashima K,Zhou X,Kunkel G,et al. The novel zinc finger-containing transcription factor osterix is required for ostcoblast differentiation and bone formation [J]. Cell,2002,108(1):17-29.
[17] Sinha KM,Zhou X. Genetic and molecular control of osterix in skeletal formation [J]. J Cell Biochem,2013(5):975-984.
[18] 杨丹,于燕妮.成骨细胞特异性转录因子Osterix研究进展[J].中国公共卫生,2013,29(1):142-145.
[19] Ste in GS,Lian JB,van Wijnen AJ,et al. Runx2 control of organization,assembly and activity of the regulatory machinery for skeletal gene expression [J]. Oncogene,2004,23(24):4315-4329.
[20] Zhang C. Transcriptional regulation of bone formation by the osteoblast-specific transcription factor Osx [J]. J Orthop Surg Res,2010,5(1):37.
(收稿日期:2019-10.12 本文编辑:刘永巧)
[基金项目] 中国科学院动物研究所研究项目(41426040204)。
[作者简介] 贾琰(1994.2-),女,潍坊医学院2017级口腔临床医学专业在读硕士研究生;研究方向:口腔种植学。
[通讯作者] 张保荣(1979.7-),男,博士,副主任医师;研究方向:口腔种植学、牙周学。
