“对角线规则”教学内容的挖掘与拓展
2020-04-02苑凌云岳文虹杨吉
苑凌云 岳文虹 杨吉

摘要: 通过梳理初、高中教材“对角线规则”相关知识,明确各阶段学生需达到的进阶目标和思维层级;简述“对角线规则”在近年高考试题中的应用,说明对角线规则对推理预测陌生元素性质的重要作用。补充教材中位于对角线上的元素“锂-镁、铍-铝、硼-硅”性质的相似之处,并拓展至“碳-磷、氮-硫、氧-氯”元素,于深度和广度上挖掘和拓展“对角线规则”,帮助学生建立完整的元素周期律体系,培养基于“位-构-性”认知模型分析复杂问题的能力。
关键词: 元素周期律; 对角线规则; 位-构-性
文章编号: 1005-6629(2020)03-0080-06
中图分类号: G633.8
文献标识码: B
1 问题的提出
1869年,俄国化学家门捷列夫通过对已经发现的63种元素进行详尽地分析和考察,依原子量的相对大小按序排列,并把相似性质的元素放于同一纵行,编制出了第一张较为系统的元素周期表。恩格斯称这一发现“完成了科学史上的一个勋业,这个勋业恐怕可以和勒维烈计算尚未知道的行星海王星的轨道居于同等地位”[1]。编制元素周期表时,门捷列夫大胆地为尚未发现的元素留下空位,随着科学技术的进步,这些元素一一被发现,充分证明了元素周期表的推理预测功能。
元素周期表不仅可以反映原子的位置结构,更揭示了众多元素间的内在联系和递变规律,是化学发展史上的重要里程碑,“对角线规则”即为元素周期律的重要应用之一。“对角线规则”是人教版化学选修3《物质结构与性质》第一章第二节“科学探究”栏目中的一则内容,教材叙述较为简单,很多教师在授课时也只是一语带过,但笔者通过分析近几年高考试题,发现很多考题中都潜藏了对角线规则的拓展应用;另外,脑科学证明: 零散、孤立的知识点很难在大脑中留下长久印象,只有掌握了系统的分析方法,才能够对信息进行加工处理,从而内化到自己的认知系统中。元素周期律旨在帮助学生建立“位置-结构-性质”的系统思维框架,从而培养学生基于元素周期律的推理演绎能力;“对角线规则”则丰富了学生的认知系统,提供了更多的逻辑判据,對更全面地诠释元素周期律、发挥元素周期表的功能大有裨益。
2 “对角线规则”教学内容的挖掘与拓展
2.1 “对角线规则”对应知识层级梳理
“对角线规则”从属于“元素周期律”这一核心概念,是对元素在同周期以及同族呈现周期性递变规律的补充,即在元素周期表中,某些主族元素与其右下方主族元素的有些性质是相似的,主要体现在第二、三周期的锂和镁、铍和铝、硼和硅之间。2017年版《普通高中化学课程标准》对此部分的学习活动建议为:“查阅有关元素的电负性资料,解释元素的‘对角线规则,列举实例予以说明”。课标对此部分内容的要求是希望学生能够应用原有的元素化合物知识和电负性规律对“对角线规则”进行解释和演绎。显然,课本上涉及到的六种元素中,学生对“镁、铝、硅”是非常熟悉的,“锂、铍、硼”相对来说则有些陌生,为了落实课标的学习活动建议,教师需要梳理学生解决对角线规则相关问题的知识储备及其对应目标,以大局观统筹教学设计,把控好知识的层级关系及教学序列的跨学段、跨模块设计。
表1 初、高中教材“对角线规则”对应知识层级编排表
学习阶段核心知识进阶目标思维层级
初中1. 原子的结构;
2. 简单金属、非金属,常见酸、碱、盐的性质。认识原子结构,掌握生活中常见化学物质的性质,初步学会以分类观学习元素化合物知识。实验、观察、分类、比较
必修1八种核心元素(钠、铝、铁、铜、硅、氯、硫、氮)的单质及其化合物的性质及应用。基于元素观和分类观认识物质,建立“价类二维”模型,能从物质的类别及核心元素的化合价分析物质的化学性质。实验、建模、分析、推理
必修21. 元素周期表的结构及编排原则;
2. 元素周期律: 元素的原子半径、化合价、金属性及非金属性随原子序数递增呈现周期性的递变规律;
3. 元素周期表(律)的应用。基于“位-构-性”认识元素性质,基于“构-性-用”认识物质性质。建模、分析、科学抽象、预测
选修31. 构造原理与核外电子填充规则及表示方法;
2. 元素周期律: 电离能、电负性随原子序数递增呈现周期性的递变规律。进一步认识原子结构,丰富表征原子性质的概念名词,逐步完善对元素周期律的认识。解释、比较、预测、论证
由表1“对角线规则”对应知识层级编排表不难看出,初、高中阶段对元素化合物及其规律的学习整体呈归纳方式。学习初期,通过对简单元素化合物知识的学习,培养学生观察、实验、比较、表征(宏观、微观、符号、曲线)等科学思维方法;高中必修1阶段,通过八种典型元素及对应物质的学习,初步构建系统科学的元素化合物知识网络,建立“价类二维”模型,使学生能从价态和物质类别的角度去推导物质间可能发生的反应;必修2、选修3阶段通过元素周期表(律)的学习,使学生基于此前以部分元素化合物为载体的科学探究、现象描述、性质总结、原理归纳等经验,由点及线再延伸至面,将零散的知识系统化,把元素化合物的知识整合至“位-构-性”的思维系统中,从而培养应用这一认知模型解释、预测、论证未知物质性质的高阶思维。教材编排整体上由浅入深,呈螺旋式上升,在知识横向和纵向上都进行了扩充和加深,注重学科核心内涵的总结与归纳,符合科学概念的建立过程,也有效顺应了学生心理和智力的发展特点。
2.2 “对角线规则”在高考试题中的应用
近几年高考题的整体态势是以真实情境为背景,呈现实际问题,注重学生接收、整合信息,分析和解决问题等能力的考查。笔者通过分析高考真题发现,很多考题常常以学生未系统学过的化学元素作为考查点,旨在考查学生的知识迁移能力,判断他们是否可以应用化学学科特征的思维习惯和逻辑系统去处理陌生问题。在这些考题里,有一些题目可以应用对角线规则进行推理和预测,现总结如下。
2019年课标全国卷Ⅰ第26题和2015年课标全国卷Ⅰ第27题都以硼酸作为题目背景进行物质制备、分离提纯等知识的考查。硼酸是一种重要的化工原料,广泛应用于生产实践,比如: 玻璃工业,硼酸可改善玻璃的耐热性和透明性,提高机械强度,缩短熔融时间;搪瓷、陶瓷工业,硼酸可提高制品的光泽和坚牢度、增强耐久性和耐磨性;冶金工业,硼酸可做添加剂、助溶剂,使硼钢具有高强度和良好的轧延性;医药工业,硼酸可用于生产硼酸软膏,有抑菌、收敛、防腐的功效[2]……基于硼酸对人类生产生活的重要意义,因此近几年很多高考题都以硼酸作为情境素材,不仅测试了学生分析、整合信息解决复杂任务的能力,还增强了学生对于化学学科的认同感。
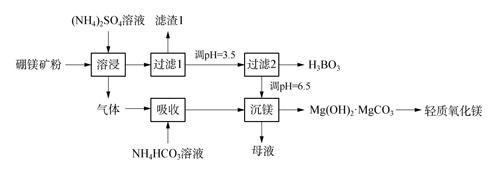
例1 (2019课标全国卷Ⅰ-26)H3BO3是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、 SiO2及少量Fe2O3、 Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(3) 根据H3BO3的解离反应: H3BO3+H2OH++B(OH)-4, K=5.81×10-10,可判断H3BO3是 酸;在“过滤2”前,将溶液pH调节至3.5,目的是 。
答案: 一元弱;转化为H3BO3,促进析出
通过生产工艺流程及题给信息,学生很容易推知H3BO3是一元弱酸,但在说明调节pH为3.5的目的时,由于学生平时很少接触H3BO3,不了解H3BO3的溶解性,很多学生想不到或者不敢答。若考虑对角线规则,由于硼元素和硅元素电负性相近,因此有很多相似的性质,于是可以合理推知: H3BO3类似于H2SiO3也是溶解度较小的弱酸,因此把pH调至3.5主要是促进硼酸析出。
此外,通过此题我们发现,硼酸的酸性不同于其他酸,它的电离方式体现了含硼化合物的缺电子特点,因此可以接受水中OH-提供的孤電子对,是非常典型的路易斯酸。另外资料显示,在利用硼镁矿石生产硼酸时,酸化后的料浆经过固液分离,得到含硼酸的滤液,利用硼酸溶解度随温度降低逐渐减小的特性,在结晶罐中经过降温、过滤、洗涤、干燥即可得到硼酸晶体,但这一过程必须通过对条件的精密控制才能得到较纯的硼酸晶体。通过反复实践,工业上发现当滤液中硫酸为0.3%时(即题中控制pH为3.5左右时),硼酸析出的速度和纯度都比较高[3]。
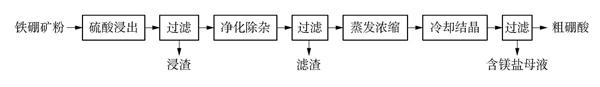
例2 (2015课标全国卷Ⅰ-27)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、 FeO、 CaO、 Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(6) 单质硼可用于生产具有优良抗冲击性能的硼钢,以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程 。
答案: 2H3BO3△B2O3+3H2O; B2O3+3Mg△2B+3MgO
学生在答此题时,往往习惯一步写出硼酸和金属镁反应的化学方程式,忽略了此反应发生的合理性。实际上以硼酸和金属镁为原料制备单质硼的过程是置换反应,中学阶段如果以反应环境作为分类标准,学生通常会接触到两类置换反应: 一类是水溶液中的置换反应,比如金属和酸生成氢气的反应,湿法炼铜等;一类是在加热或高温条件下的置换反应,比如焦炭还原氧化铜,镁和二氧化碳的反应等。但是,不论是何种转化,在学生的知识体系中,都不存在单质置换非金属含氧酸中非金属元素的反应。倘若学生可以联想到硼元素和硅元素处于对角线上,结合含硅化合物的化学性质: H2SiO3△SiO2+H2O, SiO2+2C高温Si+2CO,也就不难类比推演出本题答案了。
例3 (2018课标全国卷Ⅰ-7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、 Fe、 Li
C. 沉淀反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
答案: D
磷酸亚铁锂电池相比传统镍氢电池有很大优势,比如寿命长、安全性高等,能量密度可以达到镍氢电池的3倍之多,因此被广泛应用于电动汽车。资料显示,2013~2017年间,磷酸亚铁锂电池正极材料产量庞大,电池的使用寿命大约为3~5年,因此2020年预计会有三万多吨磷酸亚铁锂电池正极材料需要回收。本题以湿法冶金工艺回收废旧磷酸亚铁锂电池正极材料为背景,提出需要解决的真实的社会热点问题,考查学生接受、整合、分析信息以及解决实际问题的能力。
此题D选项中,学生需要判断硫酸钠能否沉淀Li+从而将锂元素分离出来,一种判断方法是根据题意发现含磷酸亚铁锂滤渣用硫酸处理后锂元素仍然存在于滤液中,由此判断硫酸锂可溶;另一种判断方法是结合对角线规则,锂元素和镁元素在某些性质上有相似之处,通过硫酸镁可溶推断硫酸锂也可溶。此外,本题沉锂采用的碳酸钠也可以从对角线规则中得到解释,碳酸镁难溶,因此推知碳酸锂也难溶。
在实际工业中,湿法回收硫酸浸过的磷酸亚铁锂电池中的锂元素通常有三种方法: (1)采用碳酸钠沉淀锂元素;(2)加入磷酸或磷酸盐沉淀锂元素;(3)加入生石灰除去硫酸根,生产氢氧化锂。本题正是采用了第一种方法[4]。
2.3 “对角线规则”中主题内容和学习任务的选取与组织
基于学生已有的概念知识和高考试题的反拨作用,笔者通过深入挖掘对角线规则的知识内涵,引导学生探究其本质原理,并适当演绎拓宽,让学生对对角线规则产生更加深刻清晰的认识,完善元素周期律知识体系,培养学生大胆思维,勇于思考,自觉利用“位-构-性”思维系统解决陌生问题的能力(见表2)。
表2 “对角线规则”中主题内容和学习任务的选取与组织
教学环节教学内容
1. 温故知新主题内容复习元素周期表(律)。
学习任务回忆元素周期表的结构,回忆元素的原子半径、化合价、金属性及非金属性、电离能、电负性随原子序数递增而呈现的周期性的递变规律。
2. 问题聚焦主题内容为什么“LiMg、 BeAl、 BSi”之间有些性质是相似的?
学习任务右下方对角线——半径相近(元素周期表中“靠上靠右半径减小”)——电负性相近——性质相似(位-构-性)。
3. 演绎拓展主题内容1“锂和镁、铍和铝、硼和硅”之间除了课本上提及的相似点还有哪些相似的性质?
学习任务(此部分内容仅做拓展,具体教学内容请自行选取)
锂和镁:
1. 在过量氧气中燃烧,均形成普通氧化物,其共价性较强,能溶于有机溶剂,如乙醚等;
2. 它们的氢氧化物都为中强碱,而且在水中的溶解度都不大,在加热时,均分解为相应的普通氧化物,如Li2O和MgO;
3. 它们的碳酸盐均不稳定,加热生成相应的氧化物和CO2;
4. 它们的一些盐类,如氟化物、碳酸盐和磷酸盐等均难溶于水;
5. Li+和Mg2+的水合能力较强;
6. Li和Mg直接和N2反应生成氮化物,而其他碱金属不能直接和N2作用:
6Li+N22Li3N; 3Mg+N2Mg3N2;
续 表
教学环节教学内容
7. 它们都有一系列烷基和芳基化合物,其作用相近,如: Mg的格氏试剂,相应的有机锂试剂等。
铍和铝:
1. 两者都是活潑金属,其标准电极电势相近: Eθ(Al3+/Al)=-1.67V, Eθ(Be2+/Be)=-1.7V;
2. 在空气中它们的表面均形成致密的氧化膜而不易被腐蚀,与酸的作用比较慢,均与浓硝酸发生钝化作用;
3. 氧化铍和氧化铝都是高熔点、高硬度;
4. 铍和铝以及它们的氢氧化物均为两性,在适当条件下可与酸、碱反应;
5. 无水氯化铍和氯化铝都是双聚体,并显示共价性,可以升华,能溶于有机溶剂;
6. 它们的盐易水解,且有许多高价阴离子的盐难溶;
7. 铍和铝的碳化物属于同一类型,水解后都产生甲烷:
Be2C+4H2O2Be(OH)2+CH4↑; Al4C3+12H2O4Al(OH)3+3CH4↑;
注意: 铍和铝尽管有很多相似的性质,但两者在人体内的生理作用却大相径庭,人体内能摄入少量的铝,却不能有一点铍,否则有生命危险。
硼和硅:
1. 硼酸、硅酸在水中的溶解度都较小,且受热易分解;
2. 自然界中多以氧化物形式存在,B—O键、 Si—O键比较稳定;
3. 硼与同周期的金属元素锂、铍相比,原子半径小,电离能高,电负性大,与硅类似,倾向于形成共价型分子;
4. 硼烷在组成上与烷烃类似,低级硼烷在室温下为气体,随着相对分子质量的增加,逐步变成挥发性的液体或固体;
5. BX3和SiX4相似,极易水解。另外,BX3的制法也和SiX4相似,可以用单质与卤素或氧化物与HF反应得到;
6. HBF4与H2SiF6一样都是强酸,Cu、 Fe等金属的氟硼酸盐用于电镀,镀层质量好,效率高且省电[5,6]。
主题内容2其他处于对角线上的元素有相似的化学性质吗?
学习任务第二、三周期中,其他位于对角线上的元素对为“C-P、 N-S、 O-Cl”,它们是典型的非金属元素,电负性差值相比前几组较大,因此性质上不尽相同,但仍然部分表现出对角线规则。如: C—H、 P—H键极性相近,磷元素也可以形成多种氢化物,并且有机磷化学也是有机化学中非常重要的一个分支;S在性质上与同族的O有很大差异,但与对角线左上方的N有些许类似,例如: 单质比较稳定,表现出一定的惰性,且有强烈的成链倾向等[7,8]。
4. 归纳提升主题内容1. 元素周期表的“位-构-性”认知模型;
2. 元素周期表(律)的推理预测功能。
学习任务根据元素周期表同周期、同族、对角线等特殊位置关系,能够对已有知识进行合理解释,对未知元素的化学性质进行预测与论证,丰富使用元素周期表的逻辑判据,形成自主的“位-构-性”的思维逻辑系统。
5. 训练反馈主题内容高考真题演练。
(2015课标全国卷Ⅰ-27, 2018课标全国卷Ⅰ-7, 2019课标全国卷Ⅰ-26)
学习任务对角线规则的应用。
注: 实际上,影响金属阳离子性质的主要参数是离子势,指离子电荷数(Z)和离子半径(r)的比值(用Ф表示),即Ф=Z/r。离子势的大小影响着某些离子化合物的溶解性、水解性、某些氢氧化物的酸碱性及含氧酸盐的热稳定性等。影响非金属元素性质的主要参数是电负性,电负性综合考虑了电离能和电子亲和能,表征元素的原子对键合电子的吸引能力,一定程度上代表元素非金属性的强弱。中学阶段,主要通过电负性数据解释对角线规则。
3 结语
高考命题以真实合理的情境创设为测试载体,以不同复杂程度的实际问题为测试任务,考查学生接收、整合信息,分析和解决问题等能力。本文通过“对角线规则”教学内容的挖掘和拓展,有利于帮助学生建立较完整的元素化合物和元素周期律体系,完善“位-构-性”认知模型,促使学生将知识转化为能力,为应对高考中的复杂陌生任务提供解题思路,培养学生灵活运用结构化知识解决实际问题的能力。
参考文献:
[1]刘则渊. 纪念门捷列夫元素周期表150周年[J]. 科学文化评论, 2019, 16(1): 5~21.
