一氧化碳还原氧化铁实验的改进
2020-04-02吴晓颖王振张明月
吴晓颖 王振 张明月
摘要: 针对教材中一氧化碳还原氧化铁实验的不足之处,利用W形管设计新的实验装置,提高了实验的成功率、安全性和可操作性。新装置不仅具有试剂耗量少、环保、一体化等优点,而且还可检验、收集尾气,以及改进了产物铁的检验方法。此外,W形管还可应用于初中其他系列经典实验的改进。
关键词: W形管; 一氧化碳还原氧化铁; 实验装置一体化设计; 实验改进
文章编号: 1005-6629(2020)03-0072-04
中图分类号: G633.8
文献标识码: B
一氧化碳还原氧化铁的实验在九年级化学教学中具有重要地位。高温还原法得到游离态金属单质是学生学习金属冶炼的第一种方法。通过学习,引导学生关注化工生产中的化学反应,意识到化学原理对生产实际的指导作用。该实验是有毒气体CO与固體在高温条件下的反应,对装置的密闭性要求甚高,且是集合了主反应的发生、气体产物检验、尾气处理于一体的完整的实验装置,是对学生以往所学化学知识的一次检验,也是对学生视野进行的一次必不可少的拓展,为系统学习金属冶炼知识做铺垫。
重视该实验并确保实验成功,是充分发挥其教学功能与价值的重要前提。但就教学现状而言,对于这一实验,多数一线教师在教学过程中仍采用观看视频或口述实验等方法代替演示实验,细究原因,主要有以下几方面。
1 教材实验的不足之处
1.1 CO的制备与储存
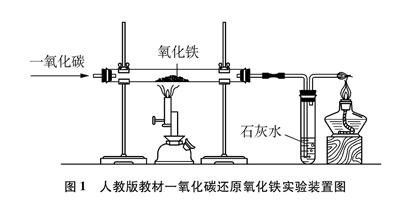
教材所示装置图中(见图1),未明确指出实验所用CO的来源。在实际教学中,部分教师采用储存有CO的安全气囊或储气罐,但对于我国广大的农村中学来说,难以购买符合条件的储气设备,因此安全气囊或储气罐的使用不具有普遍性。
图1 人教版教材一氧化碳还原氧化铁实验装置图
1.2 排尽空气所需时间
点燃酒精喷灯之前,需先排尽装置内的空气,但CO无色无味,因此难以确定装置内空气何时排尽。出于安全考虑,经常要多通一段时间的CO,这样既增加药品用量,也会浪费宝贵的课堂时间。
1.3 尾气处理
点燃法处理尾气,有两个弊端: 一是起始排出的CO中混有空气,若贸然点燃,可能会发生爆炸;二是主反应开始以后,尾气主要是CO和CO2,由于CO2不助燃且所占体积分数较大,因此CO未必能完全燃烧,直接排放会造成空气污染。
1.4 热源
一氧化碳还原氧化铁实验需要600℃以上的高温条件,因此教材实验使用酒精喷灯。但酒精喷灯的使用步骤较为繁琐,且使用时声响较大,易对学生造成心理压力,产生不必要的恐惧感。
1.5 产物的检验
该反应的生成物分别是CO2和铁。用澄清石灰水检验CO2,方法简单,现象明显。但关于铁的检验,多数教师在得到产物后,只在硬质玻璃管外用一磁铁吸引黑色粉末,发现该产物会随磁铁左右移动,便认为有铁生成,缺乏对黑色产物的进一步检验(此反应的中间产物Fe3O4也具有磁性,能被磁铁吸引)。若要将黑色粉末取出与酸反应,借由生成H2证明有铁粉生成,则必须等装置冷却,会消耗较多的时间,若未等充分冷却便取出,则铁很容易在空气中被氧化。
1.6 缺乏防倒吸装置
主反应装置与CO2检验装置直接相连,二者温度相差较大,如若操作不慎,便会引发倒吸。
2 实验改进
2.1 实验仪器与药品
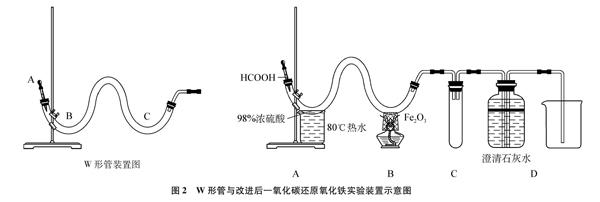
如图2所示,实验所需仪器为: 铁架台1个、塑料滴管1支、W形管(内径15mm,总长度约为35cm)1根、酒精灯1个、自制防风罩1个、试管1支、集气瓶(500mL)1个、烧杯(500mL)1个、烧杯(250mL)1个、单孔橡胶塞2个、双孔橡胶塞2个、导管若干、胶皮管若干、胶头滴管1支、药匙1支
所需实验药品为: 甲酸、98%浓硫酸、氧化铁粉末、澄清石灰水、80℃热水
W形管装置图
图2 W形管与改进后一氧化碳还原氧化铁实验装置示意图
2.2 部分实验仪器改装
(1) 酒精灯火焰的防风罩: 用废弃石棉网绕制而成。
(2) 利用“水量法”,事先测算出装置的容积约为130mL,并在集气瓶外侧表面标出上部容积130mL所在位置。当瓶内液面下降到标记处时,说明装置内空气已基本排尽。
(3) W形管: 注意中部凸起部分要比两端高一些,防止因左边产生的气体过多,导致液体溢出到右边。
2.3 实验操作步骤
(1) 检查装置气密性。如图2所示,连接仪器,装入4mL浓硫酸、氧化铁粉末、澄清石灰水后,挤压塑料滴管,若观察到集气瓶内的两根导管出现稳定的液面差(左低右高),则装置气密性良好。
(2) 水浴加热。对W形管前端的浓硫酸进行80℃水浴加热。
(3) 取下塑料滴管,吸取3mL甲酸后连接于装置中。轻轻挤压滴管,将甲酸逐滴滴加到浓硫酸中。
(4) 当集气瓶内液面下降到标记位置时,点燃酒精灯,先预热,后固定位置加热。
(5) 当红棕色粉末全部变黑且澄清石灰水变浑浊时,继续加热2~3分钟,而后熄灭酒精灯。
(6) 用磁铁吸引管内黑色粉末,并将黑色粉末转移到W形管另一个凹槽中与剩余酸液反应,多余尾气用集气瓶收集。
(7) 后续处理: 实验结束后,取下集气瓶,拿到安全之处,拔掉双孔塞,立即点燃尾气。拆开其余实验装置,清洗并整理实验用品。
2.4 注意事项
(1) 因甲酸与浓硫酸具有强腐蚀性,吸取甲酸、浓硫酸时要戴橡胶手套,防止酸液与皮肤接触。
(2) 集气瓶的规格尽量选大一些,笔者实验使用容积为500mL的集气瓶,保证尾气能被完全收集。
(3) 刚开始滴入甲酸时,速度稍慢些,防止反应速率过快。
(4) 当红棕色粉末全部变黑时,不能立刻停止加热,应再加热一段时间,而后熄灭酒精灯,防止中间产物Fe3O4干扰实验(后文详细叙述)。
3 实验创新之处及优点
3.1 无需提前储存CO
利用甲酸与浓硫酸反应制备CO: HCOOH浓硫酸60~80℃CO↑+H2O
该反应容易进行,操作简便,可以做到随时制备CO,安全性高。甲酸易挥发,密度为1.220g/cm3,浓硫酸难挥发,密度为1.84g/cm3,为避免甲酸在反应前挥发,故选择将浓硫酸水浴加热,见图2(A)。虽然甲酸的密度比浓硫酸小,将甲酸注入浓硫酸时难以避免产生液体飞溅,但是由于液体量少,飞溅程度可以忽略。
3.2 热源的选择与改进
刘怀乐在“一氧化碳还原氧化铁的实证探索与教学思考”一文[1]中指出,一氧化碳还原氧化铁的反应是分步进行的:
3Fe2O3+CO400~500℃2Fe3O4+CO2;
Fe3O4+CO500~600℃3FeO+CO2;
FeO+CO600℃以上Fe+CO2。
朱洪法[2]的《实用化工词典》则提出,当温度高于710℃, Fe能稳定存在;680~710℃之间,FeO能稳定存在;低于680℃,则主要是Fe3O4。故要得到产物铁,温度必须控制在710℃以上。实验所用W形管系石英玻璃制成,可耐高温1200℃,满足实验要求。酒精灯加热温度可达800℃[3]左右,但由于火焰会随风摆动,难以快速升温并维持高温,故笔者选择在火焰外围加装防风罩,见图2(B)。为了确保有铁生成,建议在红棕色粉末完全变黑以后,持续加热2~3分钟。
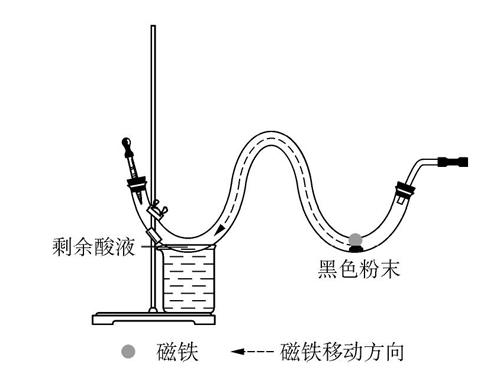
3.3 产物Fe的检验更为科学合理
熄灭酒精灯后,可立即用磁铁将产生的黑色粉末吸引并转移到W形管前面的凹槽中,与剩余酸液反应,见图3。当观察到气泡的生成速率加快,可证明有Fe生成。该操作巧妙之处在于,不必等装置完全冷却后才取出固体与酸反应,节约了时间。
图3 一氧化碳还原氧化铁产物检验操作示意图
3.4 加入防倒吸装置,提升实验安全系数
教材中的主反应装置与CO2检验装置直接相连,存在液体倒吸使玻璃管因骤冷而破裂的风险[4]。笔者在二者之间加入防倒吸裝置,见图2(C),可以解决这一问题。
3.5 集气瓶的作用
集气瓶的连接方式见图2(D)。
作用1: 根据液面下降情况,可以确定装置内空气是否排尽,准确估算开始加热的时间。虽然气体运动情况复杂,但经过笔者多次实验证明,当液面下降至标记处时再点燃酒精灯,不会发生爆炸。
作用2: 根据加热W形管前后澄清石灰水的变化,可以检验CO2,由于石灰水过量,因此也可以用于吸收剩余CO2。
作用3: 密闭体系,将反应过程中生成的所有气体全部收集起来,防止CO逸散污染环境。
作用4: 处理尾气,方便安全。实验结束后,将集气瓶拿到安全之处,打开瓶塞,立即点燃尾气。查阅资料[5]可知: 空气中CO的体积分数达到12.5%~74.2%,H2的体积分数达到4%~75%,点燃时可能会发生爆炸。由于集气瓶口较大,气浪能顺利冲出瓶口,因此不会有危险。
4 结束语
本实验装置连接简单,可操作性强,不仅减少课前准备的负担,更主要的是提升了实验的安全性和成功率,能
有效落实
该实验于课堂教学中。此外,W形管还可应用于其他化学实验的改进中,见表1。
表1 利用W形管改进化学实验一览表
编号实验ABC其他说明现象
1H2的制取与检验稀硫酸锌粒洗涤液末端明火点燃发出轻微的爆鸣声
2CO2的制取与性质实验稀盐酸石灰石澄清石灰水后接所需仪器药品澄清石灰水变浑浊
3CO还原CuO 甲酸浓硫酸氧化铜粉末后接所需仪器药品黑色粉末变为红色
4探究燃烧条件改为橡胶塞红磷白磷80℃水浴加热白磷燃烧,红磷不燃烧
5分子运动实验浓氨水/酚酞挤压A酚酞变红
参考文献:
[1]刘怀乐. 一氧化碳还原氧化铁的实践探索与教学思考[J]. 化学教学, 2007, (11): 13~16.
[2]朱洪法. 实用化工词典[M]. 北京: 金盾出版社, 2004: 12.
[3]孙黎颖, 王程杰. 酒精灯火焰的温度及实验室加热源[J]. 化学教学, 2017, (11): 51~53.
[4]马逸群. 安全便捷的一氧化碳还原氧化铁实验[J]. 教学仪器与实验, 2012, (3): 16~17.
[5]裴锐, 张灵丽. 一氧化碳还原氧化铁实验的一体化设计[J]. 化学教学, 2019, (6): 70~73.
