运用数字化技术探究盐酸滴定碳酸钠溶液的反应
2020-04-02韩慧磊信欣孙影
韩慧磊 信欣 孙影
摘要: 基于数字化技术探究盐酸滴定碳酸钠反应的过程,绘出pH随盐酸滴加的曲线变化图。实验所得三条滴定曲线图像基本重合,说明实验具有较好的重现性和一致性;对实验曲线的起始pH、半滴定终点、滴定终点以及滴定误差进行分析,其相对误差均小于5.00%,说明数字化实验结果准确且误差较小;从宏观、微观、符号和曲线四个方面对反应过程作深入分析;从定性和定量的角度阐明盐酸滴定碳酸钠的反应过程,旨在为相关内容的教学提供参考。
关键词: 数字化实验; pH传感器; 盐酸滴定碳酸钠; 实验探究
文章编号: 1005-6629(2020)03-0056-05
中图分类号: G633.8
文献标识码: B
1 问题提出
碳酸钠是钠的重要化合物,也是典型的碳酸盐,其性质研究是中学化学教学的重点。而其与盐酸的反应不仅能考察学生对碳酸钠性质的掌握,还能考察学生对酸碱滴定、溶液中离子浓度的变化以及滴定突跃等知识的综合应用情况[1~3]。对已有盐酸滴定碳酸钠实验研究整理发现,主要为以下两方面内容: 一是传统实验装置的改进,主要集中在对传统实验进行恒压式改进以及对实验条件进行探寻使实验现象明显、易于观测等[4~7];二是数字化实验,主要是采用压强传感器、二氧化碳传感器、pH传感器等对实验过程进行监测以及对实验曲线进行分析[8~10]。
尽管碳酸钠与盐酸反应的实验已有较多改进,但大多都止于定性角度对实验曲线进行分析,尚未从定量角度进一步理解水解平衡、电离平衡和滴定突跃等问题。基于此,本实验对数字化实验所得图像的数据进行深度挖掘,先基于酸碱滴定法采用滴数传感器和pH传感器测定盐酸滴定碳酸钠的pH变化曲线,然后采用酸碱质子理论从定量角度对滴定起点pH、半滴定终点和滴定终点进行误差分析以及滴定误差分析,并从宏观、微观、符号、曲线四个方面定性表征反应过程的各个阶段,以期为教师课堂教学和学生学习提供参考。
2 实验设计
2.1 实验用品
仪器: pH传感器、滴数传感器及配套滴管、数据采集器、计算机及其相配套的软件、磁力搅拌器、磁子、烧杯(50mL, 2个)、试管夹、移液管(15mL)、洗耳球、铁架台、250mL容量瓶、100mL容量瓶、胶头滴管
药品: Na2CO3(AR)、 HCl(AR)、去离子水、酚酞试剂、甲基橙试剂
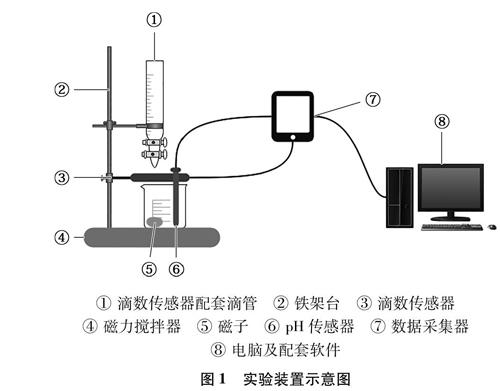
2.2 实验装置图
按照图1所示搭建实验装置。
① 滴数传感器配套滴管 ② 铁架台 ③ 滴数传感器
④ 磁力搅拌器 ⑤ 磁子 ⑥ pH传感器 ⑦ 数据采集器
⑧ 电脑及配套软件
图1 实验装置示意图
2.3 实验步骤
(1) 分别配制250.0mL 1.000mol/L的HCl溶液和100.0mL 0.5000mol/L的Na2CO3溶液。
(2) 向滴管中添加HCl溶液,打开开关阀并排尽下端空气,调节流速阀,使液滴以合适的速度成滴落下。按图1所示,连接装置。调节滴管位置,保证液滴能被滴数传感器感应,然后对滴数传感器进行校准。
(3) 用移液管量取15.00mL 0.5000mol/L的Na2CO3溶液,并将溶液转移到放在磁力搅拌器上的装有小磁子的烧杯中。液面应没过pH传感器的玻璃泡,且调整合适转速,使得液体不会溅出;调整磁子和pH传感器的位置,使得磁子不要触碰到pH传感器。
(4) 点击数据采集按钮,向烧杯中滴加几滴酚酞试剂,打开滴管下端的开关阀。观察实验数据变化和溶液颜色变化。待红色完全褪去后,快速向烧杯中滴加几滴甲基橙试剂,观察实验数据变化和溶液颜色变化。待数据曲线变化趋于稳定时,关闭滴管的开关阀,并停止数据采集。待实验数据采集完毕,清洗仪器,并重复操作(3)和(4)两次。
3 实验结果及分析
通过实验可得三条盐酸滴定碳酸钠溶液的pH曲线图,所得实验曲线如图2所示。
图2 滴定曲线图
从图中可知,三次重复实验所得曲线基本重合,说明实验操作规范、数字化实验具有良好的重现性,所绘反应曲线具有较好的一致性。
3.1 起始pH分析
3.1.1 起始pH的理论计算
Na2CO3在水溶液中发生水解反应: CO2-3+H2OHCO -3+OH-,水解平衡常数: Kb1=Kw/Ka2=10-14/5.6×10-11=1.8×10-4。又因为c/Kb1>400, [OH-]≈cKb1=0.5×1.8×10-4=9.49×10-3,计算得pH=11.98。
3.1.2 起始pH误差分析
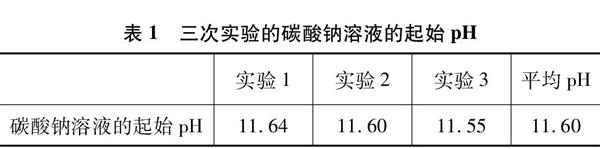
为了消除实验仪器和操作所带来的误差,取三次起始pH的平均值作为实验起始pH(见表1)。
表1 三次实验的碳酸钠溶液的起始pH
实验1实验2实验3平均pH
碳酸钠溶液的起始pH11.6411.6011.5511.60
Na2CO3溶液pH的相对误差为11.60-11.9811.98×100%=-3.17%。由此可以看出相对误差较小(<5.00%),手持技术测定结果是可靠的。
3.2 半滴定终点分析
3.2.1 半滴定终点理论分析
H2CO3是二元弱酸,其在水溶液中的电离平衡和电离常数表达式如下: H2CO3H++HCO -3, Ka1=[HCO -3][Η+][H2CO3]; HCO -3H++CO2-3, Ka2=[H+][CO2-3][HCO -3]。用HCl滴定Na2CO3的过程中,随着H+的滴加,H+先和CO2-3结合生成HCO -3,在第一个计量点时,CO2-3完全反应生成HCO -3,而在消耗H+體积的二分之一处,即第一个半滴定终点,CO2-3和HCO -3的浓度应恰好相等,此时Ka2=[H+],也即第一个半滴定终点时,pH1=pKa2=10.25。
随着H+的继续滴加,H+会和HCO -3结合生成H2CO3,在第二个计量点时,HCO -3完全反应生成H2CO3,而在第一化学计量点和第二化学计量点的等分处,为第二个半滴定终点,此时HCO -3和H2CO3的浓度应恰好相等,此时Ka1=[H+], pH2=pKa1=6.38。
3.2.2 半滴定终点误差分析
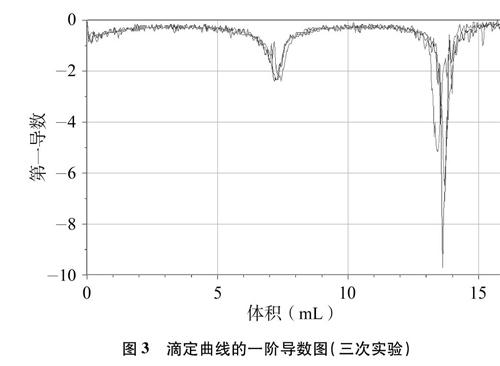
通过对软件自带的一阶导数图(见图3)进行分析,可以确定滴定终点时溶液的体积和pH,通过运算可知半滴定终点时的pH。
图3 滴定曲线的一阶导数图(三次实验)
实验测得的半滴定终点pH如表2所示。
表2 半滴定终点时pH的统计表
实验1实验2实验3平均pH
第一个半滴定终点时的pH10.3010.3410.2210.29
第二个半滴定终点时的pH6.496.546.446.49
实验测得第一个半滴定终点的平均pH为10.29,相对误差10.29-10.2510.25×100%=0.39%。
实验测得第二个半滴定终点的平均pH为6.49,相对误差6.49-6.386.38×100%=1.72%。
3.3 滴定终点分析
3.3.1 滴定终点理论分析
通常对于多元酸的滴定,首先根据cKa1≥10-8与否,判断能否对第一级解离的H+进行准确滴定,然后根据Ka1/Ka2是否大于105,以此判断第二级解离的H+是否对第一级解离的H+产生干扰[11]。通过计算可知,1.000mol/L的HCl溶液滴定15.00mL 0.5000mol/L的Na2CO3溶液中,化学计量点有两个,但第二级解离会对滴定结果造成干扰。
第一个滴定终点为7.50mL 1.000mol/L HCl溶液滴定15.00mL 0.5000mol/L Na2CO3溶液中形成22.50mL的NaHCO3溶液,此时c(NaHCO3)=0.3333mol/L, pH为8.30。第二个滴定终点为15.00mL 1.000mol/L HCl溶液滴定15.00mL 0.5000mol/L Na2CO3溶液中形成30.00mL的NaCl和H2CO3溶液。若不考虑H2CO3的分解,此时c(H2CO3)=0.2500mol/L, pH为3.49。由理论分析和计算可知: 第二步不能准确滴定,且第二个滴定终点pH应大于3.49。
3.3.2 滴定终点误差分析
通过软件自带的一阶导数图(见图3)分析,可以确定滴定终点时溶液的体积和pH。实验测得的滴定终点时的pH和消耗盐酸的体积如表3所示。
表3 滴定终点时pH和体积的统计表
实验1实验2实验3平均值
第一个滴定终点时的体积/mL7.447.197.227.28
第一个滴定终点时的pH8.118.378.208.23
第二个滴定终点时的体积/mL13.7013.6313.4213.58
第二个滴定终点时的pH4.264.494.394.38
实验测得第一个滴定终点的平均pH为8.23,相对误差8.23-8.308.30×100%=-0.84%。
在第二个滴定终点时,pH的平均值为4.38,大于3.49,且实验过程中也有部分气泡产生,说明部分碳酸在反应过程中分解。
3.4 终点误差分析
在酸碱滴定中,通常利用指示剂来确定滴定终点。若滴定终点与化学计量点不一致就会产生滴定误差,这种误差称为终点误差[12]。本实验对中学常见的酚酞指示剂的终点误差和数字化实验所得结果的终点误差进行探讨。
3.4.1 数字化实验与理论值之间的终点误差分析
以第一个滴定终点的平均值作为数字化实验所得滴定终点,得出理论值与数字化实验所得滴定终点的pH差值ΔpH=8.23-8.30=-0.07,代入公式,求得滴定误差为Et=10ΔpH-10-ΔpHKa1Ka2×100%=-0.37%。
3.4.2 酚酞指示剂与理论值之间的终点误差分析
通过对实验视频的反复观看,确定以中学常用的酚酞作为指示剂时,滴定终点的pH为9.10。得出理论值与常见指示剂之间的pH差值ΔpH=9.10-8.30=0.80,代入公式,求得滴定误差为Et=10ΔpH-10-ΔpHKa1Ka2×100%=7.10%。
由以上分析可知,采用手持技术所得的滴定误差为-0.37%,远远小于7.10%。相比需要肉眼分辨的传统的酚酞指示剂,数字化实验在滴定的分析中,不仅不需要紧盯实验过程和实验现象的变化,而且误差更小,因此更为方便可靠。
3.5 “四重表征”分析
选取其中一条滴定曲线,通过软件自带的一阶导数和二阶导数分析,确定滴定起点(A点)、两个滴定终点(C点、F点)以及滴定突跃(BD段、EG段),并对其进行标号,如图4所示。
注: 本曲线为实验2的pH曲线图
图4 实验所得HCl滴定Na2CO3的pH曲线图
对其进行四重表征分析,分析结果如表4所示。
表4 四重表征分析结果
pH段曲线变化宏观现象微观解释符号表征
AB段平缓下降溶液红色逐漸变淡CO2-3水解导致溶液呈碱性,滴加酚酞使得溶液变为红色。滴加HCl后,H+和CO2-3反应生成HCO -3,溶液pH下降。H++CO2-3HCO -3
BD段急剧下降溶液由淡红色变为无色在C点时,溶液中的CO2-3完全转化为HCO -3。随着HCl的滴加,HCO -3会和H+继续反应,生成H2CO3。H++CO2-3HCO -3
H++HCO -3H2CO3
DE段平缓下降溶液橙色逐渐变淡;有气泡产生,附着在pH传感器和磁子上,并逐渐增多随着HCl的滴加,生成的H2CO3会分解为CO2。H++HCO -3H2CO3
H2CO3CO2↑+H2O
EG段急剧下降溶液由浅橙色变为红色;有大量气泡产生在F点时,溶液介于生成的H2CO3溶液和CO2溶于水形成H2CO3之间。随着HCl的滴加,此时溶液为HCl和H2CO3的混合酸体系。H++HCO -3H2CO3
H2CO3CO2↑+H2O
GH段逐渐趋于平缓溶液中的红色逐渐加深;仍有少量气泡冒出随着HCl的滴加,pH缓慢下降。
4 实验结论
数字化实验在本实验的研究中发挥了其定量测定的优势,并通过实时生成的pH曲线变化图使得实验过程清晰明了。在本实验中不仅曲线具有较好的一致性和重现性,并且通过对其理论计算和实验所得进行误差分析发现: 起始pH的相对误差为-3.17%;第一个半滴定终点的相对误差为0.39%,第二个半滴定终点的相对误差为1.72%;滴定终点的相对误差为-0.84%;以及数字化实验与理论计算之间的滴定误差为-0.37%,远小于指示剂与理论值之间的滴定误差(7.10%)。
5 小结
5.1 本实验优点
(1) 实验所得三条曲线基本重合,说明本实验具有一定的重现性和一致性;对曲线中的起点、半滴定终点、滴定终点以及滴定误差进行分析,从定量角度解释了盐酸滴定碳酸钠的反应过程;并选取其中一条曲线进行四重表征分析,阐明反应过程中各离子浓度及种类以及溶液pH的变化。分别从定性和定量两个角度对盐酸滴定碳酸钠溶液进行了详细分析,为有关教学提供参考。
(2) 相比传统的滴定实验,滴数传感器和pH传感器能对盐酸滴定碳酸钠过程中pH变化进行实时监测,使整个反应过程可视化,方便捕捉pH的细微变化,更便于操作和分析;相比传统实验中的酚酞指示剂,数字化实验所得结果的滴定误差更小。
(3) 本实验曲线中的起点pH、半滴定终点和滴定终点的理论计算分别对应着盐类的水解、电离平衡以及酸碱滴定等重要内容。通过对实验过程的定性和定量分析,为电离平衡、水解平衡和滴定突跃等知识提供了支撑证据,有助于学生形成并发展微粒观、守恒观;并可将实验现象和数据等证据素材应用于课堂实践中,帮助学生形成认识水溶液中离子反应与平衡的基本思路。
5.2 实验展望
(1) 实验的不足有待进一步改进。
根据碳酸钠和盐酸反应的分步进行和物料守恒可知,两步反应间消耗的H+应相同。然而在具体分析过程中未考虑混合后溶液体积的变化,且通过对两步反应间消耗的体积分析发现,第一步消耗的H+多于第二步,其可能是随着反应的进行,溶液中的离子种类和数目以及体积发生改变,导致离子迁移率改变;还可能是因为pH传感器中的玻璃泡受反应时间和位置的影响等,具体原因还有待进一步探究。
(2) 本实验在教学中还可以进一步拓展。
本实验是以数字化实验作为一种手段,结合实验现象与图像,从定量的角度帮助学生深化对碳酸钠的性质以及酸碱滴定、滴定突跃和滴定误差等知识的理解,从而让学生触类旁通、举一反三。本实验不仅可以作为学生实验,帮助学生理解酸碱滴定等知识,还可以对本文定量分析等内容进行改造,运用于真实的课堂教学中,以培养学生的问题解决能力和定量计算能力。
参考文献:
[1]宋心琦主编. 普通高中课程标准实验教科书·化学反应原理(选修4)[M]. 北京: 人民教育出版社, 2009.
[2]王明召, 高盘良, 王磊. 普通高中课程标准实验教科书·化学反应原理(选修4)[M]. 济南: 山东科技出版社, 2007.
[3]周存军. 谈探究碳酸钠性质实验的创新[J]. 化学教学, 2014, (5): 50~52.
[4]伍强, 方瑞光. 碳酸钠和碳酸氢钠与稀盐酸反应实验的创新设计[J]. 化学教学, 2016, (8): 63~65.
[5]伍强. 碳酸钠和碳酸氢钠性质对比实验的研究[J]. 化学教学, 2015, (12): 48~50.
[6]伍强. 碳酸钠溶液与稀盐酸反应实验探究[J]. 化学教学, 2014, (9): 57~58.
[7]王娜, 白新瑞. 关于碳酸钠和碳酸氢钠与盐酸反应的实验研究[J]. 化学教学, 2007, (10): 8~9.
[8]吴晓红, 任斌, 肖敏等. 利用手持技术探究碳酸钠和碳酸氢钠与稀盐酸的反应本质[J]. 教学仪器与实验, 2015, (4): 32~33.
[9]孙卫中. 碳酸钠和碳酸氢钠定量实验的开发与研究[J]. 中学化学教学参考, 2014, (7): 53~55.
[10]徐建菊, 吴晓红. 借助传感器探究碳酸钠与碳酸氢钠的热稳定性[J]. 化学教学, 2019, (4): 63~66.
[11][12]武漢大学, 中国科学技术大学, 中山大学等. 分析化学(第5版)[M]. 北京: 高等教育出版社, 2006: 146, 147.
