提取方法对奇亚籽油品质特性的影响
2020-04-02高妮娜1刘鸿铖1岩1刘婷婷
高妮娜1,2,刘鸿铖1,2,邹 岩1,3,刘婷婷
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;(2.农业农村部食用菌加工技术集成科研基地,吉林长春 130118;(3.吉林省粮食精深加工与副产物高效利用技术创新重点实验室,吉林长春 130118;(4.吉林省粮食精深加工与高效利用工程研究中心,吉林长春 130118)
奇亚籽(Chia Seed)为唇形科,鼠尾草属,芡欧鼠尾草(SalviahispanicaL.)的种子,原产于墨西哥南部和危地马拉北部[1]。2014年国家卫生和计划生育委员会发布的第10号文件《关于批准塔格糖等 6种新食品原料的公告》中批准奇亚籽为新食品原料[2]。奇亚籽含油量为25%~40%,在已知植物中奇亚籽油的α-亚麻酸含量最高(约68%)[3]。奇亚籽油脂肪酸组成中亚麻酸(ω-3)和亚油酸(ω-6)占总脂肪酸含量的80%以上[4],ω-3与ω-6多不饱和脂肪酸的比值高于大多数植物油约为3.18~4.18[5],奇亚籽油还含有其他生物活性成分,如生育酚、植物甾醇[6],酚类化合物包括绿原酸、杨梅素和山奈酚等[7],更具有降低血脂、调节血糖和预防心血管疾病等诸多功能[8-9]。关于抗氧化活性研究rica等[10]发现,奇亚籽和奇亚籽油可能成为具有高抗氧化能力的功能性食品。
目前,油脂的提取方法包括有机溶剂浸提法、压榨法、水酶法、超临界CO2萃取法等[11]。其中压榨法和浸提法提油较为普遍,压榨法操作简单,但易使油脂色泽加深而降低油脂的品质,且压榨过程中温度过高导致饼粕蛋白变性严重[12];有机溶剂浸提法的产油率较高,生产成本低,但得到毛油品质差,并且使用的溶剂多为易燃易爆品,存在一定危险性[13]。水酶法提取油脂条件温和,脱脂后饼粕蛋白变性程度低,但酶制剂价格较高,提取过程耗水量大,易造成生产成本的增加,且存在油脂与乳浊液分离困难的缺陷[14-15]。超临界CO2萃取法是在较低温度和无氧条件下进行,萃取物和萃余物均无溶剂残留,并能够有效保护生物活性成分[16],但由于设备一次性投资较大,因此其应用受到限制[17]。
奇亚籽油还有其他提取方式,岳金霞等[18]采用微波辅助法提取奇亚籽油并对其脂肪酸组成进行分析。王志强等[19]采用索氏提取法提取奇亚籽油脂,并对其甲酯化处理后用气相色谱法进行分析。本文将分别采用压榨法、有机溶剂浸提法、水酶法和超临界CO2萃取法制取奇亚籽油,运用气相色谱与质谱联用技术分析奇亚籽油脂肪酸组成,测定了其理化性质,油脂氧化稳定性,总酚、黄酮含量及体外抗氧化能力,以期为今后奇亚籽油的开发利用提供理论参考。
1 材料与方法
1.1 材料与仪器
奇亚籽(Chia Seed) 杭州绿之宝食品有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 美国Sigma公司;正乙烷(色谱纯) 赛默飞世尔科技公司;脂肪酶(酶活力275 IUN/g) 诺维信(中国)生物技术有限公司;福林酚 厦门海标科技有限公司;没食子酸、芦丁 国药集团化学试剂有限公司;冰乙酸、三氯甲烷、石油醚、异丙醇、无水乙醇、浓盐酸 天津新通精细化工有限公司;氢氧化钾、氢氧化钠、过硫酸钾等 均为国产分析纯。
ZYJ901榨油机 江门市贝尔斯顿电器有限公司;HA121-50-02超临界萃取装置 江苏南通华安超临界萃取有限公司;HZS-HA水浴振荡器 哈尔滨市东联电子技术开发有限公司;TSQ9000气质联用仪 赛默飞世尔科技(中国)有限公司;SNB-1数字旋转粘度计 上海恒平科学仪器有限公司;WSL-2比较测色仪(133.4 mm槽) 上海昕瑞仪器仪表有限公司;JJ500型电子精密天平 梅特勒-托利多仪器有限公司;PHS-3C PH计 上海仪电科学仪器股份有限公司;KDC-1042型低速离心机 安徽中科中佳科学仪器有限公司;DIKW-4电热数显恒温水浴锅 杰瑞尔电器公司;UV-2300紫外分光光度计 北京普析通用仪器有限公司;ZDF-6050型真空干燥箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 奇亚籽油的提取
1.2.1.1 压榨法 取200 g奇亚籽,使用螺旋榨油机进行压榨,接收奇亚籽油,室温静置10 min,在3500 r/min条件下离心10 min,取上层得到压榨油样,将奇亚籽油存放在棕色瓶中,在4 ℃环境下冷藏待用。
1.2.1.2 溶剂浸提法 奇亚籽经碾压处理,过60目筛后称取10.000 g奇亚籽仁粉(精确至0.001),石油醚为溶剂,使用索氏提取器在38 ℃条件下抽提8 h,抽提完毕后,用旋转蒸发仪蒸馏收集石油醚,将旋蒸后奇亚籽油放在棕色瓶中,在4 ℃环境下冷藏待用[20]。
1.2.1.3 水酶法 奇亚籽经碾压处理,称取过60目筛奇亚籽仁粉200 g,按照料液比1∶5(奇亚籽仁粉与水体积质量比)添加蒸馏水,用0.1 mol/L的NaOH溶液准确调节料液比pH至8,调节温度至55 ℃,添加0.5%的脂肪酶(以奇亚籽仁质量计),酶解3 h,酶解完成后,将酶解液置于95 ℃水浴中灭酶15 min,冷却至室温后移至离心瓶中于3800 r/min离心20 min,收集上层清油,将奇亚籽油存放在棕色瓶中,在4 ℃环境下冷藏待用[21]。
1.2.1.4 超临界CO2萃取法 奇亚籽经碾压处理,过60目筛,称取200 g奇亚籽仁粉于超临界萃取罐中,在物料粒度60目、萃取压力25 MPa、萃取温度50 ℃条件下萃取2.5 h。收集萃取油,在3500 r/min条件下离心10 min得到超临界油样,取上层奇亚籽油存放在棕色瓶中,在4 ℃环境下冷藏待用。
1.2.2 奇亚籽油脂得率的计算
式中:W奇亚籽油脂得率,%;m0表示奇亚籽油质量,g;m1表示物料质量,g。
1.2.3 奇亚籽油的理化指标测定 水分及挥发物测定:参考GB 5009.236-2016《动植物油脂水分及挥发物的测定》,采用第二法电热干燥箱法测定;酸值测定:参考GB 5009.229-2016《食品中酸价的测定》,采用第一法冷溶剂指示剂滴定法测定;过氧化值测定:参考GB 5009.227-2016《食品中过氧化值的测定》,采用第一法滴定法测定;皂化值测定:参考GB/T 5534-2008《动植物油脂皂化值的测定》;色泽(红值、黄值):参照GB 22460-2008《动植物油脂罗维朋色泽的测定》,采用罗维朋比色计法(133.4 mm槽)测定;透明度、气味、滋味测定:参照GB 5525-2008《植物油脂透明度、气味、滋味鉴定法》;粘度的测定:在室温条件下,使用数字旋转粘度计测定。
1.2.4 奇亚籽油的脂肪酸组成及含量测定
1.2.4.1 样品的甲酯化 精确称取50 mg奇亚籽油于干燥洁净的25 mL试管中,加入5 mL正己烷(色谱纯),混合使油脂溶解,再加入预先配制的0.8 mol/L的氢氧化钾-甲醇溶液2 mL,混匀,于30 ℃恒温水浴加热15 min至油珠完全溶解。取出试管竖直静置分层,加入约0.5 g无水硫酸钠,分层后用针头过滤器吸取上层正己烷,0.22 μm滤膜过滤,放入色谱进样瓶中进行GC-MS分析。
1.2.4.2 GC-MS分析条件 气相色谱条件:HP-5ms石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度220 ℃,110 ℃保持5 min,以升温速率10 ℃/min升至175 ℃,保持4 min,以升温速率2 ℃/min升至185 ℃,保持4 min,以升温速率10 ℃/min升至220 ℃,保持1 min,再以10 ℃/min升至280 ℃,保持4 min。载气为高纯度氦气,流速为1.0 mL/min,分流比80∶1,进样量为1 μL。
质谱条件:电子轰击(EI)离子源;电子倍增器电压1.25 kV;电子能量70 eV;传输管线温度250 ℃;离子源温度230 ℃;溶剂延时4 min;质量扫描范围为m/z 40~600 u。通过将获得的数据与标准质谱数据库(Wiley和NIST文库)进行比较来分析质谱,组分的相对含量由面积归一化法确定。
1.2.5 Schaal烘箱法测定奇亚籽油氧化稳定性 分别取四种新提取的奇亚籽油100.0 g放入200 mL 烧杯中,敞口置于(63±0.5) ℃的烘箱中,每隔3 h测定油样的过氧化值。
1.2.6 奇亚籽油总酚及总黄酮含量的测定
1.2.6.1 奇亚籽油中总酚和黄酮的提取 分别称取(10.00±0.01) g奇亚籽油,加入20 mL 80%乙醇溶液,超声波浸提1 h,3000 r/min离心10 min,收集上清液,将奇亚籽油再次加入20 mL 80%乙醇溶液,超声波浸提1 h,3000 r/min离心10 min,收集上清液,合并两次上清液转移至25 mL容量瓶中,用80%乙醇溶液定容,避光保存备用。
1.2.6.2 奇亚籽油总酚含量的测定 采用Folin-ciocalteu法,参照Oliveira-Alves等[22]的方法并略有改动。
标准曲线的绘制:准确称取没食子酸标准品0.0100 g,配成100 μg/mL的没食子酸标准溶液,继续将其稀释,配制成10、20、30、40、50 μg/mL的标准溶液。吸取5 mL各梯度溶液置于100 mL容量瓶中,分别加入1 mL福林酚溶液和3 mL 7.5%碳酸钠溶液,充分混匀1 min,室温下暗处放置2 h显色,在波长765 nm处测定吸光度,以吸光度(Y)为纵坐标,没食子酸标准溶液质量浓度(X)为横坐标,得到回归方程:Y=0.0103X-0.0014(R2=0.9989)。
总酚含量的测定:取5 mL奇亚籽油乙醇溶液,按照上述标准曲线测定方式,测定其在波长765 nm处测定吸光度,根据吸光度在标准曲线上相应的质量计算总酚含量。
1.2.6.3 奇亚籽油总黄酮含量的测定 参照Bouayed[23]等的方法并略有改动。标准曲线的绘制:准确称取芦丁标准品0.0100 g,用60%乙醇溶液溶解并定容至100 mL容量瓶刻度线,摇匀,配成100 μg/mL的芦丁标准溶液,继续将其稀释,制备20、40、60、80、100 μg/mL的标准梯度溶液,取1 mL各标准梯度溶液置于10 mL容量瓶中,分别加入4 mL 60%乙醇溶液,0.5 mL 5%亚硝酸钠溶液,混匀后静置6 min,加入10%硝酸铝溶液0.5 mL,6 min后加入4 mL 1.0 mol/L氢氧化钠溶液,摇匀后放置10 min,于波长510 nm处测定吸光度,以吸光度(Y)为纵坐标,芦丁标准溶液质量浓度(X)为横坐标,得到回归方程:Y=0.0085X+0.0092(R2=0.9976)。
样品检测:吸取2 mL待测溶液,按照标准曲线的测定方法,测定其在波长510 nm处吸光度,根据吸光度在标准曲线上相应的质量浓度计算黄酮含量。
1.2.7 奇亚籽油抗氧化活性研究
1.2.7.1 奇亚籽油DPPH自由基清除能力测定 参照白章振等[24]方法检测,准确称取3.94 mg的DPPH试剂,用少量无水乙醇溶解并定容至100 mL容量瓶中,配成0.1 mmoL/L溶液于4 ℃冰箱避光备用。将不同方法提取的奇亚籽油用乙醇稀释至10~50 mg/mL,取样液1 mL加入DPPH 4 mL充分摇匀,避光反应40 min后在517 nm波长处测定吸光度为A1。不加样液测得空白吸光值A0,不加DPPH对照的吸光值A2,见公式(2)。
式(2)
1.2.7.2 奇亚籽油ABTS+·清除能力测定 采用郭刚军等[25]方法稍作改进。将7 mmol/L的ABTS溶液15 mL加入264 μL 140 mmol/L过硫酸钾溶液,置于暗处15 h,加无水乙醇稀释80倍左右,在波长734 nm处吸光度0.700±0.004。取2 mL油样与乙醇溶液加入4 mL ABTS溶液混匀,静置6 min,在波长734 nm处测定吸光度,记为A1。用无水乙醇代替样液测定吸光度,记为A0,按公式(3)计算。

式(3)
式(4)

表2 不同方法提取的奇亚籽油理化指标分析Table 2 Analysis of physical and chemical indicators of Chia seed oil extracted by different methods
注:同列肩标不同小写字母表示差异显著(P<0.05)。
1.3 数据处理
采用SPSS 19.0数据统计软件和Origin 8.0软件对有关实验数据做相应的数据处理和分析,应用单因素方差分析与邓肯氏法进行显著性分析,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 不同方法提取的奇亚籽油脂得率的比较
由表1可以看出,4种方法油脂提取率超临界CO2萃取法(85.5%)>溶剂浸提法(65.8%)>压榨法(40.9%)>水酶法(33.2%)。水酶法提取的奇亚籽油的得率低于压榨法、溶剂浸提法和超临界CO2萃取法,该方法大量油脂在由蛋白质构成的细胞质膜中,产生乳化现象,所以奇亚籽油得率偏低。其次压榨法提取奇亚籽油的得率低于超临界CO2萃取法和溶剂提取法,由于压榨法是采用挤压的方式,将油脂释放出,所以饼粕含油率较高,四种方法奇亚籽油得率差异显著(P<0.05)。

表1 不同方法提取的奇亚籽油脂得率的比较Table 1 Comparison of the yields ofChia seeds extracted by different methods
注:同列肩标不同小写字母表示差异显著(P<0.05)。
2.2 不同方法提取的奇亚籽油理化特性比较
由表2可知压榨法、溶剂浸提法、水酶法和超临界CO2萃取法制取奇亚籽油的黄值均为70±0差异不显著,四种方法提取的奇亚籽油中水酶法的红值最高,为6.6±0.1,表明水酶法奇亚籽油颜色偏黄严重,奇亚籽油呈现橙黄色,溶剂浸提法和超临界CO2萃取法红值远低于水酶法奇亚籽油,说明黄色稍淡,可能是胡萝卜素等脂溶性色素对奇亚籽油颜色影响较大,此外磷脂、甾醇等在压榨过程中发生氧化,也会对油脂的颜色产生影响[27]。四种不同方法提取奇亚籽油灰值在0.3~0.4,无显著性差异(P>0.05),说明四种方法提取的奇亚籽油均为亮色。
通过对压榨法、溶剂浸提法、水酶法、超临界CO2萃取法得到的奇亚籽油理化性质进行分析比较,由表2可知,不同方法提取奇亚籽油的水分及挥发物质量分数、粘度、皂化值有一定差异,另外,酸价、过氧化值存在显著差异(P<0.05)。压榨法、溶剂浸提法、水酶法、超临界CO2萃取法提取奇亚籽油的过氧化值分别为0.0185、0.0320、0.0244、0.0137 g/100 g,其中溶剂浸提法和水酶法在萃取奇亚籽油操作中,通过持续加热并获得油脂,所以过氧化值偏高,水分及挥发物质量分数较高、有异常气味,需要进一步精炼才能达到食用油的标准。超临界CO2萃取法的提取温度相对较低,且在超临界状态下与外界隔离,所以氧化作用较小;而压榨法使用家用榨油机,压榨过程中物料之间相互挤压,螺杆会摩擦产热,加速了油脂的氧化过程,因此较超临界CO2萃取法过氧化值较高。
2.3 不同方法提取的奇亚籽油脂肪酸组成分析

表3 不同方法制取奇亚籽油的脂肪酸组成及含量Table 3 Fatty acid composition and content of Chia seed oil prepared by different methods

图1 不同提取方式奇亚籽油脂肪酸甲酯的总离子流图Fig.1 Total ion chromatogram of different extraction methods of Chia seed oil fatty acid methyl ester注:A:压榨法;B:溶剂浸提法;C:水酶法;D:超临界CO2萃取法。1:棕榈酸甲酯;2:14-甲基十六烷酸甲酯;3:亚油酸甲酯;4:亚麻酸甲酯;5:硬脂酸甲酯;6:17-甲基硬脂酸甲酯;7:花生四烯酸甲酯;8:二十烷酸甲酯。
由表3中可以看出,压榨法、溶剂浸提法、水酶法和超临界CO2萃取法的奇亚籽油脂肪酸主要由棕榈酸、亚油酸、亚麻酸、硬脂酸组成,由于4种方法提取奇亚籽油的原理及方法各有不同,导致主要脂肪酸组成含量略有差别。在这4种主要脂肪酸中,棕榈酸和硬脂酸是饱和脂肪酸,亚油酸、亚麻酸是不饱和脂肪酸。多不饱和脂肪酸的相对含量依次为水酶油(89%)>超临界CO2萃取油(88.41%)>压榨油(88.27%)>溶剂浸提油(88.2%),均在88%以上,其中亚麻酸含量在69.67%~70.01%,亚油酸含量在18%~18.8%。4种方法对奇亚籽油的主要脂肪酸的组成和含量并没有显著差异(P>0.05)。
2.4 不同方法提取奇亚籽油的氧化稳定性研究
从图2可以看出,随着氧化时间的增加,四种方法提取的奇亚籽油过氧化值随之增大。在GB 271-2018《食品安全国家标准植物油》标准中,以过氧化值大于0.25 g/100 g为油脂标准[28]。当氧化时间达到30 h时,溶剂浸提法的过氧化值最大为0.2718 g/100 g,此时压榨法和水酶法的奇亚籽油也超过油脂标准0.25 g/100 g,超临界CO2萃取法氧化速度最慢在30 h后过氧化值达到0.25 g/100 g。综上可知,四种方法提取的奇亚籽油氧化速度差别不大,无显著性差异(P>0.05)。

图2 不同方法提取奇亚籽油过氧化值的变化Fig.2 Changes in the peroxide value ofChia seed oil extracted by different methods
2.5 不同方法提取的奇亚籽油总酚和总黄酮含量分析
研究表明多数植物油中含有多酚,它是一种纯天然且抗氧化性很强的抗氧化剂,并且能清除体内多余的自由基,调节机体免疫力,更具有预防心脑血管疾病和降血糖等功能[29]。由表4可以看出,不同方法提取的奇亚籽油总酚含量有显著差异(P<0.05),含量大小顺序为:压榨法油>超临界油>溶剂浸提油>水酶油。
由表4可知,不同方法提取奇亚籽油类总黄酮含量差异显著(P<0.05),超临界CO2萃取油中黄酮含量为(222.09±0.12) mg/kg,高于其他3种提取方法。压榨油黄酮含量为(217.74±0.22) mg/kg,由于螺旋压榨过程中随着温度的升高,使部分黄酮类物质发生氧化。水酶法提取油中黄酮含量最低,可能是在提油过程中加入碱液,使黄酮苷类物质溶于碱液,导致黄酮类物质的流失。溶剂浸提油黄酮含量略高于水酶油,可能是溶剂极性的原因导致黄酮未大量溶出[30]。

表4 不同方法提取的奇亚籽油总酚和黄酮含量分析Table 4 Analysis of total phenol and flavonoidsin Chia seed oil extracted by different methods
注:同列肩标不同小写字母表示差异显著(P<0.05)。
2.6 不同方法提取的奇亚籽油抗氧化活性研究
2.6.1 不同方法提取的奇亚籽油对DPPH自由基的清除作用 压榨法、溶剂浸提法、水酶法和超临界萃取法油脂随油样质量浓度变化对DPPH自由基的清除能力如图3所示,四种奇亚籽油表现出的抗氧化能力各不相同,这应该与奇亚籽油中含有的多酚类和黄酮类化合物等具有的抗氧化性质有关。IC50值越小,说明奇亚籽油清除自由基效果越强,奇亚籽油的抗氧化能力越好[31]。4种方法测得的IC50值依次为水酶法(36.24 mg/mL)>溶剂浸提法(31.93 mg/mL)>压榨法(29.67 mg/mL)>超临界萃取法(28.04 mg/mL),进一步说明压榨法和超临界萃取法奇亚籽油呈较强的DPPH自由基清除能力。与其它3种方法相比,超临界萃取法表现出稍强的清除能力,说明超临界萃取法保留了更多抗氧化物质。
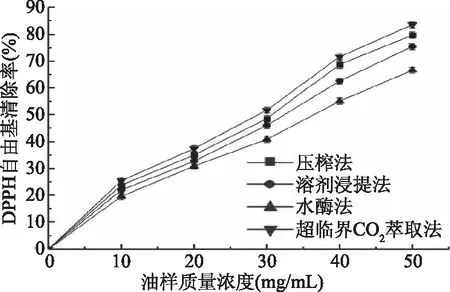
图3 不同方法提取的奇亚籽油对DPPH自由基的清除能力比较Fig.3 Comparison of scavenging ability of Chia seed oilextracted by different methods for DPPH free radicals

图4 不同方法提取的奇亚籽油对ABTS+·的清除能力比较Fig.4 Comparison of the scavenging ability of Chia seed oilextracted by different methods for ABTS+·
2.6.2 不同方法提取的奇亚籽油对ABTS+·的清除作用 由图4可以看出,不同提取方式奇亚籽油对ABTS+·的清除能力均随着油样质量浓度的增大而增强,相同浓度下超临界萃取奇亚籽油对ABTS+·的清除能力明显高于溶剂浸提法和水酶法油,当IC50值越小,说明奇亚籽油清除ABTS+自由基效果越强,奇亚籽油的抗氧化能力越好。4种方法测得的IC50值依次为水酶法(39.21 mg/mL)>溶剂浸提法(37.84 mg/mL)>压榨法(35.64 mg/mL)>超临界萃取法(33.70 mg/mL),与清除DPPH自由基的趋势相同。进一步说明超临界萃取法奇亚籽油呈较强的ABTS+自由基清除能力。
2.6.3 不同方法提取的奇亚籽油对超氧阴离子自由基的清除作用 由图5可以看出,压榨法、溶剂浸提法、水酶法和超临界萃取法奇亚籽油对超氧阴离子自由基都有较强的清除作用。随着油样质量浓度的增加,其对超氧阴离子自由基的清除作用也增强。其中,超临界萃取油对超氧阴离子自由基的清除率优于水酶法和溶剂浸提法,但略低于压榨油。4种方法测得的IC50值依次为溶剂浸提法(11.18 mg/mL)>水酶法(10.68 mg/mL)>超临界萃取法>(10.08 mg/mL)>压榨法(9.76 mg/mL),说明采用超临界萃取法得到的奇亚籽油呈较强的超氧阴离子自由基清除能力。
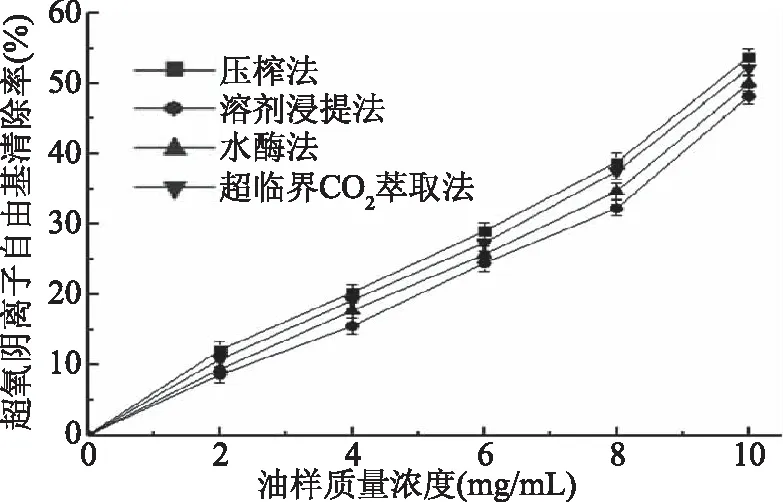
图5 不同方法提取的奇亚籽油对超氧阴离子自由基的清除能力比较Fig.5 Comparison of scavenging ability of Chia seed oilextracted by different methods for superoxide anion radical
3 结论
本实验采用4种不同方法提取奇亚籽油,并对奇亚籽油的基本理化指标进行测定,同时对脂肪酸组成及含量,总酚和类黄酮含量进行了分析,评价了其体外抗氧化能力。结果表明,在四种方法提取的奇亚籽油中,超临界CO2萃取法油脂得率最高且品质最佳,其酸价、过氧化值、色泽和气味,均符合国家标准,多不饱和脂肪酸质量分数,优于压榨法和溶剂浸提法;加速氧化实验中氧化速度最慢在30 h后过氧化值达到0.25 g/100 g;总酚和类黄酮含量等指标优于水酶法和溶剂浸提法。超临界CO2萃取得到的奇亚籽油体现出较强的抗氧化活性,对DPPH自由基和ABTS+自由基有较强的清除作用,对超氧阴离子自由基也表现出一定清除能力。
奇亚籽油是对人体有益的植物油,不同方法提取的奇亚籽油特性略有不同,抗氧化能力也存在差异。压榨法虽然也表现出良好特性,但出油率较低,油脂颜色过深会增加后续处理部分,降低了油脂品质。有机溶剂法存在溶剂残留问题、工艺流程复杂等缺点。水酶法存在出油率低、难分离等缺点。超临界CO2萃取法操作简单、产油全过程无污染,对奇亚籽有效成分破坏少,不影响萃余物的再次利用,且萃取率高,更适合奇亚籽油的提取。综上所述,超临界CO2萃取法更适合于奇亚籽油的提取,为今后奇亚籽油的工业化生产提供基础依据。
