双波长法测定冰温贮藏西洋参中直链淀粉和支链淀粉的含量
2020-04-02
(黑龙江省农业科学院食品加工研究所,黑龙江哈尔滨 150086)
西洋参(PanaxquinquefoiumL.)为五加科人参属多年生宿根性草本植物[1],既是名贵中药材,又是保健食品的重要原料,具有降血压、降血糖、免疫调节以及抗癌等多种生理功能,因有较高的医疗保健价值[2-7]。目前,市售的西洋参多以干品为主,鲜参仅在每年秋冬交替之际有短暂供应。鲜参的活性成分的含量和种类都大大优于干参,因此,鲜西洋参愈来愈受到人们的青睐[8]。然而,由于鲜西洋参采摘时间固定、贮藏时间较短、无法实现全年供应,因此严重地限制其在加工领域的应用。鉴于此,科研工作者们在西洋参保鲜技术方面进行了研究[9],付建国等[10]利用冰温保鲜技术使西洋参保持鲜活状态达到12个月以上,实现了鲜参的全年供应,这为鲜西洋参的加工利用提供了原料保障。冰温保鲜技术是将包括果蔬、冷鲜肉和水产品在内的食品贮藏在冰点至0 ℃之间以实现延长其保质期的一种非冻结保鲜技术,其具有不损害食品细胞,有效抑制有害微生物的滋生以及最大程度的抑制食品细胞生命活动等特点[11]。淀粉是西洋参的主要组成成分,也是最主要的储能物质。西洋参中的淀粉包括直链淀粉和支链淀粉,其含量和组成比例对西洋参营养功能与加工品质等都有一定的影响[12]。然而有研究表明,某些淀粉类植物在冰温贮藏过程中,会通过呼吸作用消耗体内的淀粉[13],因此,测定冰温贮藏过程中西洋参中直链淀粉和支链淀粉的含量变化有助于分析其保鲜品质和提出合理的冰温保鲜模式。
目前,直链淀粉和支链淀粉的测定方法主要为碘比色法,而碘比色法又可分为单波长法、双波长法以及多波长法[14],其中,单波长法因无法区分直链淀粉和支链淀粉,使得测定结果不够准确[15];而多波长法虽能区分直链淀粉和支链淀粉,但方法相对繁琐,应用性不强[16];双波长法是近些年应用广泛的测定方法[17],不但可有效的消除直链淀粉和支链之间吸收背景的交互影响[18],降低误差[19],提高准确度[20],而且操作简便、方法实用[21],具有准确度高和效率高等优点[22]。
因此,本文以冰温贮藏的西洋参为原料,采用双波长法建立西洋参中直链淀粉和支链淀粉的检测方法,分析冰温贮藏过程中西洋参中直链淀粉和支链淀粉的含量变化,为实现鲜西洋参的高品质加工利用提供理论和技术依据。
1 材料与方法
1.1 材料与仪器
西洋参(四年生) 采自黑龙江省海林市;直链淀粉标准品(马铃薯源) 农业部谷物及制品质检中心;支链淀粉标准品(马铃薯源) 上海源叶生物科技有限公司;氢氧化钾、盐酸、碘化钾、碘、石油醚(60~90 ℃)、无水乙醇等 均为国产分析纯。
BC/BD-379HN冰柜 青岛海尔股份有限公司;CT410旋风磨 丹麦Foss公司;CARY100紫外分光光度计 美国Varian公司;DK-98-IIA电热恒温水浴锅 天津市泰斯特仪器有限公司;RLPHR1-4LSC真空冷冻干燥机 德国Martin Christ公司;3-18K冷冻离心机 德国Sigma公司;XS204分析天平、Seven Compact pH计 瑞士Mettler Toledo公司。
1.2 实验方法
1.2.1 西洋参的冰温贮藏 挑选大小均一、完整无病害的西洋参放入内含塑料薄膜的泡沫箱内,再将含水量15%左右的泥沙和锯末先后覆盖在参体表面,然后将塑料薄膜封口、泡沫箱封箱,移置冰柜中,在泡沫箱上覆盖一层棉被,并在冰柜上、中、下层分别放置电子温度计,调节温度至-8~-3 ℃进行冰温储藏。
1.2.2 双波长测定直链淀粉与支链淀粉含量方法的建立
1.2.2.1 直链淀粉与支链淀粉标准物质纯度确定 由于目前市售的直链淀粉和支链淀粉标准物质无法提供纯度,因此需对其纯度进行表征。参考石海信等[23]的方法,准确称取2.5 mg直链淀粉和10 mg支链淀粉分别放入50 mL烧杯中,加入几滴无水乙醇,再分别加入10 mL 1 mol/L氢氧化钠溶液,80 ℃水浴加热10 min至样品充分溶解,摇匀后分别取出1 mL直链淀粉与支链淀粉溶液放于50 mL烧杯中进行显色操作,再分别加入25 mL去离子水,以0.1 mol/L的盐酸溶液调节pH至3.5,再分别加入0.50 mL碘试剂(含20 mg/mL碘化钾和2 mg/mL碘)和0.08 g酒石酸氢钾,将所获得的溶液分别移至50 mL容量瓶中用去离子水准确定容,室温静止20 min,以相同质量浓度的碘溶液作空白,在波长400~800 nm范围内进行光谱扫描,测定最大吸收波长λmax和该波长下的吸光度Amax,蓝值的计算如公式(1)所示。

式(1)
式中,M为直链淀粉或支链淀粉质量浓度(mg/100 mL)。
1.2.2.2 直链淀粉和支链淀粉标准工作液的配制 准确称取直链淀粉和支链淀粉各0.10 g,分别放入50 mL烧杯中,加入几滴无水乙醇,再分别加入浓度为1 mol/L氢氧化钠溶液10 mL,80 ℃水浴加热10 min,至样品充分溶解,然后将所获得溶液移至100 mL容量瓶中,用去离子水准确定容,即得1 mg/mL直链淀粉和支链淀粉标准工作液。
1.2.2.3 直链淀粉与支链淀粉检测波长确定和标准曲线绘制 分别准确吸取直链淀粉标准工作液1.60 mL和支链淀粉标准工作液2.00 mL,放于50 mL烧杯中按照1.2.2.1进行显色操作,在波长400~800 nm范围内进行光谱扫描,确定直链淀粉测定波长λ1和支链淀粉测定波长λ3,然后将直链淀粉和支链淀粉标准工作液扫描光谱叠加,绘制在同一坐标系里,采用等吸收点作图法,确定直链淀粉参比波长λ2和支链淀粉参比波长λ4。
分别准确吸取直链淀粉标准工作液0.00、0.40、0.80、1.20、1.60、2.20、2.40、2.80 mL和支链淀粉标准工作液0.00、0.50、1.00、1.50、2.00、2.50、3.00、3.50 mL放于50 mL烧杯中按照(1)进行显色操作,以去离子水为空白,对不同浓度的直链淀粉工作液在λ1和λ2波长下分别测定吸光度值Aλ1和Aλ2,以ΔA直=Aλ1-Aλ2为纵坐标,直链淀粉标准工作液浓度为横坐标,绘制直链淀粉的标准曲线,对不同浓度的支链淀粉工作液在λ3和λ4波长下分别测定吸光度值Aλ3和Aλ4,以ΔA支=Aλ3-Aλ4为纵坐标,支链淀粉标准工作液浓度为横坐标,绘制支链淀粉的标准曲线。
1.2.2.4 样品中直链淀粉与支链淀粉含量测定 分别将冰温贮藏0、3、6、9、12个月的西洋参取出洗净切片,然后进行真空冷冻干燥和粉碎过筛(80目)处理,得西洋参冻干粉。测鲜参含水率,记为W1。将西洋参冻干粉进行索氏提取脱脂处理(石油醚回流4 h),测脂肪含量,记为W2;精确称取贮藏不同月份的脱脂西洋参冻干粉样品0.10 g,分别放入50 mL烧杯中,加入几滴无水乙醇,再分别加入浓度为1 mol/L氢氧化钠溶液10 mL,80 ℃水浴加热10 min,使样品搅拌溶解,然后用去离子水定容至50 mL,静置20 min后过滤,得供试样品溶液。分别取5 mL供试样品溶液放于50 mL烧杯中,按照1.2.2.1进行显色操作,以去离子水为空白,在λ1、λ2、λ3和λ4波长下,分别测定各个样品的吸光度,然后根据标准曲线,计算出样品溶液中直链淀粉与支链淀粉的浓度。冰温贮藏的西洋参中直链淀粉和支链淀粉含量的计算,如公式(2)和(3)所示。
直链淀粉含量(%)=[C直×50×50×(1-W1-W2)]/(5×0.10×1000)×100
式(2)
支链淀粉含量(%)=[C支×50×50×(1-W1-W2)]/(5×0.10×1000)×100
式(3)
式中,C直为样品溶液中直链淀粉的质量浓度(mg/mL);C支为样品溶液中支链淀粉的质量浓度(mg/mL)。
1.2.3 方法学验证 稳定性试验:将冰温贮藏0个月的西洋参按1.2.2.4进行操作制备供试样品溶液,每隔10 min测得和计算直链淀粉和支链淀粉的吸光度差值ΔA直和ΔA支,计算直链淀粉和支链淀粉的RSD值,考察样品溶液的稳定性。
精密度试验:将冰温贮藏0个月的西洋参按1.2.2.4进行操作制备供试样品溶液,重复6次,测得和计算直链淀粉和支链淀粉的吸光度差值ΔA直和ΔA支,计算直链淀粉和支链淀粉的RSD值,考察样品溶液的精密度。
准确性试验:将冰温贮藏0个月的西洋参按1.2.2.4进行操作制备供试样品溶液,测得和计算直链淀粉和支链淀粉的吸光度差值ΔA直和ΔA支,并计算供试样品溶液直链淀粉和支链淀粉初始质量浓度;再分别向240 mL供试样品溶液中分别加入10 mL浓度为0.05、0.1 mg/mL的直链淀粉标准工作液和0.2、0.3 mg/mL支链淀粉标准工作液,250 mL容量瓶定容,测得和计算加标后的直链淀粉和支链淀粉的吸光度差值ΔA直和ΔA支,并计算供试样品溶液直链淀粉和支链淀粉加标后质量浓度,然后根据结果,计算直链淀粉和支链淀粉的加标回收率和RSD值,考察样品溶液的准确性。
1.3 数据处理
每组实验均进行三次平行实验,测定结果以平均值±标准差表示,采用Excel 2010软件进行统计分析,Origin 8.5软件作图处理。
2 结果与分析
2.1 直链淀粉与支链淀粉标准物质纯度
蓝值和最大吸收波长是反映淀粉与碘结合程度的重要指标,由于不同纯度的淀粉与碘形成的复合物吸收峰存在一定的差异,因此,其也可作为直链淀粉和支链淀粉的纯度表征的方法。直链淀粉与碘形成的复合物吸收峰波长一般在600~680 nm之间,蓝值在0.8~1.2之间;支链淀粉与碘形成的复合物吸收峰波长一般在520~590 nm之间,蓝值在0.08~0.22之间[24]。本文选用直链淀粉标准物质的蓝值和最大吸收波长分别为1.092和630 nm,支链淀粉标准物质蓝值和最大吸收波长分别为0.136和520 nm。因此,表明本文选用的直链淀粉和支链淀粉标准物质纯度较高,可用来进行定量分析。
2.2 直链淀粉与支链淀粉测定波长的确定
分别对直链淀粉与支链淀粉标准工作液在400~800 nm进行光谱扫描,将二者扫描光谱图叠加绘制在同一坐标系内,如图1所示。依据双波长法等吸收原理,采用作图法确定直链淀粉测定波长为630 nm,参比波长为423 nm,支链淀粉测定波长为520 nm,参比波长为771 nm。

图1 直链淀粉和支链淀粉测定波长和参比波长Fig.1 Determination wavelength and referencewavelength of amylose and amylopectin
2.3 直链淀粉与支链淀粉标准曲线的绘制
以直链淀粉浓度为横坐标,以测定波长630 nm和参比波长423 nm下测得的吸光度的差值为纵坐标,绘制直链淀粉标准曲线如图2,确定其回归方程为:y=23.046x+0.0062,决定系数R2=0.998,表明在直链淀粉浓度0~0.056 mg/mL范围内线性关系良好,符合比耳定律;以支链淀粉浓度为横坐标,以测定520 nm和参比波长771 nm下测得的吸光度的差值为纵坐标,绘制支链淀粉标准曲线如图3所示,确定其回归方程为:y=2.5021x-0.0017,决定系数R2=0.997,表明在支链淀粉浓度0~0.070 mg/mL范围内线性关系良好,符合比耳定律。

图2 直链淀粉标准曲线Fig.2 Standard curve of amylose
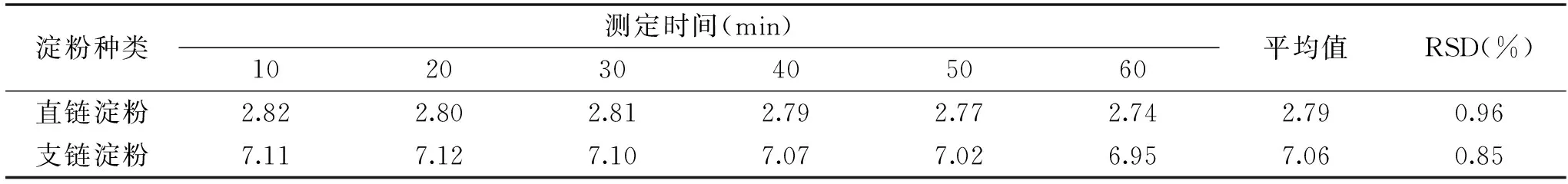
表1 稳定性试验结果Table 1 Results of stability experiment
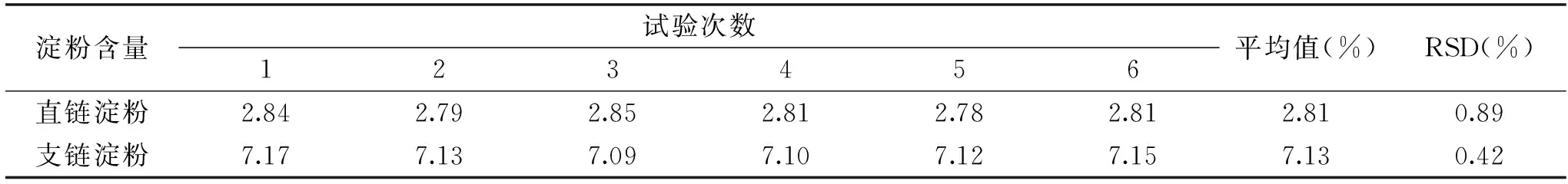
表2 精密度试验结果Table 2 Results of precision experiment
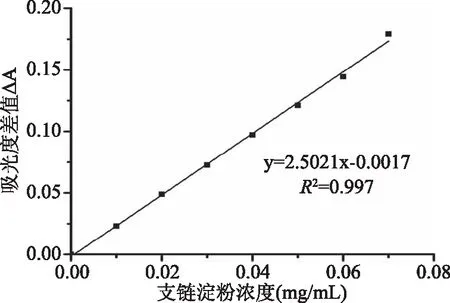
图3 支链淀粉标准曲线Fig.3 Standard curve of amylopectin
2.4 方法学验证
2.4.1 稳定性分析 稳定性试验结果如表1所示,从表1可以看出,直链淀粉和支链淀粉溶液在测定时间10~60 min范围内,测定值的相对标准偏差RSD值分别为0.96%和0.85%,二者均小于1%,并且10~30 min内测定结果基本稳定,说明试验重复性良好,该方法测定结果相对稳定。
2.4.2 精密度分析 精密度试验结果如表2所示,从表2可以看出,重复6次测定的直链淀粉和支链淀粉溶液含量平均值的相对标准偏差RSD值分别为0.89%和0.42%,二者均小于1%,因此,说明试验重复性良好,该方法测定结果精密度较高。

表3 准确性试验结果Table 3 Results of accuracy experiment
2.4.3 准确性分析 准确性试验结果如表3所示,从表3可以看出,直链淀粉和支链淀粉测定的平均回收率分别为100.22%和100.19%,测定值的相对标准偏差RSD值分别为0.82%和0.62%,二者均小于1%,因此,说明试验重复性良好,该方法测定结果准确性较高。
2.5 冰温贮藏过程中西洋参直链淀粉和支链淀粉的含量变化
冰温贮藏过程中西洋参直链淀粉和支链淀粉的含量变化如图4所示。由图4可以看出,随着贮藏月份的增加,西洋参中直链淀粉和支链淀粉的含量均呈现小幅下降的趋势,直链淀粉含量从2.84%下降到2.60%,而支链淀粉含量从7.13%下降到6.29%,这可能是因为西洋参在冰温贮藏过程中仍然进行着各种生理活动,其中就包括蒸腾作用和呼吸作用。一方面,西洋参在冰温贮藏过程中采取了保湿、保温、避光等措施,使西洋参的蒸腾作用减弱,减少了水分的损失,另一方面,西洋参在冰温环境下为了维持机体生命活动的正常进行,会通过呼吸作用消耗淀粉等能量物质而生成水,当呼吸作用大于蒸腾作用时,表观呈现出淀粉含量的减少,这与贾爱军等[13]在研究冰温自发气调贮藏对板栗淀粉含量影响时的结果相类似。
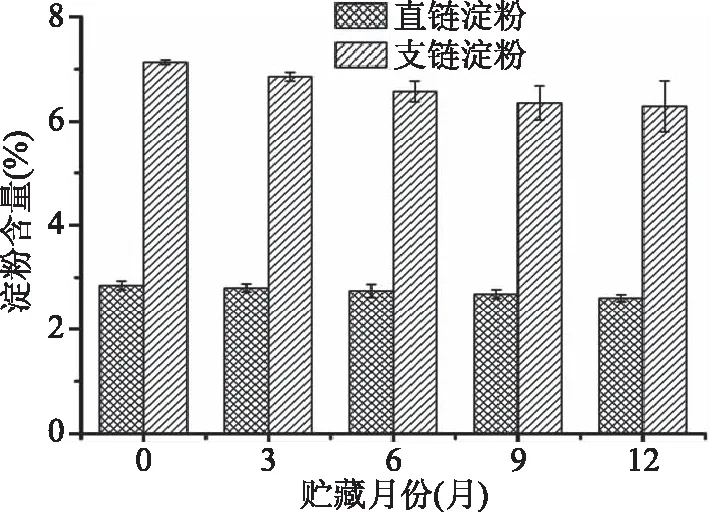
图4 冰温贮藏过程中西洋参直链淀粉和支链淀粉的含量变化Fig.4 Contents change of amylose and amylopectinin American ginseng under ice-temperature storage
3 结论
本文为了测定冰温贮藏西洋参中直链淀粉和支链淀粉的含量,采用双波长法建立了直链淀粉和支链淀粉的检测方法,通过方法学验证实验表明该法具有较高的稳定性、精密度和准确性,并且随着贮藏月份的增加,西洋参中直链淀粉和支链淀粉的含量均呈现小幅下降的趋势。因此,双波长法适用于冰温贮藏西洋参中直链淀粉和支链淀粉的含量的检测,该方法的建立可有效的评价冰温贮藏西洋参的加工品质,为进一步实现鲜西洋参的加工利用提供一定的借鉴作用。
