砷碱渣稳定化处理合成臭葱石晶体固砷
2020-04-02方紫薇郑雅杰张寿春
张 楠,方紫薇,龙 华,郑雅杰,张寿春
砷碱渣稳定化处理合成臭葱石晶体固砷
张 楠1,方紫薇1,龙 华2,郑雅杰2,张寿春1
(1. 中南大学 化学化工学院,长沙 410083;2. 中南大学 冶金与环境学院,长沙 410083)
砷碱渣中含有剧毒可溶性砷化合物,若不妥善处置,易造成水体污染和生物中毒。本研究目的是将砷碱渣中的砷转化为大颗粒晶型臭葱石以利于安全储存。在制备臭葱石晶体的反应中,考察了初始pH值、Fe/As摩尔比和反应温度对沉砷率及臭葱石形成的影响,并探究了不同条件下得到的沉淀的浸出毒性。结果表明:当初始pH值为1.0~2.0、Fe/As摩尔比为0.5~3.0及反应温度为105~175 ℃时,沉砷率可达80%以上,所得臭葱石晶体的As浸出浓度低于5 mg/L。在初始pH值为1.5、Fe/As摩尔比为1.0及反应温度为150 ℃的优化条件下,得到的臭葱石晶体呈八面体形状,颗粒尺寸可达20 μm,且As浸出浓度低至0.08 mg/L,适于稳定化处理砷并长期安全储存。
砷碱渣;砷;臭葱石;沉砷率;浸出毒性

砷碱渣是锑冶炼过程中产生的有毒危险废物,主要有害成份为砷酸钠(Na3AsO4),若贮存不当引起泄漏,暴露于环境中的砷将进入水体和食物链,轻则危害人体健康,重则导致死亡[1]。目前,工业中处理砷碱渣的方法有火法冶金与湿法冶金。在火法冶金中,常采用氧化焙烧挥发法处理砷碱渣制取三氧化二砷(As2O3),该方法易带来二次污染[2−4]。在湿法冶金中,常通过水热浸出和蒸发结晶处理砷碱渣,得到砷碱混合盐,但其成分不稳定,应用价值不高[2−4]。以上处理方法并未从根本上解决砷碱渣的安全隐患,因此亟待开发新的技术对其进行安全处置或资源化利用,以消除砷碱渣带来的环境风险。
国内外针对含砷废渣的处理开展了大量的工艺研究,其中稳定化/固化法因其操作方便及成本效益高的优点受到广泛关注[5−6]。该方法是指通过改变砷的化学状态,将其封装为具有低毒性、低溶解度及高稳定性的物质[7−9]。臭葱石晶体是一种很稳定的结晶型水合砷酸铁(FeAsO4·2H2O),在水溶液中的溶解度较无定形砷酸铁小很多,砷溶解性低且浸出毒性小,长期堆存不会造成二次污染,是理想的砷废稳定化产物[10−11]。
常用合成臭葱石的方法有水热法,改进常压法与微生物法。水热法是较早用于制备臭葱石的方法,通过水热反应从酸性砷铁溶液中析出臭葱石。该方法制备臭葱石的过程中,由于反应体系中过饱和度较低,晶核能稳态生长,有利于获得颗粒大、结晶度高的臭葱石晶体[12−13]。2008年,FUJITA等[14−15]提出用改进常压法合成臭葱石晶体,即在常压条件下,通过通入氧气控制Fe(Ⅱ)的氧化过程,在铁沉淀过程中诱导砷共沉淀生成臭葱石,但该方法在制备过程中易形成无定形砷酸铁。2010年GONZALEZ-CONTRERAS等[16]提出通过微生物氧化Fe(Ⅱ)、与As(Ⅴ)发生反应生成臭葱石。该方法前期培养微生物要求较高,不适合大范围使用。臭葱石的稳定性主要受其结晶强度和粒径大小的影响,大颗粒的臭葱石比表面积较小,浸出毒性小,稳定性高[17−18]。因此,合成大颗粒的臭葱石晶体对砷的安全稳定贮存具有重要意义。
目前,将含砷废水中的砷固化处理制备臭葱石的研究较多,但将砷碱渣这种固废中的砷进行安全处置制备臭葱石的研究报道较少。本研究采用水热法将砷碱渣中的砷转化合成臭葱石晶体,探究不同反应条件对沉砷率及臭葱石形成的影响,通过XRD、SEM、TG及XPS等方法对臭葱石进行了表征,并进一步考察了臭葱石的浸出毒性。
1 实验
1.1 实验原料
实验所用原料为锡矿山闪星锑业有限责任公司提供的二次砷碱渣。将一定质量的砷碱渣于真空干燥箱60 ℃干燥24 h后,用X射线荧光光谱(XRF,S4PIONEER)分析其元素成分,结果如表1所示。砷碱渣中元素种类较多,成分复杂,其中Na和O是含量最丰富的元素,其他元素主要与Na元素与O元素相结合形成钠盐。通过XRD进一步确认砷碱渣的物相组成,如图1所示。图1中主要可识别的物相为Na3AsO4、NaSb(OH)6、Na2CO3、NaHCO3及CaSiO3等;还有一些衍射峰不能识别,但结合砷碱渣来源企业的生产实践与相关文献进行分析,砷碱渣中还含有Na3AsO3及Na3SbO3等物质[19]。

表1 砷碱渣的组成

图1 砷碱渣的XRD谱
1.2 实验试剂
本实验所用化学试剂等级均为分析纯(AR),具体如表2所示。将砷碱渣分步处理得到的溶液作为砷源,以七水硫酸亚铁为铁源,质量分数为30%的H2O2溶液为浸出及砷固定过程中的氧化剂,用浓H2SO4(18.4 mol/L)与NaOH (1 mol/L)溶液调节pH值。
1.3 实验过程
砷碱渣的浸出:称取500 g砷碱渣置于3 L的三颈烧瓶中,以液固比4:1、浸出温度85 ℃及反应时间45 min为浸出条件,同时加入过量的H2O2溶液进行浸出。反应结束,冷却至室温,过滤得到初始pH值为13.0的砷碱混合液及含锑沉淀。将浸出液浓缩一半,通CO2脱碱,至浸出液pH为8.0反应结束。过滤,回收析出的白色固体NaHCO3。向滤液中加入浓H2SO4调节pH除去剩余的碱至pH为1.5。静置一段时间,过滤得到富砷溶液。
臭葱石的合成:量取30 mL上述富砷溶液,按照一定铁砷摩尔比配制FeSO4溶液,用适量H2O2溶液氧化Fe(Ⅱ),将铁砷溶液混合均匀,调节溶液的初始pH值,然后将该混合溶液放入水热反应釜中于指定温度下反应5 h。反应结束后,冷却至室温,过滤,析出固相用去离子水洗涤3次,于60 ℃真空干燥24 h后进行检测。
1.4 分析与检测
采用美国珀金埃尔默5300DV型电感耦合等离子体光发射光谱仪(ICP-OES)分析富砷溶液中元素的组成,结果如表3所示,溶液中砷的质量浓度为16.5 g/L。
用ICP表征滤液中As的质量浓度,并根据反应前后的实验数据按式(1)计算样品的沉砷率[20]。

表2 实验试剂
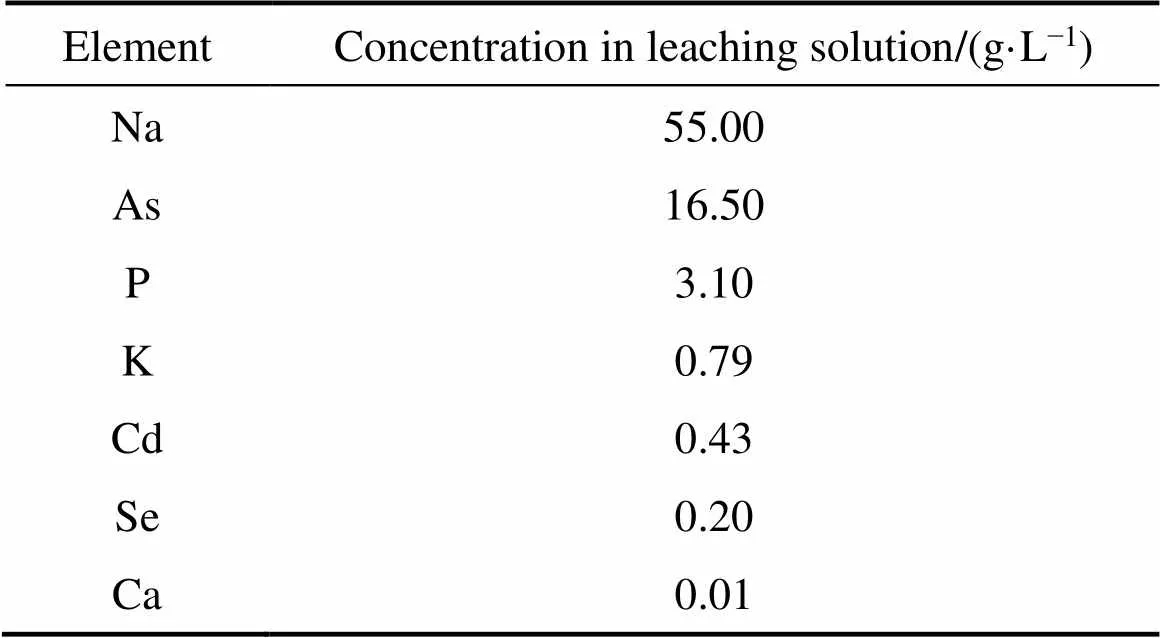
表3 富砷溶液中元素的组成
采用日本JEOL公司JSM−6360LV型扫描电镜(SEM)和日本理学Rigaku D/max-TTRIII型X射线衍射仪(XRD)分析固体的表面形貌以及物相组成;用美国珀金埃尔默Diamond型热重分析仪(TG/DTA)在氮气氛围下进行热重测试;X射线光电子能谱用ASIS Ultra DLD型XPS能谱仪在铝靶X射线源(Al K1486.7 eV)中进行测量。
1.5 浸出毒性测试
浸出毒性测试参考1992年美国环境保护局颁布的《Method 1311:Toxicity Characteristic Leaching Procedure》(TCLP)[21]:1) 用CH3COOH和NaOH(1 mol/L)溶液以及去离子水配制1000 mL pH为(4.95±0.05)的浸出液;2) 将已烘干至恒重的臭葱石样品放置于30 mL 聚乙烯瓶,按液固比20:1加入浸出液;3) 将聚乙烯瓶置于恒温振荡仪中,于(23±2) ℃以(110±10) /min的振荡频率水平振荡18 h;4) 用0.45 μm孔隙过滤膜进行液固分离;5) 用ICP-OES测定滤液中As的浓度。
2 结果与讨论
2.1 反应条件对产物的影响
2.1.1 初始pH值的影响
在Fe/As摩尔比((Fe)/(As))为1.0、温度为150 ℃的条件下,考察初始pH值对沉砷率、析出物物相组成及形貌的影响,如图2~4所示。由图2可知,随着初始pH值增大,沉砷率总体呈上升趋势,表明提高初始pH值有利于降低溶液中As的含量。在1.0~1.5的pH值范围内,沉砷率升高了19.86%;而pH值从1.5增至2.5,沉砷率由83.12%升至87.15%,仅增加4.03%。由此说明,当pH值较低时,适当升高pH值有利于提高沉砷率,但升至1.5后,pH值对沉砷率的影响不明显。
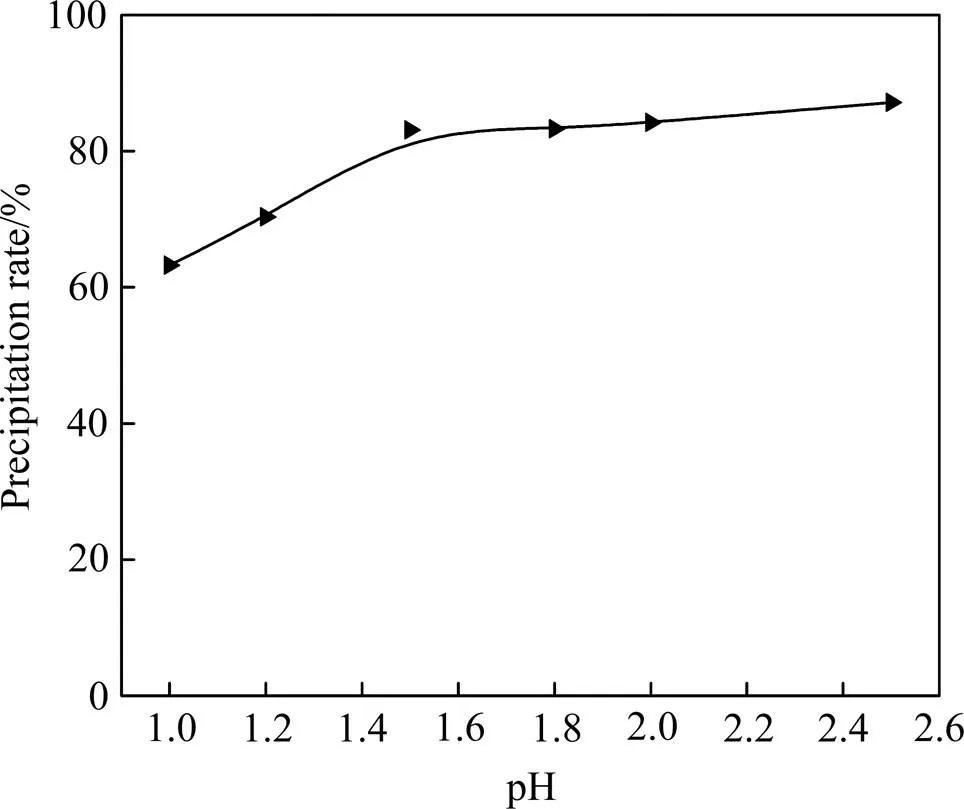
图2 初始pH值对沉砷率的影响
由图3可知,初始pH值对析出物的物相组成影响较大。pH值在1.0~2.0时,只观察到臭葱石一种物相。当pH值从1.5逐渐增大时,臭葱石衍射峰强度逐渐减弱,表明析出物的结晶度开始降低;当pH值为2.5时,析出物以无定形砷酸铁为主[22]。研究认为,臭葱石的形成是一个由无定形砷酸铁逐渐转化为臭葱石晶体的相变过程[23−24]。pH值较低时,从无定形砷酸铁转化为臭葱石的动力学过程较快;随着pH值的增加,臭葱石的形成过程逐渐变慢。在本研究中,pH 值为2.5时XRD谱没有显示出臭葱石的存在,可能是由于砷酸铁在该条件下尚未转化为臭葱石晶体。

图3 不同初始pH值条件下析出物的XRD谱
利用SEM(见图4)分析析出物形貌的演变过程。pH值在l.0~1.2时,部分颗粒已呈现出八面体形貌,但还有相当一部分颗粒未聚集长大;pH值为1.5时,样品颗粒聚集成表面光滑、粒径可达20 μm八面体臭葱石晶体;pH值继续增加,晶体结构仍为八面体,但晶体表面逐渐出现一些小团聚体;pH值升至2.0,样品形貌逐渐演化为不规则形状,结晶度变差。
以上研究表明,初始pH值在臭葱石形成过程中起着重要作用。pH值超过一定范围时,在本实验条件下,反应未能形成臭葱石晶体,因此在反应过程中应严格控制初始pH值。相关文献报道,结晶度高、粒径较大的臭葱石稳定性较高[17−18]。综合考虑初始pH值对沉砷率、结晶度及形貌等因素的影响,在此选取pH=1.5较为适宜。
2.1.2 Fe/As摩尔比的影响
保持pH值为1.5,温度为150 ℃,探究Fe/As摩尔比对析出物形成的影响,结果如图5~7所示。由图5可知,当Fe/As摩尔比较小时,由于溶液中Fe3+含量较少,导致沉砷不完全,因此沉砷率较低。Fe/As摩尔比由0.5增至1.0,沉砷率增至83.12%。XRD谱(见图6)和SEM像(见图7)显示,此时析出物为结晶度高,具有八面体形貌的臭葱石晶体。继续增大初始铁含量至Fe/As摩尔比为3.0,沉砷率变化不明显,臭葱石结晶度逐渐减弱并出现团聚,形貌也逐渐由八面体变为不规则形状。当Fe/As摩尔比为4.0时,沉砷率增至89.25%,此时析出物的结晶程度降低,以无定形态为主,溶液中的砷酸盐可能被吸附覆盖在无定形物质的表面,从而一定程度上提高了沉砷率,却阻碍了晶体的聚集与生长[23, 26]。综合以上分析,Fe/As摩尔比选1.0较为适宜。

图4 不同初始pH条件下析出物的SEM像
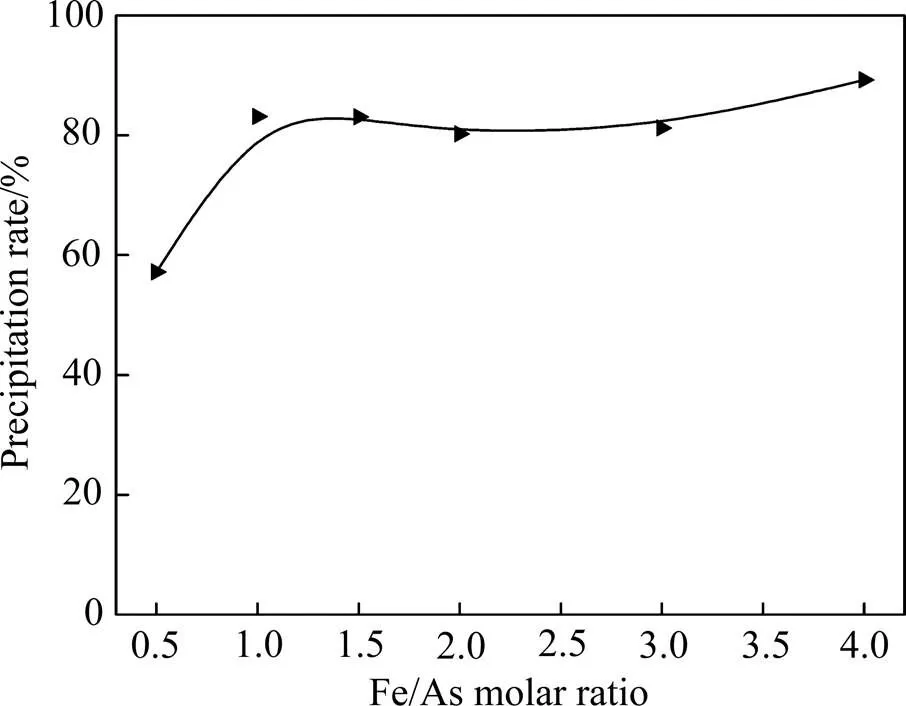
图5 Fe/As摩尔比对沉砷率的影响
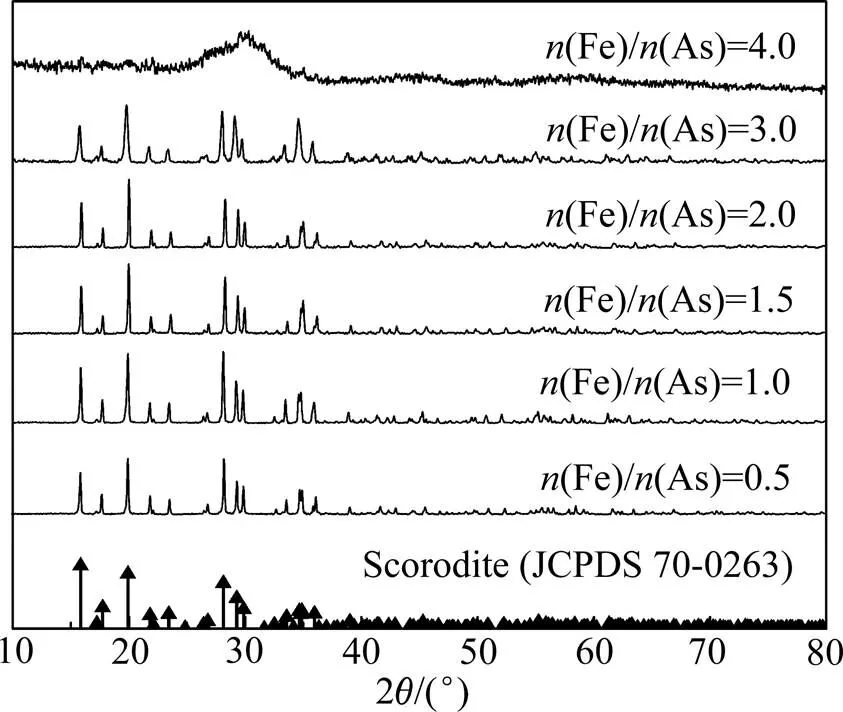
图6 不同Fe/As摩尔比下析出物的XRD谱

图7 不同Fe/As摩尔比下析出物的SEM像
2.1.3反应温度的影响
在初始pH值为1.5,Fe/As摩尔比为1.0的基础上,探究温度对析出物的影响如图8~10所示。由图8 可知,当温度由105 ℃升高至150 ℃,沉砷率逐渐增大;继续升温至175 ℃,沉砷率则基本不变。同时,从XRD谱(见图9)和SEM像(见图10)中也可以看出,一定程度升高温度有利于形成结晶度高、形貌较好的八面体臭葱石晶体,这可能是由于在相对较高温度时臭葱石具有较高的热力学稳定性且较易于成核结晶[25]。当温度升高到175 ℃时,臭葱石产品的形貌变得不够规则,同时颗粒粒径减小。综合以上分析,反应温度选150 ℃较为适宜。

图8 反应温度对沉砷率的影响
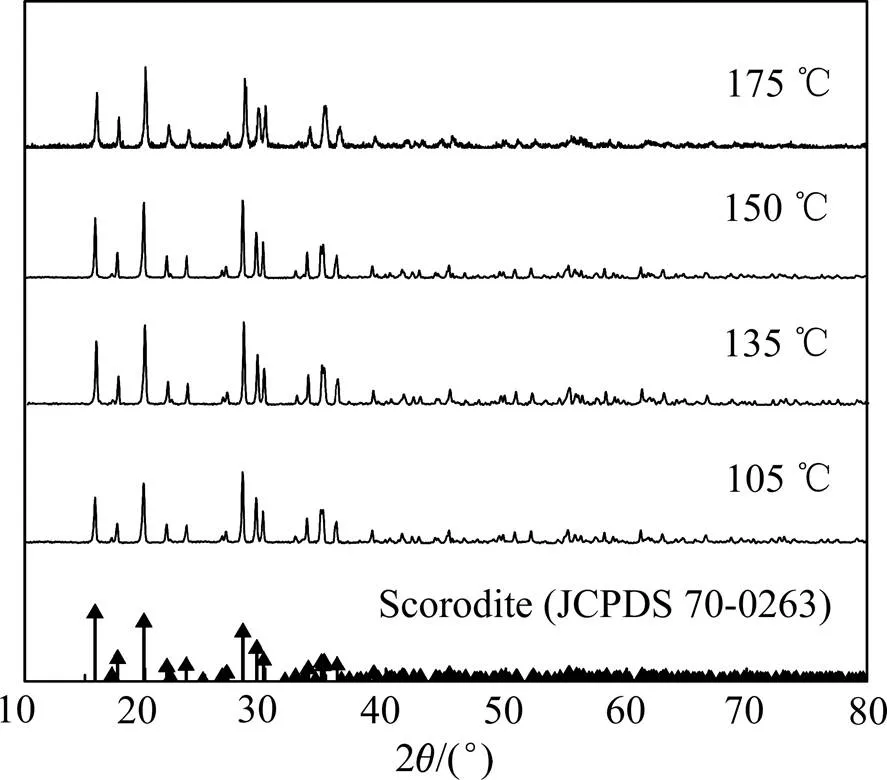
图9 不同反应温度下析出物的XRD谱
2.2 TG分析
对优化条件下所得的臭葱石进行TG分析(见图11),可得到更多关于结晶程度及失水率的信息。在DTA曲线中观察到,210.34 ℃处有明显的吸热谷,而537.57 ℃处有较小的放热峰。210.34 ℃出现吸热谷主要是由于FeAsO4·2H2O分解失去结晶水。TG曲线中存在一个拐点,且在较窄的温度范围内完成了减重,说明该析出物具有很好的结晶度[22]。DTG曲线上的峰顶点表明失重速率的最大值为687.83 μg/min。由TG曲线可知,臭葱石的失水率为17.4%,这一数值高于理论的15.6%。该研究结果与BERRE等[26]的所测结果类似,可能是由于在样品测试期间,样品的结构不是完整的晶体化,即此时样品不是完全结晶的臭葱石所致。
2.3 XPS分析
用XPS光谱仪对样品表面进行元素鉴定,臭葱石的XPS全谱图如图12(a)所示,检测到的主要元素有C、O、As和Fe。利用XPS PEAK41软件对As、Fe、O元素的XPS光谱数据进行分峰拟合,分析各元素在样品中的价态。As 3d谱图(见图12(b))中,可观察到As 3d的结合能为45.515 eV,表明样品中的砷主要以As(Ⅴ)的形式存在[27]。Fe 2p1/2和Fe 2p3/2的峰值位置通常用来定性地分析铁元素的价态[28]。Fe 2p谱图(见图12(c))中,在711.525 eV和725.085 eV处分别出现了Fe 2p3/2和Fe 2p1/2的结合能信号,且其结合能之差为13.56 eV,表明有Fe(Ⅲ)的存在[28]。O 1s谱图中(见图12(d))显示有两个峰,表明臭葱石晶体表面存在两种不同的氧。在530.933 eV处存在的峰可能与臭葱石结构中的AsO43-基团有关;在532.292 eV处存在的峰可能与H2O基团有关[29]。
2.4 浸出毒性分析
浸出毒性实验可表征含砷物质的稳定性,若As浸出浓度低于中国危险废物鉴别标准规定的砷浸出浓度限值(5 mg/L),则表示该含砷物质可安全储存[30]。不同初始pH值条件下所得臭葱石产物的砷浸出浓度如表4所示。pH值在1.0~2.0范围内,产物均为结晶性较好的臭葱石晶体,其砷浸出浓度均低于5 mg/L,可安全储存。其中pH值为1.5时,形成的臭葱石晶体结构致密且粒径可达20 μm,砷浸出浓度最低(0.08 mg/L)。由表5可知,Fe/As摩尔比在0.5~3.0范围内,砷浸出浓度均低于5 mg/L。由表6可见,温度从105 ℃升至150 ℃,砷浸出浓度由3.65 mg/L降至0.08 mg/L,表明一定程度升高温度可促进臭葱石晶体生长,进而降低臭葱石的浸出毒性。但温度升高至175 ℃时,砷浸出浓度又开始增大。

图10 不同反应温度下析出物的SEM像
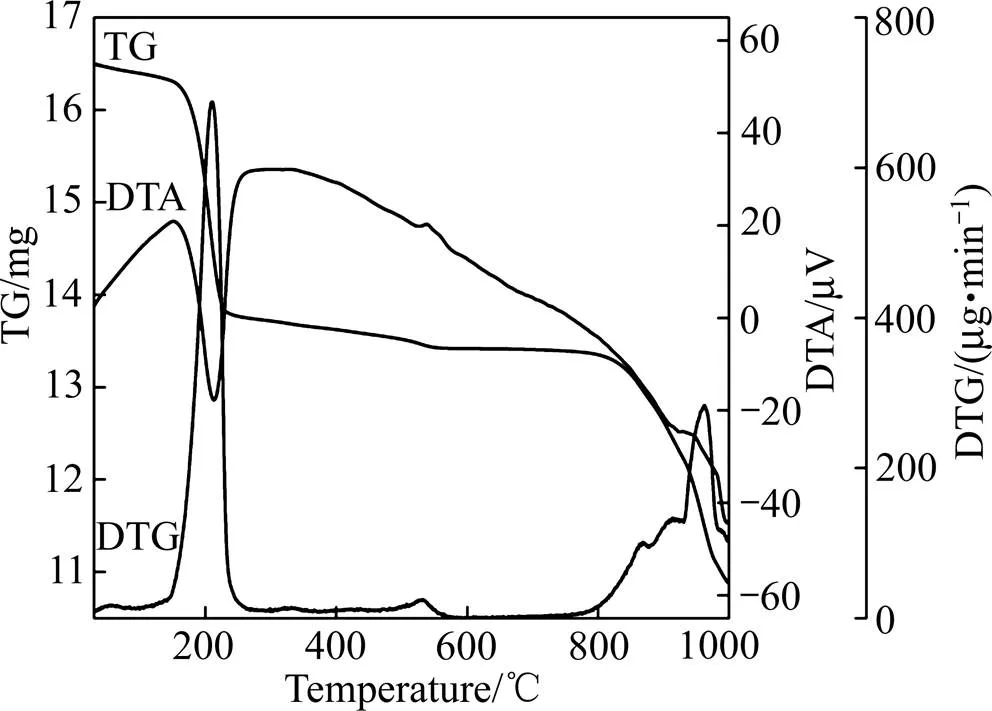
图11 优化条件下合成的臭葱石的TG−DTA−DTG曲线

图12 优化条件下合成的臭葱石的XPS光谱图
以上结果表明,溶液的初始pH值、Fe/As摩尔比及反应温度对臭葱石产物的浸出毒性有显著影响,且颗粒粒径越大,浸出毒性越小。当pH值为1.5、Fe/As摩尔比为1.0及温度为150 ℃时,所得臭葱石的浸出毒性低至0.08 mg/L,说明臭葱石的浸出毒性与产品的结晶度形貌及颗粒大小密切相关,具有八面体构型的大颗粒臭葱石晶体稳定性高,能满足安全储存的要求。
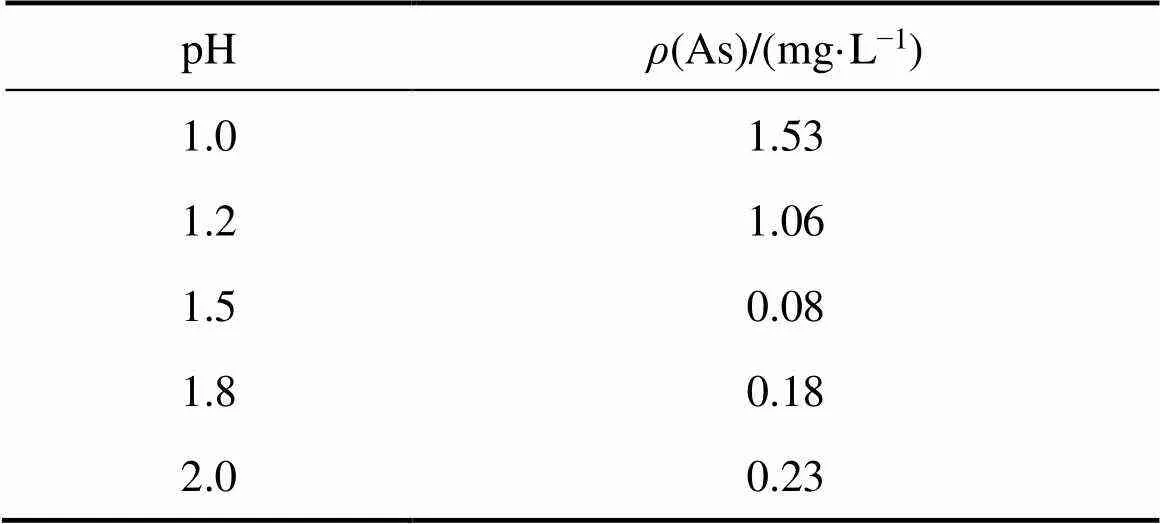
表4 不同初始pH值条件下所得臭葱石的浸出毒性
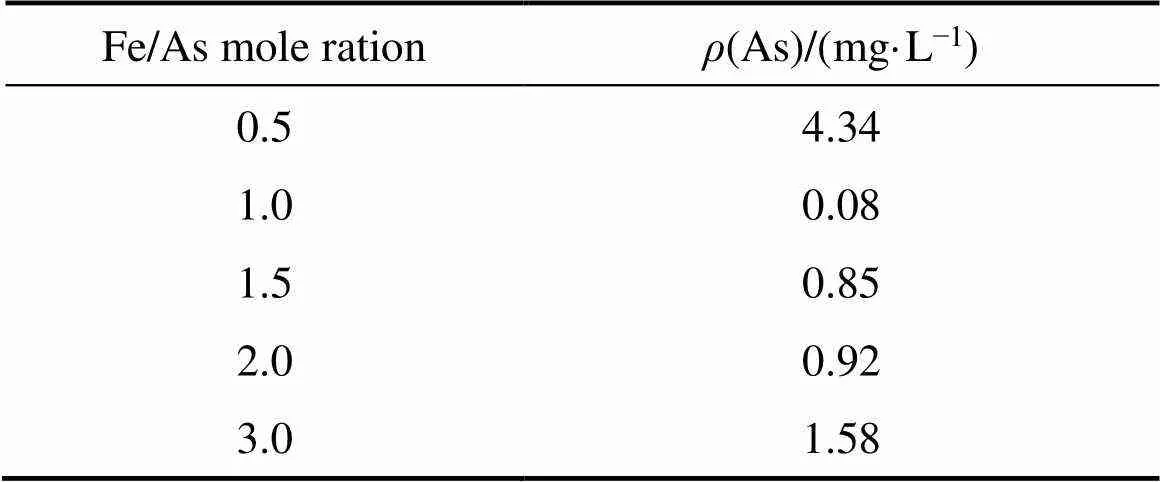
表5 不同Fe/As摩尔比条件下所得臭葱石的浸出毒性
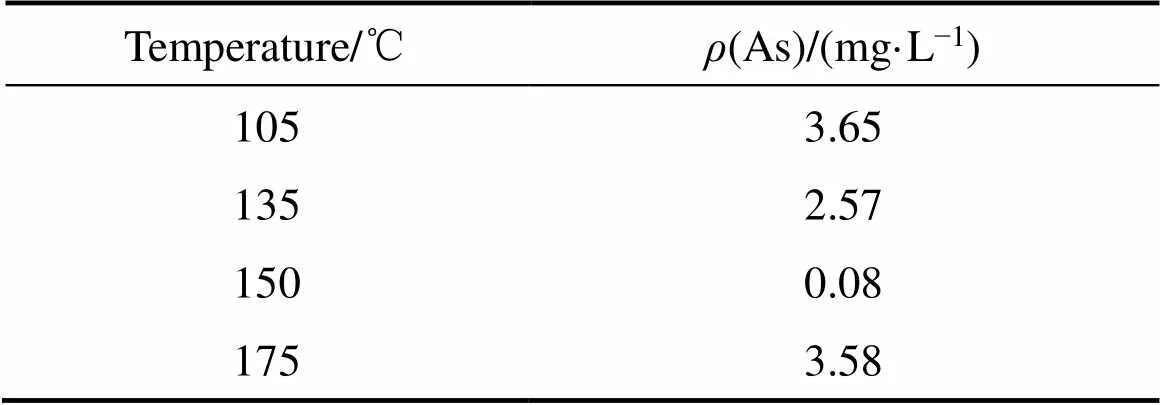
表6 不同反应温度条件下所得臭葱石的浸出毒性
3 结论
1) 本研究成功将砷碱渣中的砷以臭葱石的形式固定,并考察了各实验参数对析出物的影响。经分析可知,初始pH值、Fe/As摩尔比及温度对析出物的形成有显著影响。初始pH值较低时能较快形成臭葱石;随着pH值的增加,反应的动力学进程逐渐减慢。适量增加初始含铁量有利于形成结晶度较高的臭葱石;添加过量的铁盐则会抑制晶体的长大。在一定范围内提高反应温度可加快反应进程及促进晶体的生长。
2) 在pH值为1.5、Fe/As摩尔比为1.0及温度为150 ℃的优化条件下,沉砷率达到83.12%,析出的臭葱石晶体形貌表现为明显的八面体形状,颗粒粒径可达20 μm,As浸出浓度为0.08 mg/L,低于浸出毒性限值(5 mg/L),可安全储存。
[1] 万文玉, 陈 伟, 黄顺红, 孙建德, 李 倩. 砷碱渣浸出液氧化脱锑试验[J]. 有色金属(冶炼部分), 2015(8): 6−9. WAN Wen-yu, CHEN Wei, HUANG Shun-hong, SUN Jian-de, LI Qian. Antimony oxidation removal from arsenic alkali residue leaching solution[J]. Nonferrous Metals (Extractive Metallurgy), 2015(8): 6−9.
[2] 韦岩松, 杨宗朝. 从砷碱渣中浸出砷的试验研究[J]. 湿法冶金, 2014, 33(5): 371−374. WEI Yan-song, YANG Zong-chao. Leaching of arsenic from arsenic-alkali residue[J]. Hydrometallurgy, 2014, 33(5): 371−374.
[3] 陈白珍, 王中溪, 周竹生, 胡干武, 仇勇还. 二次砷碱渣清洁化生产技术工业试验[J]. 矿冶工程, 2007, 27(2): 47−49. CHEN Bai-zhen, WANG Zhong-xi, ZHOU Zhu-sheng, HU Gan-wu, QIU Yong-hai. Commercial test of cleanly production technology of second arsenic-alkali residue[J]. Mining and Metallurgical Engineering, 2007, 27(2): 47−49.
[4] 邓卫华, 柴立元, 戴永俊. 锑冶炼砷碱渣有价资源综合回收工业试验研究[J]. 湖南有色金属, 2014, 30(3): 24−27. DENG Wei-hua, CHAI Li-yuan, DAI Yong-jun. Industrial experimental study on comprehensive recovering valuable resources from antimony smelting arsenic alkali residue[J]. Hunan Nonferrous Metals, 2014, 30(3): 24−27.
[5] KITAMURA Y, OKAWA H, KATO T, SUGAWARA K. Effect of ultrasound intensity on the size and morphology of synthesized scorodite particles[J]. Advanced Powder Technology, 2016, 27(3): 891−897.
[6] 徐 慧, 闵小波, 梁彦杰, 王云燕. 机械力活化Fe-MnO2稳定含砷废渣[J]. 中国有色金属学报, 2017, 27(10): 2170−2179. XU Hui, MIN Xiao-bo, LIANG Yan-jie, WANG Yun-yan. Stabilization of arsenic bearing solid waste with Fe-MnO2activated by mechanochemical process[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(10): 2170−2179.
[7] MIN Xiao-bo, LIAO Ying-ping, CHAI Li-yuan, YANG Zhi-hui, XIONG Shan, LIU Lin, LI Qing-zhu. Removal and stabilization of arsenic from anode slime by forming crystal scorodite[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(4): 1298−1306.
[8] KOSSOFF D, WELCH M D, HUDSON-EDWARDS K A. Scorodite precipitation in the presence of antimony[J]. Chemical Geology, 2015, 406(1): 1−9.
[9] 张明琴, 周新涛, 罗中秋, 郝旭涛, 何 欢, 史桂杰. 石灰−铁盐法处理工业含砷废水研究进展[J]. 硅酸盐通报, 2016, 35(8): 2447−2453. ZHANG Ming-qin, ZHOU Xin-tao, LUO Zhong-qiu, HAO Xu-tao, HE Huan, SHI Gui-jie. Treatment of arsenic-bearing industrial wastewater by lime-ferric salt method[J]. Bulletin of the Chinese Ceramic Society, 2016, 35(8): 2447−2453.
[10] YANG Jin-qin, LI Qing-zhu, CHAI Li-yuan, WANG Qing-wei, LIU Hui, MIN Xiao-bo, XIAO Rui-yang. A new mixed-valent iron arsenate black crystal[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(5): 1036−1044.
[11] NAZARI A M, RADZINSKI R, GHAHREMAN A. Review of arsenic metallurgy: Treatment of arsenical minerals and the immobilization of arsenic[J]. Hydrometallurgy, 2016, 174: 258−281.
[12] SWASH P M, MONHEMIUS A J. Hydrothermal precipitation from aqueous solutions containing iron(Ⅲ), arsenate and sulphate[C]//Hydrometallurgy ’94. Springer Netherlands, 1994: 177−190.
[13] MAMBOTE R C M, KRIJGSMAN P, REUTER M A. Hydrothermal precipitation of arsenic compounds in the ferric- arsenic(Ⅲ)-sulfate system: Thermodynamic modeling[J]. Minerals Engineering, 2003, 16(5): 429−440.
[14] FUJITA T, TAGUCHI R, ABUMIYA M, MATSUMOTO M, SHIBATA E, NAKAMURA T. Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution. Part Ⅰ[J]. Hydrometallurgy, 2008, 90(2/4): 92−102.
[15] FUJITA T, TAGUCHI R, ABUMIYA M, MATSUMOTO M, SHIBATA E, NAKAMURA T. Effects of zinc, copper and sodium ions on ferric arsenate precipitation in a novel atmospheric scorodite process[J]. Hydrometallurgy, 2008, 93(1): 30−38.
[16] GONZALEZ-CONTRERAS P, WEIJMA J, WEIJDEN R V D, BUISMAN C J N. Biogenic scorodite crystallization by acidianus sulfidivorans for arsenic removal[J]. Environmental Science & Technology, 2010, 44(2): 675−680.
[17] FUJIEDA S, SHINODA K, INANAGA T, ABUMIYA M, SUZUKI S. Dissolution characteristics and morphology of large-sized scorodite particles synthesized from Fe(Ⅱ) and As(Ⅴ) in aqueous solution[J]. High Temperature Materials & Processes, 2012, 31(4/5): 451−458.
[18] KITAMURA Y, OKAWA H, SUGAWARA K. Synthesis of large scorodite particles using short period time sonication to enhance agglomeration of precursor[J]. Japanese Journal of Applied Physics, 2015, 54(7): 7−12.
[19] 邓卫华. 锑冶炼砷碱渣有价资源综合回收研究[D]. 长沙: 中南大学, 2014. DENG Wei-hua. Study on comprehensive recovery of valuable resources in arsenic alkali residue from antimony smelting[D]. Changsha: Central South University, 2014.
[20] 余自秀, 李存兄, 魏 昶, 樊 刚, 李兴彬, 邓志敢, 李旻廷. 砷铁水热共沉淀制备大颗粒臭葱石[J]. 过程工程学报, 2018, 18(1): 126−132. YU Zi-xiu, LI Cun-xiong, WEI Chang, FAN Gang, LI Xing-bin, DENG Zhi-gan, LI Min-ting. Preparation of large-sized scorodite based on arsenic and iron hydrothermal co-precipitation[J]. The Chinese Journal of Process Engineering, 2018, 18(1): 126−132.
[21] Environment Protection Agency of US. Information and documentation-rules for bibliographic references and citations to information resources:1311[S]. Washington, DC, 1992.
[22] CHEN Yong-ming, LIU Nan-nan, YE Long-gang, XIONG Shan, YANG Sheng-hai. A cleaning process for the removal and stabilisation of arsenic from arsenic-rich lead anode slime[J]. Journal of Cleaner Production, 2018, 176: 26−35.
[23] PAKTUNC D, BRUGGEMMAN K. Solubility of nanocrystalline scorodite and amorphous ferric arsenate: implications for stabilization of arsenic in mine wastes[J]. Applied Geochemistry, 2010, 25(5): 674−683.
[24] OTGON N, ZHANG G J, ZHANG K L, YANG C. Removal and fixation of arsenic by forming a complex precipitate containing scorodite and ferrihydrite[J]. Hydrometallurgy, 2019, 186: 58−65.
[25] SHINGHANIA S, WANG Q K, FILIPPOU D, QIANKUN WANG, DEMOPOULOS G P. Temperature and seeding effects on the precipitation of scorodite from sulfate solutions under atmospheric-pressure conditions[J]. Metallurgical & Materials Transactions B, 2005, 36(3): 327−333.
[26] BERRE J F L, GAUVIN R, DEMOPOULOS G P. A study of the crystallization kinetics of scorodite via the transformation of poorly crystalline ferric arsenate in weakly acidic solution[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2008, 315(1): 117−129.
[27] FRAU F, ADDARI D, ATZEI D, BIDDAU R, CIDU R, ROSSI A. Influence of major anions on As(V) adsorption by synthetic 2-line ferrihydrite. kinetic investigation and XPS study of the competitive effect of bicarbonate[J]. Water Air & Soil Pollution, 2010, 205(1/4): 25−41.
[28] 沈跃跃, 刘祎玮, 李 颖, 马崇迪, 李 越, 刘文韬, 廖 洋, 毛 卉. 固化杨梅单宁对水体环境中铁离子的吸附特性研究[J]. 四川师范大学学报(自然科学版), 2016, 39(5): 705−710. SHEN Yue-yue, LIU Yi-wei, LI Ying, MA Chong-di, LI Yue, LIU Wen-tao, LIAO Yang, MAO Hui. Adsorption property of iron ion in aqueous solution by immobilized bayberry tannins[J]. Journal of Sichuan Normal University (Science and Technology), 2016, 39(5): 705−710.
[29] KLOPROGGE J T, WOOD B J. X-ray photoelectron spectroscopic and raman microscopic investigation of the variscite group minerals: Variscite, strengite, scorodite and mansfieldite[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2017, 185: 163−172.
[30] 中华人民共和国国家环境保护总局, 国家质量监督检验检疫总局. 危险废物鉴别标准浸出毒性鉴别: GB 5085.3−2007 [S]. 北京: 中国标准出版社, 2007. State Environmental Protection Administration and General Administration of Quality Supervision of the People’s Republic of China, Standardization Administration of the People’s Republic of China. Identification standards for hazardous wastes−identification for extraction toxicity: GB 5080.3−2007[S]. Beijing: Standards Press of China, 2007.
Stabilization of arsenic from arsenic alkali residue by forming crystalline scorodite
ZHANG Nan1, FANG Zi-wei1, LONG hua2, ZHENG Ya-jie2, ZHANG Shou-chun1
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China; 2. School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Arsenic alkali residue contains highly toxic soluble arsenic compounds, if not properly disposed, easy to cause water pollution and biological poisoning. The purpose of this study was to convert arsenic from arsenic alkali residue into large-sized crystalline scorodite for safe storage. The effects of initial pH, Fe/As molar ratio and reaction temperature on the As precipitation rate and formation of scorodite, as well as on the leaching toxicity of the precipitates were investigated. The results show that, under the conditions of initial pH of 1.0−2.0, Fe/As molar ratio of 0.5−3.0 and reaction temperature of 105−175 ℃, the As precipitation rate can reach more than 80%, and the As leaching concentration of the obtained scorodite is less than 5 mg/L. Well crystallized octahedral scorodite with particles size up to 20 μm can be obtained under the optimal conditions of initial pH of 1.5, Fe/As molar ratio of 1.0 and 150 ℃, and the As leaching concentration is as low as 0.08 mg/L, suggesting the crystalline scorodite has sufficient stability and is suitable for arsenic stabilization and long-term storage.
arsenic alkali residue; arsenic; scorodite; As precipitation rate; leaching toxicity
Project(2017SK2254) supported by the Hunan Province Key Research and Development Project of China
2018-12-26;
2019-05-20
ZHANG Shou-chun; Tel: +86-15274801744; E-mail: zhang_shch@sina.cn
1004-0609(2020)-01-0203-11
TF09
A
10.11817/j.ysxb.1004.0609.2020-35720
湖南省重点研发计划项目(2017SK2254)
2018-12-26;
2019-05-20
张寿春,副教授,博士;电话:15274801744;E-mail:zhang_shch@sina.cn
(编辑 何学锋)
