卡托普利肾动态显像诊断肾血管性高血压及血浆肾素的影响
2020-04-02阮谢妹段莉莉武新宇徐俊玲高永举
阮谢妹,段莉莉,武新宇,王 鹏,徐俊玲,高永举
(郑州大学人民医院 河南省人民医院核医学科,河南 郑州 450003)
肾血管性高血压(renovascular hypertension, RVH) 约占继发性高血压的5%,发病机制为肾动脉狭窄肾血流减低,激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS),血浆肾素活性(plasma renin activity, PRA)增高,血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)升高,小动脉收缩而致高血压[1]。血管紧张素使醛固酮(aldosterone, ALD)分泌增多,引起水钠潴留血容量增加,加重高血压。增多的AngⅡ使出球小动脉收缩,滤过压升高,以维持肾小球滤过率(glomerular filtration rate, GFR),导致基础肾动态显像诊断RVH的灵敏度降低。在基础显像后应用卡托普利,可阻断血管紧张素Ⅰ向 AngⅡ转换,降低AngⅡ的代偿作用,故卡托普利肾动态显像(Captopril renal scintigraphy, CRS)可提高RVH检出率。本研究分析RVH患者激素水平与CRS诊断RVH效能的关系,探讨血浆PRA对CRS的影响。
1 资料与方法
1.1 一般资料 收集2018年2月—2019年3月35例郑州大学人民医院临床诊断RVH患者,男16例,女19例,年龄13~87岁,平均(48.7±17.9)岁;平均血压(185.76±23.14)/(108.10±23.85)mmHg;均先接受卧、立位外周血浆PRA、AngⅡ、ALD 检测,随后依次接受非对比增强MRA(non-contrast enhanced MRA, NCE-MRA)、基础及CRS,其中19例接受数字减影血管造影(digital subtraction angiography, DSA)。
入组标准[2-3]为符合以下至少2项,且DSA或NCE-MRA肾动脉狭窄≥70%:①突发或恶化的高血压,年龄≤30岁或≥55岁;②腹部闻及血管杂音;③服用3种或以上抗高血压药;④应用血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)/血管紧张素受体阻滞药(angiotensin receptor blockers, ARB)类药物后,血肌酐升高≥30%;⑤伴动脉粥样硬化病变;⑥反复发作的肺水肿。排除标准:原发性高血压及其他原因引起的继发性高血压,如嗜铬细胞瘤、原发性醛固酮增多症等;水化不足,检查过程中血压变化大及长期服用钙离子拮抗剂(如络活喜、硝苯地平)等。
介入治疗后,与基础比较,符合下列1项为CRS阳性:①GFR下降≥10%;②峰时延迟≥2 min;③20 min皮质滞留增加≥10%;④肾功能无明显变化,但一侧基础显像异常(两侧肾脏相对摄取比<30%,高峰时间≤2 min,肾影缩小)[4-5]。由2位以上高年资核医学医师分别读片,经讨论达成共识。
1.2 血浆PRA、AngⅡ及ALD检测 采血前停用β受体阻断剂、利尿剂等影响体内RAAS药物至少2周。分别于立、卧位经肘静脉采血2~5 ml(立位为持续站立活动≥2 h;卧位为平躺过夜无起身或静卧≥2 h)[6],以化学发光免疫分析法进行检测。
1.3 仪器与方法 检查前停用ACEI/ARB类药物至少48 h,显像前1 h饮水500 ml水化,上机前排空膀胱。采用GE Discovery NM/CT 670型SPECT/CT仪,行仰卧后位显像,视野包括双肾及膀胱。显像剂为99Tcm-二乙三胺五醋酸(DTPA),剂量3.70 MBq/kg体质量,检测满针注射器放射性计数后,经肘静脉“弹丸式”注射并启动采集。以每帧2 s采集30帧肾血流灌注相图像,每帧1 min采集20帧动态功能相图像。采集结束后检测空针注射器放射性。应用ROI技术勾画双肾轮廓及本底,生成肾图曲线及GFR等参数。次日予患者口服卡托普利50 mg 1 h后行肾动态显像,方法同前,期间监测血压及心率,血压变化较大时及时处理。
1.4 统计学分析 采用SPSS 21.0及Medcalc统计分析软件。连续非正态定量资料用中位数(上下四分位数)表示。应用Mann-WhitneyU秩和检验比较组间血浆激素水平。行ROC曲线分析,得出立位血浆PRA最低阈值,即CRS诊断RVH效能最高的界值。P<0.05为差异有统计学意义。
2 结果
阳性组24例,阴性组11例,CRS诊断RVH的灵敏度68.57%(24/35)。
2.1 组间PRA、AngⅡ及ALD比较 阳性组立位PRA明显高于阴性组(Z=3.11,P<0.001);卧位PRA差异无统计学意义(Z=1.92,P=0.07)。2组立、卧位AngⅡ和ALD差异均无统计学意义(表1)。
2.2 诊断效能 以立位PRA绘制ROC曲线(图1),CRS阳性即约登指数最大时(0.65)AUC为0.84,临界值为2.47 ng/(ml·h),CRS诊断RVH的灵敏度为83.33%,特异度为81.82%(图2)。
3 讨论
RVH有治愈可能,早期诊断肾动脉狭窄及肾功能状态,可在一定程度上逆转和阻止疾病进展,对改善预后极为重要。DSA是诊断肾动脉狭窄的金标准,但为有创性检查,存在对比剂肾病风险[7],且与超声、CTA、MRA类似,均仅能从形态学上显示狭窄的解剖结构。CRS无创、可重复,且无肾脏损害,可通过功能显像反映肾动脉狭窄是否引起血流动力学改变,同时评价肾功能和分肾功能等[8],更能评估RVH患者能否自再血管化治疗中获益[1],但诸多影响因素导致其诊断效能降低。本研究中CRS诊断RVH的灵敏度仅为68.57%,与既往文献[4]报道的71%~92%接近,低于CTA和MRA[7]。
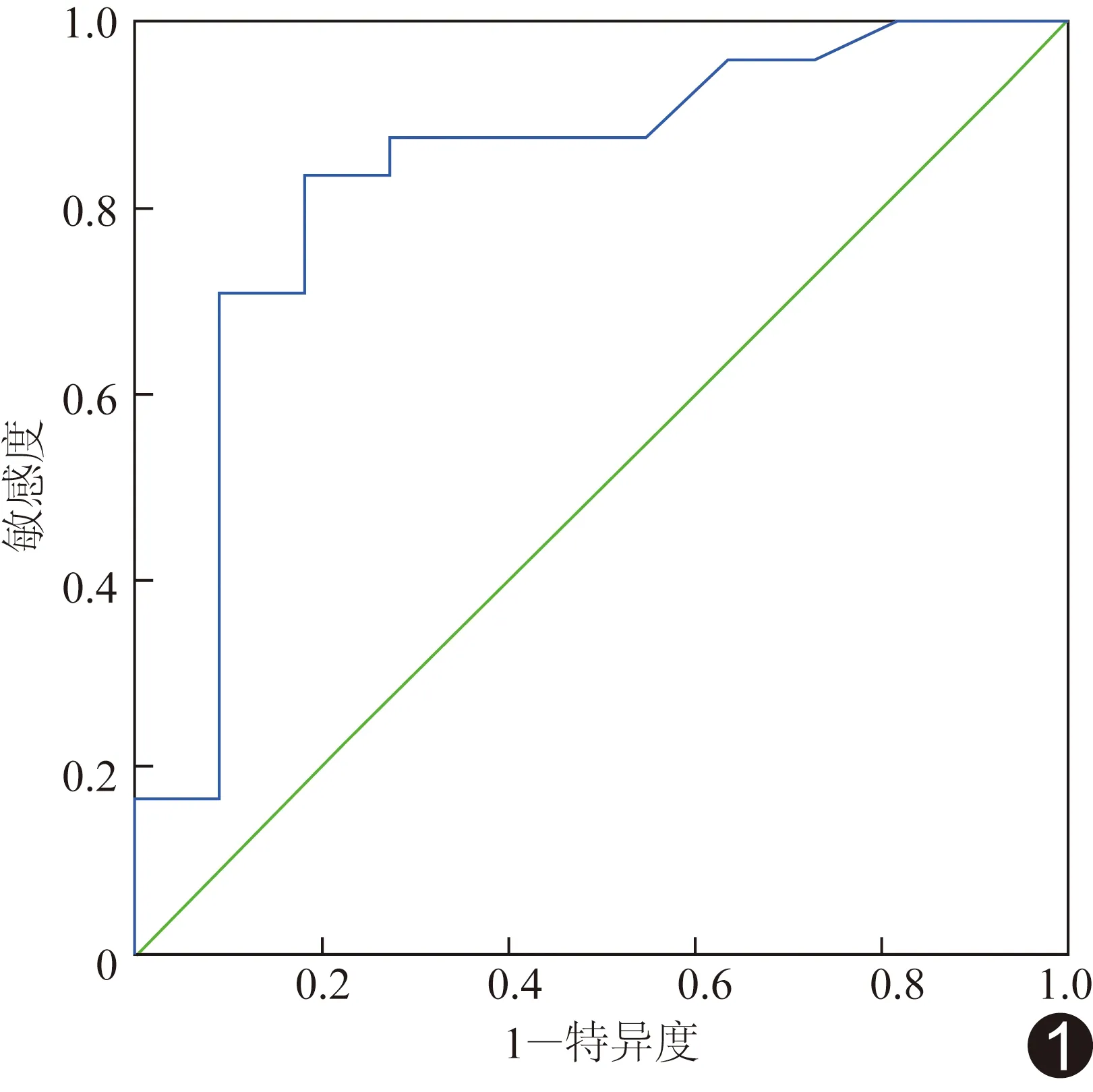
图1 血浆立位PRA预测RVH患者CRS阳性的ROC曲线
CRS为功能性检查,受诸多因素影响,研究[9]显示通过体外补充刺激血浆PRA可提高CRS诊断的准确率,提示血浆PRA、AngⅡ和ALD水平可能影响CRS。人体回心血量与体位相关,立位时回心血量减少,激发RAAS系统,使血浆PRA、AngⅡ及ALD较卧位时升高[6]。本研究显示所有患者立位PRA、AngⅡ及ALD水平均较卧位有不同程度升高,原因可能为立位时回心血量减少,肾灌注进一步减低,加重患侧肾缺血症状,进一步激活RAAS系统,使激素水平升高。分别对比分析CRS阳性组和阴性组立、卧位PRA、AngⅡ及ALD水平,发现CRS阳性组立位PRA升高程度明显高于阴性组,而阳性组卧位PRA及立、卧位AngⅡ和ALD与阴性组差异无统计学意义,可能与选取样本抑或AngⅡ和ALD较集中于患侧肾血管局部有关[10],也在一定程度上提示血浆肾素升高可作为辅助诊断RVH的指标,与张奇等[11]的研究结果相佐证;据此推测,立位PRA水平高的RVH患者CRS阳性的可能性更大。本研究中立位PRA的AUC为0.84,提示立位PRA与CRS关系显著,且立位PRA>2.47 ng/(ml·h)时,CRS诊断RVH阳性的灵敏度为83.33%,特异度为81.82%,表明立位PRA是影响CRS诊断RVH敏感性的指标,分析CRS时需考虑PRA的影响。DAIDOJI等研究[12]表明,PRA亦可作为评估血流重建术后RVH患者预后的指标。
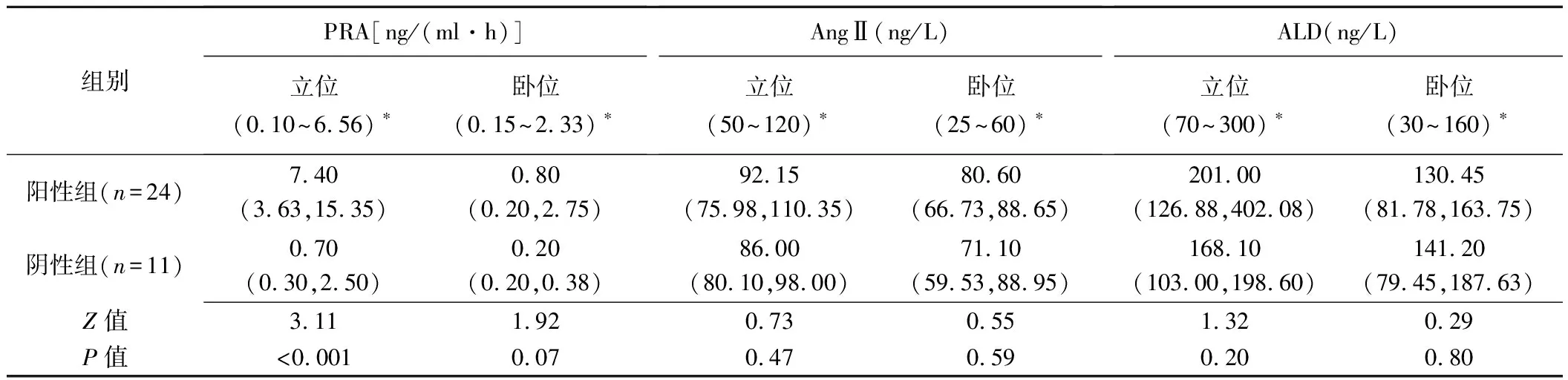
表1 2组PRA、AngⅡ及ALD水平比较[M(P25,P75),n=35]
注:*:括号内为参考值范围
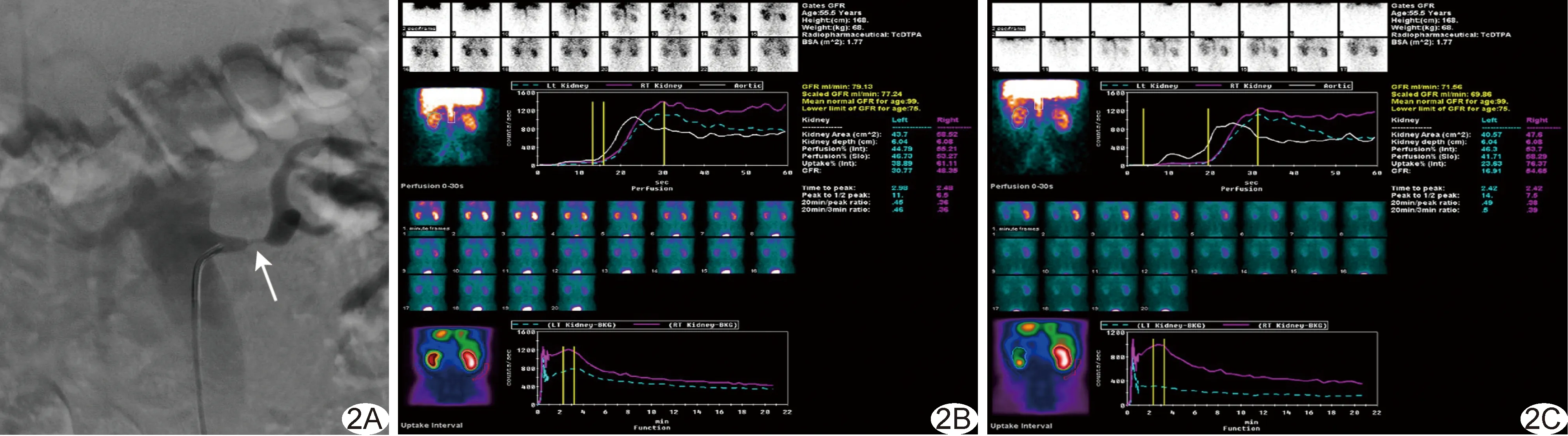
图2 患者女,55岁,肾血管性高血压1月余,最高血压210/115 mmHg,立、卧位PRA分别为10.00 ng/(ml·h)和18.40 ng/(ml·h) A.DSA示左肾动脉狭窄约90%(箭示狭窄); B.基础肾动态显像左肾GFR=30.77 ml/min,右肾GFR=48.35 ml/min; C.卡托普利介入后左肾GFR=16.91 ml/min,较基础降低45.10%,半排时间延长约27%,考虑RVH可能,右肾GFR=54.65 ml/min
熟悉影响CRS诊断敏感性的因素,综合分析结果能提高诊断效能。研究[13]显示PRA处于正常低值水平时,会降低对卡托普利的敏感性,且部分RVH患者不受肾素介导。本研究纳入的35例RVH患者中,CRS阳性24例,阴性11例,导致CRS假阴性可能与低肾素水平及不受肾素介导有关,但本研究未检测肾静脉血PRA,无法排除是否存在非肾素介导的RVH,为局限性所在。本研究1例立位PRA异常[立位PRA为18.80 ng/(ml·h)],但CRS结果为阴性,MRA示狭窄侧多发分支血管供血,可能起到代偿作用,还可能与该侧肾功能损伤有关[14]。阳性组24例中15例立位PRA水平明显升高,9例立位PRA虽较卧位时升高,但未超出正常水平,可能与长期高血压引起的水钠潴留、肾功能及药物干扰等因素有关[13]。另外,双侧肾动脉狭窄也使患者对卡托普利的灵敏度降低,本研究中8例双侧肾动脉狭窄,其中 6例CRS诊断为阳性,仅2例为阴性,但因样本数据量过小,难以进行统计分析,后续将积累病例,进一步对比分析CRS对于单侧和双侧肾动脉狭窄RVH患者的诊断价值。
综上所述,联合血浆PRA测定可提高CRS在RVH诊疗中的应用价值。
