丹红注射液治疗缺血性脑卒中的研究进展
2020-04-02
缺血性脑卒中是老年人致死的主要原因之一,是世界范围内导致中老年人永久性残疾的主要因素。超过80%的脑卒中病人属于因脑血管狭窄或闭塞而引起的缺血性卒中[1-2]。在过去20余年中,卒中发病及由于卒中引起的死亡人数均在增加[3]。静脉溶栓是目前认为最为有效和直接的治疗缺血性脑卒中的治疗方法,但由于受限于3~4.5 h的治疗时间窗,只有不到10%的急性脑卒中病人获益[4-5]。因此,寻找其他有效的治疗卒中方法一直是近年的研究热点,许多潜在有效的治疗方法近年来被广泛研究。大型临床研究DAWN的研究结果表明,血管内治疗(EVT)可以延长到脑梗死发病后24 h[6]。然而采用DAWN的纳入标准,基于对6 742例脑卒中病人临床数据分析表明,仅有32%病人在24 h内到达医院,只有1.1%的病人适合血管内治疗[7]。
天然药物和传统替代医学在近年来越来越受欢迎,发达国家中约有1/3的成年人曾尝试过传统替代医学的草本疗法[8]。中医药在中国及部分东南亚国家被用来治疗脑卒中已有几千年的历史,根据中医学理论,卒中属于“中风”范畴,血瘀证是其最常见证型,因此,活血化瘀在中风的治疗中非常重要[9]。许多被用来治疗缺血性卒中的中成药是具有活血化瘀功效的中草药提取物。北京中医药大学研究团队2018年主导了一项关于中成药治疗急性脑梗死临床疗效的系统研究,其研究荟萃分析了64项临床研究,涉及的中成药达15种(包括丹红注射液、舒血宁注射液、疏血通注射液、脉络宁注射液、复方丹参注射液、灯盏花素注射液、银杏达莫注射液、丹参川芎嗪注射液、丹参注射液、川芎嗪注射液、灯盏细辛注射液、参芎葡萄糖注射液等),总纳入病人达到了6 225例。其研究结果表明,在西医常规治疗基础上联用丹红注射液的临床显效率明显优于其他品种[10]。
丹红注射液是一种广泛用于脑梗死、冠心病、肺心病、糖尿病周围神经病变治疗中的中药制剂[11-12]。近年来出现了许多关于丹红注射液治疗脑梗死的机制研究,通过系统复习文献。丹红注射液治疗缺血性卒中相关机制主要方面见图1所示。
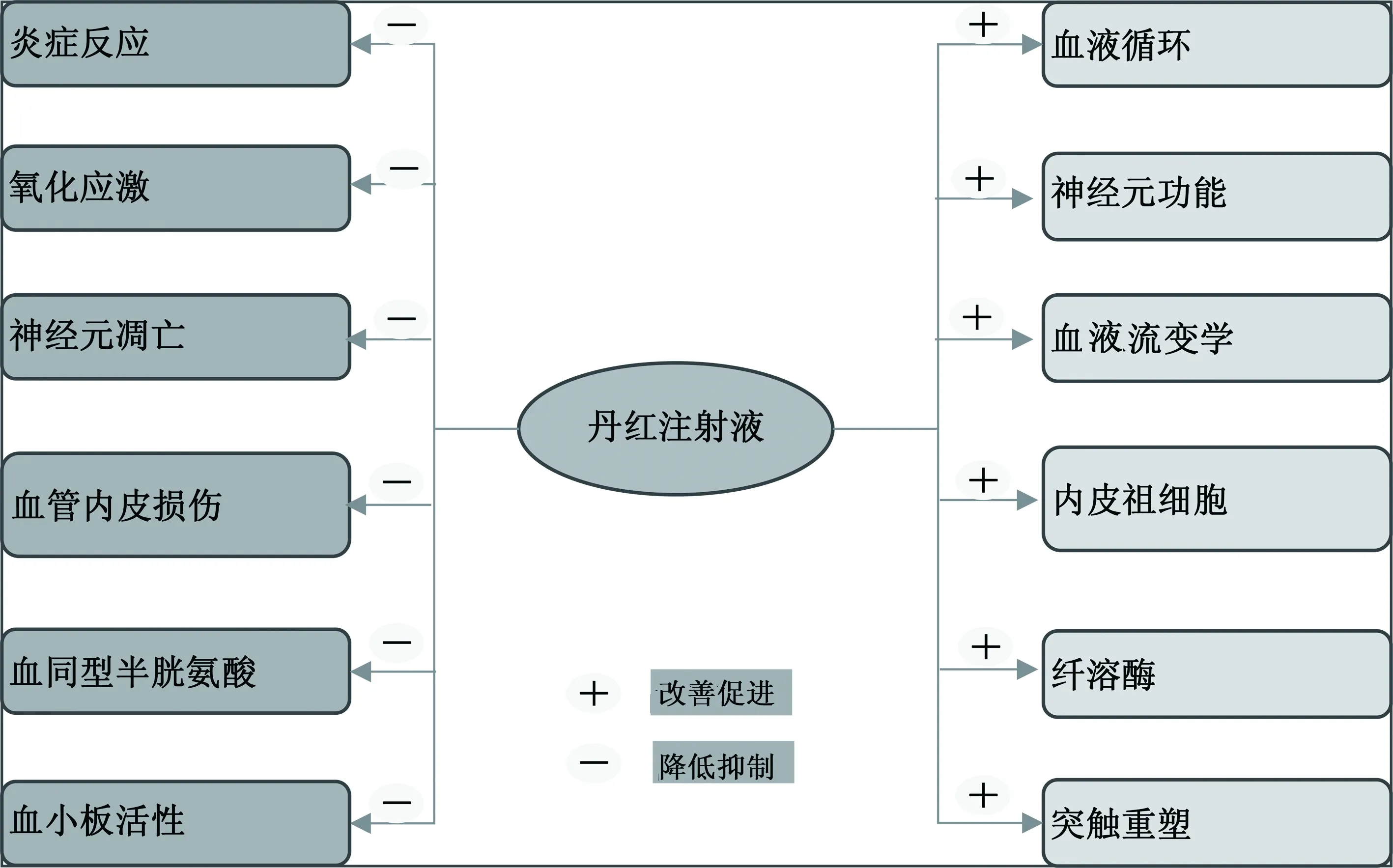
图1 丹红注射液治疗缺血性卒中的主要相关机制
1 延长阿替普酶(t-PA)静脉溶栓治疗时间窗
较短的治疗时间窗被认为是阿替普酶静脉溶栓的一个主要缺点,中草药是否有助于解决这个问题呢?最近,浙江中医药大学的研究者研究了丹红注射液在延长阿替普酶静脉溶栓时间窗方面的一些作用,其体外实验研究结果显示,当阿替普酶与丹红注射液以1∶1.6 W/V比例时可以将t-PA激活纤溶酶原的能力提高1.4倍;体内实验研究表明,丹红注射液(4 mL/kg)联合t-PA (2.5 mg/kg)可以将t-PA治疗时间窗延长至4.5 h,并且可以减轻血脑屏障损伤,减小脑梗死面积,减轻脑肿胀程度及溶栓后出血转化率[13]。但此方面的研究相对较少,需要更多的研究进一步证实。
2 改善血液循环
缺血性脑卒中最直接的原因是血管闭塞,所以促进血液循环、消除瘀血阻滞被认为是治疗脑梗死最直接的手段。许多研究均表明丹红注射液可以改善血液循环,包括影响血小板活化和血液流变学指标。
2.1 影响血小板活性 血小板P-选择素是血小板活性的一个敏感指标。临床研究表明,丹红注射液可以降低急性脑梗死病人的血P-选择素、血清白介素-8(IL-8)、扣针蛋白-5(fibulin-5) 水平[14]。另有临床研究表明,经丹红注射液治疗7 d后,血小板活化相关产物血小板活化标志物P-选择素(CD62P)、血小板膜糖蛋白Ⅱb/Ⅲa(PAC-1) 明显降低,在治疗14 d后,丹红注射液治疗组血 CD62p和PAC-1水平与对照组相比明显降低,且差异具有统计学意义[15]。
2.2 改善血液流变学指标 丹红注射液可以明显改善急性脑梗死病人血液流变情况。临床研究表明,经丹红注射液治疗后,病人大脑后动脉的收缩期峰值流速(Vs) 和平均血流速度 (Vm) 显著升高,而阻力指数(RI)显著降低;血液流变学指标全血黏度(高切、中切、低切)、血浆黏度及纤维蛋白原均比对照组显著降低 (P<0.05)[16]。
3 改善血管内皮损伤
内皮素 (ET)、血管内皮生长因子(VEGF)、内皮祖细胞与血管内皮功能密切相关。研究表明,丹红注射液可以升高急性脑梗死病人急性期的VEGF水平[17]。与单纯依达拉奉治疗组相比较,丹红注射液联合依达拉奉治疗有糖尿病基础的急性脑梗死病人可更有效降低ET水平 (P<0.05),从而发挥改善内皮细胞功能作用[18]。基于MCAO模型动物实验研究表明,与对照组相比,丹红注射液治疗14 d后可以明显升高VEGF、缺氧诱导因子-1α(HIF-1α)、FLK-1的蛋白及基因表达水平 (P<0.05),并且可明显减小脑梗死面积(P<0.05),表明丹红注射液可以减轻急性脑梗死血管内皮炎症损伤[19]。另一项研究表明,丹红注射液可明显升高急性脑梗死实验动物模型24 h、72 h 、168 h 时的CD133+/VEGFR-2+双标内皮内皮细胞个数,增加内皮祖细胞的数量,从而促进神经功能恢复[20]。另一项临床研究也证实了丹红注射液可以升高急性脑梗死病人7 d、14 d 、30 d时外周血的内皮祖细胞数量[21]。
4 抗氧化应激和炎症损伤
活化巨噬细胞和小胶质细胞可以诱导急性脑梗死时的炎症损伤[5,22]。因糖氧剥夺而导致活性氧(ROS)释放为主要标志的氧化应激反应在急性脑梗死发病过程中也发挥重要作用[23]。故此,抗炎症损伤和抗氧化应激也是缺血性卒中治疗的主要目标。
临床研究表明丹红注射液联用奥扎格雷可以显著降低急性脑梗死病人血清白细胞介素-18(IL-18)、肿瘤坏死因子-α(TNF-α) 水平[24]。与常规治疗组相比,添加丹红注射液治疗后可明显降低急性脑梗死病人的血清超敏C反应蛋白(hs-CRP)、IL-6 、TNF-α、丙二醛(MDA)水平 (P<0.05)[25-26],显著升高病人血浆超氧化物歧化酶(SOD) 水平 (P<0.05)[26]。与常规西医治疗组相比,常规西医治疗联合丹红注射液治疗2周后病人的SOD升高和MDA降低(P<0.05或P<0.01),而 hs-CRP和IL-6水平显著下降 (P<0.05)[27]。体外细胞实验也表明丹红注射液可以提高低氧损伤的Neuro-2A 细胞株的增殖活力,抑制ROS、乳酸脱氢酶(LDH)释放[28]。
5 抗神经元凋亡
凋亡在急性脑梗死后神经元存活、神经相关单元损伤及神经功能恢复方面发挥重要作用[29]。抗神经元凋亡是很多治疗卒中药物的主要作用机制之一。实验研究表明,丹红注射液可以抑制糖氧剥夺原代培养海马神经元caspase-3的表达,减少凋亡细胞数量[30]。基于组分配伍理论的实验研究表明,丹红注射液有效活性组分联用对低氧诱导原代培养脑微血管内皮细胞可以发挥明显保护作用,其机制与丹红注射液的抗凋亡功能相关[31]。
6 神经保护功能
血清神经元特异性烯醇化酶(NSE)和 S100B是神经系统受损伤的重要指标。通过对80例急性脑梗死病人的研究表明,相比西医常规治疗组,经联用丹红注射液治疗14 d后血清S100B 和 NSE下降更明显(P<0.01)[32]。实验研究表明,丹红注射液0.9 mL/kg、1.8 mL/kg、3.6 mL/kg 腹腔注射72 h后均可明显提高神经功能(P<0.05),并可降低NSE 水平 (P<0.05)。且丹红注射液 0.9 mL/kg、1.8 mL/kg 腹腔注射还可明显降低S100B 蛋白水平(P<0.05)[28]。
7 促进神经元突触重塑
神经元突触重塑在脑梗死后脑功能恢复中发挥重要作用,脑的重塑在脑梗死后神经功能恢复中发挥着非常重要的作用[33]。与单纯骨髓间充质干细胞注射相比,联用丹红注射液组的生长相关蛋白-43(GAP-43)表达水平明显升高 (P<0.05),表明丹红注射液可以促进脑梗死后GAP-43的表达,促进神经元重塑[34]。基于对大脑中动脉栓塞(MCAO)模型大鼠的动物实验表明,丹红注射液可以促进梗死灶周围区域GAP-43基因蛋白表达,促进轴突再生,改善神经功能[35]。
8 其他相关方面
8.1 降低血清同型半胱氨酸(Hcy) Hcy是脑卒中的独立危险因素。临床研究表明,在治疗前、治疗后7 d、治疗后15 d,急性进展性脑梗死病人的血清Hcy与神经功能缺损评分呈正相关(P<0.05);丹红注射液联用尤瑞克林治疗7 d和15 d后,与对照组相比,其Hcy水平明显下降(P<0.05)[36]。另一项临床研究也表明,经丹红注射液治疗后急性脑梗死病人的血清Hcy水平显著下降,与对照组相比差异差异有统计学意义(P<0.05)[37]。
8.2 调节氨基酸代谢 氨基酸代谢与脑梗死病理过程相关,丹红注射液可通过调节相关信号通路改善缺血再灌注损伤脑梗死大鼠氨基酸代谢水平[38]。
9 小结与展望
丹红注射液是丹参和红花的提取物[39],含有诸多具有脑血管和心血管保护功能的活性成分的丹参在亚洲很多国家被广泛使用,其主要成分包括亲脂性成分(丹参酮Ⅰ、丹参酮Ⅱa、丹参酮Ⅱb、隐丹参酮、二氢丹参酮等)和亲水性成分 (丹参素、丹酚酸A、丹酚酸B、原儿茶醛等)[40]。红花是一年生菊科草本植物,在包括中国和韩国在内的东方国家被用作染料和药物。传统中医学认为,红花具有重要的药理作用,如通过促进血液循环可活血化瘀止痛等[41-42]。科学家发现红花具有多种化学组成成分和药理作用,已从红花中分离出了200余种化学组分。很多研究关注的化学成分主要包括类黄酮、苯丙素苷类、脂肪酸、类固醇类、红花黄色素等。现代药理学研究表明,红花具有多种生物活性,如抗氧化、神经保护、免疫抑制、抗炎症、抗癌及黑色素生成抑制等作用[43-44]。作为丹参和红花的提取物,丹参注射液中有38种组分来自丹参,25种组分来自红花。源自丹参的酚酸和其衍生物占丹红注射液总组分的75%,这说明丹参是丹红注射液的主要来源,酚酸类是丹红注射液的主要活性成分。与此同时,源于具有活血化瘀通络作用红花的羟基红花黄色素A是丹红注射液中主要的辅助成分。而据中医理论,丹参和红花在活血化瘀通络方面是相须为用的[45]。
中医药被用来治疗卒中具有数千年的历史,在长期发展过程中根据中药“四气五味”建立起了独有的配伍理论如“君臣佐使”“七情和合”等。丹红注射液是相须药对丹参和红花的提取物。基于中医经典理论,用于治疗疾病的中药处方常不止一味中药,通常包括几味甚至几十味中药。当然,其化学组分非常复杂,具有多靶点治病的优势,然而,与此同时也带来一些困惑,其治病的确切机制很难阐释,有时也难以确定其具体发挥功效的活性成分。
关于中药注射液致严重不良反应的报告[46-47],中国食品药品监督管理局统计数据显示,近年来出现了12.7万例中药注射液不良事件,占据整个中医药不良事件的51.3%[48]。一项基于真实世界、多中心、大样本量、集中监控的前瞻性研究分析了丹红注射液的不良反应,共从全国37家三级甲等医院收集到30 888例使用丹红注射液的病人资料,最终发现了108例不良事件,发生率为0.35%[49]。另一个单中心研究表明丹红注射液的不良反应发生率达到了1.90%,且其不良反应事件可发生于循环系统、神经系统、消化系统、皮肤系统等[50]。
为了解决这一科学上的两难问题促进中医药的发展,组分配伍理论应运而生并被广泛接受认可。2005年,Zhang等[51]提出建立中药标准组分库以促进现代创新药物的研发。在组分配伍理论指导下,中药处方的传统理论精髓得以保持,中草药被其具体活性组分代替,这就解决了传统中药方剂的不足。至于丹红注射液,笔者认为以下几个方面尚需进一步深入研究发展: ①应进一步研究其组分配伍最佳比例,以此提高临床疗效,并最大限度减少副作用的发生; ②机制研究应涉及更多的信号传导通路,而不是仅仅局限于一些临床常见指标,可以借助网络药理学、生物信息分析等方法进行深入筛选、分析、研究; ③临床研究的质量有待进一步提高,以提升临床使用丹红注射液的循证依据级别。
