不同剂量重组人生长激素治疗对特发性矮小症患儿身高、体重以及血清IGF-1和IGFBP-3表达的影响
2020-04-01郭艳艳蒋成霞
郭艳艳,蒋成霞,姚 兰,黄 炜
目前,在我国特发性矮小症(ISS)的发病率约为3%,且呈逐年上升的趋势,严重影响患儿的个性、自尊自信、认知发育能力和社交能力[1]。导致ISS的原因复杂,临床应详细询问病史、进行全面体格检查,并合理的选择实验室及特殊检查,进行全面分析,从而做出诊断[2]。血清胰岛素样生长因子-1(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)随年龄增长和发育而增高,且与营养、骨代谢等因素密切相关,是针对身材矮小儿童常用的特殊检查指标[3]。重组人生长激素(r-hGH)是目前治疗ISS的主要药物,推荐剂量为0.1~0.2 U/(kg·d),但是剂量选择尚无统一标准,选择有效、安全的剂量方案具有重要的临床意义[4]。因此,本研究观察大剂量与小剂量r-hGH在ISS治疗中的应用情况,现将研究结果报告如下。
1 资料与方法
1.1一般资料 回顾性分析2014年3月—2018年4月宜宾市第二人民医院58例ISS患儿的临床资料。①纳入标准:所有患儿符合《诸福棠实用儿科学》中关于ISS的诊断标准[5];年龄6~12岁;就诊前1个月无糖皮质激素、内分泌、免疫、抗生素治疗史;患儿家属均知情同意并签署知情同意书。②排除标准:存在先天性畸形、染色体异常、宫内发育迟缓等疾病者;有明确全身性、营养性、消耗性或器质性疾病者;有严重心理、情感障碍疾病或摄食异常者;临床资料不全者。按照r-hGH的应用剂量不同分为大剂量组31例和小剂量组27例。其中大剂量组男17例,女14例;年龄6~12(8.17±1.83)岁;青春Tanner分期:Ⅰ期20例,Ⅱ期11例。小剂量组男14例,女13例;年龄6~12(8.21±1.85)岁;青春Tanner分期:Ⅰ期18例,Ⅱ期9例。2组的性别、年龄、青春Tanner分期等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 2组均予以指导合理饮食以及补充钙剂、维生素、微量元素等基础营养治疗。大剂量组在此基础上予以r-hGH(长春金赛药业股份有限公司,国药准字:S10980102)0.2 U/(kg·d)每晚睡前皮下注射,注射部位取脐周、大腿中部前外侧面,每次注射应更换注射点,持续治疗12个月。小剂量组则将r-hGH剂量调整为0.1 U/(kg·d)每晚睡前皮下注射,其余同大剂量组。
1.3观察指标 所有患儿通过电话、复诊等方式随访12个月。于治疗前及治疗12个月后测定2组的身高、体重,并计算生长速度(GV)、身高标准差积分(Ht SDS),GV=(治疗后身高-治疗前身高)/间隔时间×12,Ht SDS=(实测身高值-同龄儿童身高的均值)/同龄儿童身高的标准差。于治疗前及治疗12个月后采集清晨空腹静脉血6 ml,离心分离血清;采用西门子IMMULITE 2000-全自动化学发光免疫分析仪及配套试剂盒检测血清IGF-1、IGFBP-3水平;采用罗氏cobas e 601电化学发光仪及配套试剂盒检测血清骨代谢相关指标:Ⅰ型前胶原氨基端前肽(PⅠNP)、骨碱性磷酸酶(BAP)、Ⅰ型胶原交联羧基末端肽(β-CTX)水平差异。观察2组治疗过程中的不良反应发生情况。

2 结果
2.1生长情况相关指标比较 治疗前,2组身高、体重、GV、Ht SDS比较差异均无统计学意义(P>0.05)。治疗后,2组身高、体重、GV、Ht SDS均较治疗前明显升高,且大剂量组明显高于小剂量组(P<0.05)。见表1。

表1 2组ISS患儿治疗前后身高、体重、GV、Ht SDS比较
注:ISS为特发性矮小症,GV为生长速度,Ht SDS为身高标准差积分;与治疗前比较,aP<0.05;与小剂量组比较,cP<0.05
2.2血清IGF-1、IGFBP-3水平比较 治疗前,2组血清IGF-1、IGFBP-3水平比较差异均无统计学意义(P>0.05)。治疗后,2组血清IGF-1、IGFBP-3水平均较治疗前明显升高,且大剂量组明显高于小剂量组(P<0.05)。见表2。
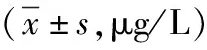
表2 2组ISS患儿治疗前后血清IGF-1、IGFBP-3水平比较
注:ISS为特发性矮小症,IGF-1为胰岛素样生长因子-1,IGFBP-3为胰岛素样生长因子结合蛋白-3;与治疗前比较,aP<0.05;与小剂量组比较,cP<0.05
2.3骨代谢相关指标比较 治疗前,2组血清PⅠNP、BAP、β-CTX水平比较差异均无统计学意义(P>0.05)。治疗后,2组血清PⅠNP、BAP水平均较治疗前明显升高,且大剂量组高于小剂量组(P<0.05);2组血清β-CTX水平均较治疗前明显降低,且大剂量组明显低于小剂量组(P<0.05)。见表3。

表3 2组ISS患儿治疗前后血清PⅠNP、BAP、β-CTX水平比较
注:ISS为特发性矮小症,PⅠNP为Ⅰ型前胶原氨基端前肽,BAP为骨碱性磷酸酶,β-CTX为Ⅰ型胶原交联羧基末端肽;与治疗前比较,aP<0.05;与小剂量组比较,cP<0.05
2.4不良反应发生情况比较 2组总不良反应发生率比较差异无统计学意义(P>0.05)。见表4。

表4 2组ISS患儿不良反应发生情况比较[例(%)]
注:ISS为特发性矮小症
3 讨论
ISS是指患儿身高较同种族、同年龄、同性别正常儿童平均身高低2个标准差,并排除先天性、器质性、内分泌系统疾病、染色体病、慢性系统性疾病、营养心理疾病等已明确病因导致的生长障碍[6]。ISS是一个排他性、描述性的分类,并不是一种特定的临床诊断,故是小儿生长落后最常见的类型,约占矮小儿童的60%~80%[7]。
生长激素是由人垂体前叶分泌的具有促进除神经组织外其他组织生长、蛋白质合成、脂肪分解、微量元素吸收及抑制葡糖糖利用等作用的蛋白质激素[8]。r-hGH具有与内源性生长激素相似的作用,于2003年6月经美国FDA批准用于ISS的治疗,国内外研究均已证实,r-hGH治疗ISS安全、有效[9-11]。但目前临床应用r-hGH剂量范围较大,常用剂量是0.1~0.2 U/(kg·d),剂量选择尚无统一标准,且不同剂量疗效存在差异[12-13],故选择有效、安全的用药剂量具有重要临床价值。本研究对58例r-hGH治疗ISS患儿的临床资料进行回顾性分析,发现治疗12个月后,2组身高、体重、GV、Ht SDS均较治疗前明显升高,且大剂量组明显高于小剂量组,表明r-hGH的促生长效应呈剂量依赖性,大剂量r-hGH促生长效果更优。
生长激素由垂体前叶合成、分泌,受生长激素释放激素和生长抑素的双重控制[14]。生长激素可直接作用于干骺端生长板上的软骨细胞前体,促进细胞分化[15]。亦可通过生长激素-IGF-1轴对骨骼生长发挥调节作用,生长激素与肝脏等靶器官上的生长激素受体结合,合成IGF-1,IGF-1与IGFBP-3、酸不稳定亚单位形成三元复合物,进入血液循环,结合长骨骨干末端生长板软骨细胞上的IGF-1受体,促进细胞分裂增殖[16-17]。本研究结果发现,治疗12个月后,2组血清IGF-1、IGFBP-3水平均较治疗前明显升高,且大剂量组明显高于小剂量组;显示大剂量r-hGH对ISS患儿血清IGF-1、IGFBP-3水平的改善作用优于小剂量r-hGH,更有利于促进患儿骨骼的生长。本研究对ISS患儿的骨代谢指标分析也发现,治疗12个月后,2组血清PⅠNP、BAP水平均较治疗前明显升高,且大剂量组明显高于小剂量组;2组血清β-CTX水平均较治疗前明显降低,且大剂量组明显低于小剂量组;显示r-hGH治疗ISS有助于加快患儿骨形成及骨吸收速度,促使机体呈高转换状态,骨形成大于骨吸收,骨量累积,从而有效促进骨骼生长,且大剂量r-hGH促进生长效果更为显著。此外,本研究还显示,2组总不良反应发生率比较差异无统计学意义;表明相较于0.1 U/(kg·d)r-hGH,0.2 U/(kg·d)r-hGH治疗ISS并未增加不良反应发生率,且不良反应皆在可控范围内,安全性良好。
综上所述,0.2 U/(kg·d)r-hGH可有效促进ISS患儿生长,改善患儿血清IGF-1、IGFBP-3水平和骨代谢,效果优于0.1 U/(kg·d)r-hGH,且安全性良好。
