纳米材料在放射性废水处理中的应用进展
2020-04-01赵海洋倪士英张林
赵海洋,倪士英,张林
(1火箭军工程设计研究院,北京100011;2环境保护部辐射环境监测技术中心,国家环境保护辐射环境监测重点实验室,浙江杭州310012;3浙江大学化学工程与生物工程学院,浙江杭州310027)
近年来,我国核工业发展迅速,截至2018 年底,投入运行的核电机组达到44 台,装机容量达到4464.5×104kW。《“十三五”核工业发展规划》显示,到2020 年,我国核电运行和在建装机将达8800×104kW。核能的开发利用有助于缓解目前所面临的能源危机,但随之产生的放射性污染也成为一个严峻的环境问题。在核能开发利用过程中,铀矿勘察和开采、铀提炼和浓缩、核燃料元件制备、核能发电、乏燃料后处理等环节均会产生一定量的放射性废水,危及水环境和水生态的安全。因此,核电工业的发展对放射性废水处理提出了更高要求。
纳米材料是近年来颇受关注的一类新兴功能材料,其独特的纳米结构赋予了材料一些特异效应,如小尺寸效应、量子尺寸效应、表面效应、宏观量子隧道效应等。小尺寸效应能够增强材料的韧性和吸附能力,量子尺寸效应会增强材料的氧化还原能力,表面效应提高了材料的表面活性、比表面积等[1],因此纳米材料具有异于传统材料的性质,被广泛尝试应用于放射性废水处理,包括放射性核素的去除、富集、提取等。但纳米材料存在易团聚、难分散、生物毒性不明等问题,通常在使用前需根据放射性核素的种类、浓度和共存离子类型进行改性、修饰、接枝等化学处理[2],除了克服上述问题外,还能增加纳米材料对放射性核素的吸附能力[3]:一方面,化学处理能够除去纳米材料中的杂质,提高纳米材料的比表面积;另一方面,化学处理可以引入功能基团(如COOH、OH或者C—O),改善其亲水性和反应活性。
基于放射性废水处理的重要性和纳米材料在其中表现出的良好应用前景,本文对此进行综述,依据在放射性废水处理中的应用方式,总结了纳米材料作为吸附介质和分离膜材料对放射性核素的处理性能和应用研究进展,并讨论了纳米材料处理放射性废水的重点发展方向。放射性废水处理相关文献大多采用冷实验,即采用无放射性的同位素开展相关实验研究。下文如无特殊标注,元素符号均代表非放射性同位素。
1 纳米材料处理放射性废水的原理
通过动力学分析、热力学分析、光谱技术分析、表面络合模型分析、理论计算分析等方法可对纳米材料处理放射性废水的原理进行研究[4]。纳米材料对放射性核素的去除主要依赖于放射性核素在纳米材料与水界面发生相互作用的过程,因此,纳米材料处理放射性废水的机理因纳米材料种类、放射性核素种类、反应环境条件等不同而存在差异。本文依据纳米材料在放射性废水处理中的应用方式,将纳米材料处理放射性废水的原理分为吸附和膜分离。
纳米材料吸附放射性废水的反应机理又可分为外层表面络合、内层表面络合、表面共沉淀、氧化还原反应等[5]。此外,放射性核素和纳米材料之间的吸附过程不仅与放射性核素在纳米材料表面的氢键、分子间作用力或化学键合等相关,还涉及进入纳米材料内部时发生的各种物理和化学反应[6]。
纳米材料膜法处理放射性废水可根据其作用机理分为纳滤和膜吸附。前者利用纳米材料制备纳滤膜,基于筛分作用和电荷排斥作用对放射性废水中核素实现选择性分离,处理效果主要取决于纳米材料与放射性核素表面的电荷情况,包括性质、密度和分布;后者利用纳米材料制备吸附膜,将筛分作用和吸附作用结合实现对放射性废水中核素的选择性分离,处理效果主要取决于纳米材料对放射性核素的吸附特性。
两者膜法处理方式的最大差异在于:前者在合理工况下可连续长期运行,后者则在一定时间内达到吸附饱和,存在穿透现象。此外,两种分离膜的膜孔明显不同,前者的膜孔较小,一般在1nm 左右;后者的膜孔较大,一般在微米、亚微米级别。
2 吸附
吸附是放射性废水处理的主要方法之一,具有工艺简单、操作成本低、去除率高、选择性好等优点,但传统的吸附剂存在吸附容量有限、易产生二次污染、难再生等问题。纳米材料种类丰富,特别是功能化修饰后的纳米材料表面含有大量活性基团,易与放射性核素形成金属离子螯合物;另外,丰富的网络结构纳米孔道,使其具有很高的吸附容量,因此常被用作吸附剂去除水体中的放射性核素。
用于放射性废水处理的纳米材料可根据其结构分为零维(如原子团簇、纳米球)、一维(如纳米管、纳米棒)、二维(如纳米片、纳米板)和三维(由上述纳米材料为基元构成的多级结构,例如纳米片组装而成的花球)纳米材料。
2.1 零维纳米材料
用于放射性核素吸附的零维纳米材料包括纳米氧化物、纳米金属颗粒等。
2.1.1 纳米氧化物
纳米氧化物在水解后表面富含羟基,可与放射性核素通过配位键形成络合物,从而吸附去除水体中的放射性核素。
二氧化钛(TiO2) 可被用于去除水体中的、Eu3+等放射性核素[7-8],纳米TiO2具有更大的比表面积和更丰富的羟基,因而可更高效地去除水体中的核素离子。Tan 等[9-10]考察了直径为22nm的纳米TiO2颗粒吸附去除水体中Th4+的效果。在投加量为0.1g/L、初始离子浓度为7.6μmol/L、pH为3的条件下,最大吸附量可达49.4mg/g。红外表征发现,TiO2吸附Th4+后生成了Ti-O-Th 配合物,说明该吸附过程的机理主要是表面络合作用。
纳米Fe3O4颗粒和纳米Fe2O3颗粒是一类具有磁性的吸附材料,可克服TiO2纳米颗粒难以回收的问题。Zhou等[11]将直径约50nm的磁性纳米Fe3O4颗粒包裹在钛酸盐内,制成多级介孔结构纳米复合材料,用于去除模拟废水中的Ba2+(代替具有相近离子半径和离子交换性质的放射性Ra2+),最大吸附容量为118.4mg/g。复合材料在吸附Ba2+后,可通过磁分离方法实现便捷分离。Majidnia 等[12]将两种具有光电催化特性的纳米颗粒(γ-Fe2O3和TiO2)包埋入PVA-藻酸钠中制成纳米复合微球,可借助光照调控对Ba2+的吸附效果。在溶液pH为8、初始浓度为50mg/L 的条件下,纳米复合微球能够在150min 内去除水体中99% 的Ba2+,效果优于γ-Fe2O3微球和TiO2微球。此外,也有研究者将磁性纳米颗粒与、壳聚糖[14]、真菌[15]等材料结合,从而改善其对放射性核素的吸附效果。
纳米氧化银(Ag2O)易与I-生成不溶性沉淀物AgI,因此在放射性核素I-的去除方面有很好的应用潜力。Mu等[16]认为,I-的去除能力和去除速率取决于Ag2O 的比表面积,粒径较大的纳米Ag2O 颗粒比表面积较小,去除容量和反应活性不佳;而粒径较小的Ag2O 颗粒对I-去除效果则明显提高,但小粒径的Ag2O 颗粒易团聚。为此,研究者们尝试将纳米Ag2O 颗粒固定在不同种类的基底材料上以减少其团聚,进而提高对I-的去除效率。例如,固着在纤维素[17]、铌酸钠复合物[18]、钛酸盐纳米管[19]的纳米Ag2O能够更高效地俘获水中的放射性I-。
ZnO是一种富含多羟基的环境友好型材料,纳米尺寸的ZnO 颗粒可高效去除水体中的重金属。Kaynar等[20-21]采用微波法制备了直径约57nm的纳米ZnO颗粒,并尝试用于吸附放射性核素。在最优条件下,纳米ZnO 颗粒对的去除率可达98.7%,最大吸附量可达1111mg/g;对Th4+的去除率可达97.0%,最大吸附量可达1500mg/g。
综上所述,多数纳米氧化物主要通过羟基与核素离子形成配位键,发生化学吸附,从而将放射性核素从水体中去除。由于纳米颗粒尺度较小,吸附后回收是阻碍其应用的主要难题之一,因此,纳米磁性氧化物的易回收优点使之备受青睐。另外,纳米Ag2O 在放射性核素去除中主要依赖于其与I-形成稳定的不溶性沉淀物而达到去除放射性碘的目的,因此,主要应用于放射性碘的去除。
2.1.2 纳米金属颗粒
一些纳米金属颗粒(如纳米零价铁和纳米银)可与部分放射性核素或基团发生氧化还原反应,生成低价态的不溶性单质或氧化物,实现放射性核素的分离。
纳米零价铁(nZVI)是一种还原性强的纳米金属颗粒。在中性和碱性条件下,nZVI是1个壳核结构,α-Fe0为核,表面包裹1层铁氧化物(FeO),nZVI 可与发生氧化还原反应,生成不溶性的铀氧化物UO2,故常用于去除水体中的放射性核素铀。万小岗等[22]探讨纳米零价铁对废水中铀浓度为的去除效果,在pH 为5、初始浓度为10mg/L时,nZVI 对铀的去除率可达99%,比普通铁粉还原速率高15 倍。这是因为纳米铁的比表面积远远大于普通铁粉,在溶液中更容易生产悬浮的胶体,与UO2+2的反应更快更充分。nZVI 存在分散性较差、极易被氧化的问题,通常需要与其他功能材料复合使用。Xu 等[23]发现,nZVI 负载在蒙脱石上可同时有效地解决其易氧化和易团聚的问题。nZVI还可将还原为低价态的不溶性的的氧化物TcO2,从而达到去除的目的。Darab 等[24]将nZVI(直径10~30nm)负载在不同支撑物上用于去除放射性废水中的。研究表明,负载在硅胶支撑物上的nZVI 可在中性环境(pH=7)、TcO4-初始浓度为0.076mmol/L 的条件下,反应18h 可去除95%的。
与纳米氧化银类似,纳米银也可用于去除水体中的放射性核素I-。张煜昌等[25]通过紫外光解法将纳米银颗粒负载在TiO2颗粒上,获得了均匀负载的Ag/TiO2材料,用于吸附溶液中放射性I-。结果表明,TiO2材料表面负载的Ag包括单质Ag(0)和Ag2O两种形态,以Ag(0)为主。当I-初始浓度为220mg/L时,对I-的饱和吸附容量为212mg/g。Liu 等[26]详细研究了纳米Ag颗粒在吸附I-过程中的作用:首先,Ag2O 与H+和I-反应生成AgI;同时,受表面等离子体共振效应影响,Ag/TiO2受可见光激发产生电子/空穴(e-/h+)对。激发电子e-被纳米Ag捕获,空穴h+将I-氧化为I2。最后,I2被附近的纳米AgI颗粒吸收形成AgI3,或被AgI2n-1吸收形成AgI2+1。因此,Ag/TiO2光催化作用使Ag2O 吸附I-的能力提高了2n+1倍。
虽然可用于放射性废水处理的纳米金属颗粒种类较少,但其应用领域比较广泛,通常可与放射性核素形成不溶性沉淀物,吸附后易于回收。然而,纳米金属颗粒的分散性较差,在应用中常与其氧化物共存,负载活性基底材料有助于改善其分散性和吸附效果。零维纳米材料对放射性核素的吸附性能见表1。
2.2 一维纳米材料
用于放射性核素吸附的一维纳米材料可分为纳米管和纳米纤维。
2.2.1 纳米管
碳纳米管(CNTs)经化学处理生成的含氧官能团可通过表面络合、离子交换和电化学势与离子形成非常稳定的配合物[29],从而显著改善CNTs 对水体中放射性核素的吸附去除能力。Sun 等[30]对比发现,硝酸氧化的MWNTs对等的饱和吸附量达42.3mg/g,明显高于比相同条件下CNTs 的吸附量(25.7mg/g)。Li 等[31]对 比 了H2O2、HNO3和KMnO43 种氧化方法处理的CNTs 对Cd2+吸附效果。3 种氧化CNTs 的饱和吸附量分别为2.6mg/g、5.1mg/g 和11.0mg/g,均高于原始CNTs 的吸附能力(1.1mg/g)。Yang 等[32]发现磺化磁性CNTs 不但对Co2+具有较好的吸附性能,室温下饱和吸附量为8.42mg/g,而且自身的磁性有利于吸附后回收。利用羧甲基纤维素(CMC)[33]、聚苯胺(PANI)[34]、壳聚糖(CS)[35]等功能性材料修饰CNTs,能够改善其分散性和稳定性,从而增强对放射性核素的吸附效果。
钛酸盐纳米管(T3NT)具有优良的离子交换能力和较高稳定性,比表面积大和孔隙率高,拥有独特的层状结构,吸附放射性离子后,其晶相结构由亚稳态转为稳态,永久固化核素,防止二次污染。Yang 等[36]考察了T3NT 在初始Cs+浓度为250 mg/L 的溶液中,吸附去除率可达85%;当初始137Cs+浓度低于80mg/L 时,吸附去除率可达100%。在吸附137Cs+后,T3NT 结构发生显著变化,长度从100~200nm 缩短至60~80nm,直径从8nm增加至11nm,片层间距从0.72nm 增加至0.85nm。这是因为该吸附过程属于离子交换,尺寸较大的137Cs+代替H+,增大了片层间距,破坏了部分管壁结构。Xu 等[37]发现UO2+2通过离子交换方式进入纳米管后,导致其片层结构发生严重形变而破裂成纳米片,致使UO2+2被永久包埋。Liu等[38]认为T3NT对Th4+的吸附机理是表面络合作用,吸附效果严重依赖pH,但受离子强度影响很小。Xu 等[39]利用真菌与T3NT 耦合,制备成稳定的生物纳米复合材料,不但能够高效吸附去除水体中的Ba2+,还能实现吸附剂的快速回收。

表1 零维纳米材料对放射性核素的吸附特性对比
2.2.2 纳米纤维
碳纳米纤维(CNF)的物化性质与CNT 类似,但更廉价易得。Sun 等[40]通过水热法制备的CNF 具有大量的含氧基团,对UO2+2和Eu3+的吸附容量分别达到125.0mg/L 和91.0mg/L。通过等离子接枝和化学接枝两种方式改性CNF,制备出富含氨基和羟基的两种偕胺肟基接枝CNF,能够更高效地吸附水体中的放射性核素[41]。前者对238UO2+2和241Am3+的吸附容量分别是588.2mg/L 和40.8mg/L,均高于后者的263.2mg/L 和22.8mg/L。Hu 等[42]研究发现,在不同pH 条件下CNF 吸附UO22+的机理明显不同:当pH=4时,吸附机理为外表面的络合作用;当pH=7时,吸附机理由内表面络合作用和表面共沉淀共同主导。
钛酸盐纳米纤维(T3NF)与T3NT具备相似的物化性质,可用于放射性废水处理。Yang等[43]的研究表明,T3NF可选择性吸附水中放射性离子Sr2+和Ra2+,且最大吸附量分别是55.2mg/g 和229.3mg/g,明显优于传统的吸附剂(如层状黏土、沸石等)。T3NF 吸附放射性离子后会发生结构变形,使得放射性离子无法再解吸附,约93%Sr2+和92%Ra2+会永久保留。然而,纳米纤维与纳米管的结构明显不相同,纳米纤维的比表面积远小于纳米管,因此吸附性能较差。在相同条件下,T3NF 对137Cs+的最大吸附容量为68.5mg/g,明显低于T3NT 的吸附容量(205.5mg/g)[36]。
矾酸钠纳米纤维(VNF)由带负电的细小片层组成,片层间的Na+可与溶液中的核素离子发生不可逆的离子交换作用。Sarina等[44]制备的VNF对Cs+和Sr2+的最大吸附容量分别为294.6mg/g 和93.5 mg/g。VNF 片层间的Na+被137Cs+置换后发生显著形变,当65%的钠离子被置换时,片层间距由0.774nm 增至0.845nm。纤维结构发生变形后,137Cs+会被牢牢束缚在纤维内部,离子交换逐渐停止。此外,VNF 负载Ag2O 粒子后可同时去除水体中的125I-,在137Cs+和125I-初始浓度为100mg/L的模拟废水中,该纤维对两种核素的吸附去除率可达90%和96%。
铌酸钠纳米纤维(NNF)与VNF 具有相似的结构和功能。Mu等[45]发现,NNF对Sr2+的最大吸附可达280.4mg/g,纤维片层内的Na+与Sr2+发生离子交换后,会引起片层结构变形,导致Sr2+被牢固束缚。此外,Ag2O 负载NNF 形成的复合材料可同时去除水体中的I-,但吸附Sr2+的容量有所减小。当复合材料中Na∶Ag=1 时,复合材料对I-的吸附容量 为337.6mg/g, 对Sr2+的 吸 附 容 量 减 少 为175.2mmol/g。
一维纳米材料通过表面络合作用、离子交换等方式与放射性核素形成稳定的配合物,特别是钛酸盐、矾酸盐、铌酸盐等纳米管/纤维在吸附放射性核素后会发生结构形变,实现放射性核素的永久固化,避免二次污染,在放射性废水处理中表现出较大的应用潜力。一维纳米材料对放射性核素的吸附性能见表2。
2.3 二维纳米材料
用于放射性核素吸附的二维纳米材料可分为石墨烯、纳米层状双氢氧化物和钛酸盐纳米薄片。
2.3.1 石墨烯
石墨烯在水溶液中的分散性较差,因此使用前通常需要氧化处理,生成氧化石墨烯(GO)。GO易于和各种放射性离子发生化学反应,在较大的pH 范围内表现出优异的吸附性能,明显优于膨润土和活性炭[47]。GO 表面存在的羟基、环氧基和羧基等含氧基团会影响GO 与放射性核素的结合能力。Sun等[48]对比了GO、羧化GO(GO COOH)和还原GO(rGO)对UO2+2的吸附性能发现,3 种石墨烯衍生物的吸附能力依次是rGO<GO COOH<GO,解吸顺序为GO COOH<GO<rGO,这是因为rGO 和GO COOH 的吸附属于内层络合作用,而rGO的吸附属于外层络合作用。此外,氨化修饰也能增强GO 吸附水中放射性核素的效果。氨化GO(GO NH2)的吸附容量可达116.35mg/g,明显高于GO 的吸附容量(68.20mg/g);当投加量为0.3g/L时,5min内对Co2+的吸附率可达90%以上[49]。磺化GO()对放射性核素的吸附性能更优良,当投加量为0.1g/L时,20min内对Cd2+的去除率>93%,吸附容量可达234.8mg/g[50]。将GO与聚丙烯酰胺(PAM)[51]、普鲁士蓝[52]、聚苯胺(PANI)[32]、羟基磷灰石(HPA)[53]、聚偕氨肟(PAO)[54]等功能材料复合,可在一定程度上改善GO的使用范围和吸附效果。

表2 一维纳米材料对放射性核素的吸附特性对比
2.3.2 纳米层状双氢氧化物
层状双氢氧化物(LDHs)是一类重要的二维层状化合物,因化学性稳定、成本低、毒性低等特点而被广泛使用。纳米LDHs具有独特的片层结构和优良的离子交换能力常被用于吸附水体中的放射性核素。近期,Gu等[55]对纳米LDHs的制备、改性和处理放射性废水的应用作了详细的综述,本文不再赘述。
2.3.3 钛酸盐纳米片
钛酸盐纳米片(T3NL)可认为是由钛酸盐纳米管沿长轴线剖分得到的钛酸盐片层,因此具有与T3NT 相似的物化性质。韩玉等[56]采用水热制备了具有层状结构的T3NL,吸附试验表明,纳米片对Sr2+和Ba2+的吸附容量分别为117.4mg/g和339.2mg/g,明显优于T3NF 的吸附容量(55.2mg/g 和160.7 mg/g)[43],因为前者具有较大的比表面积。然而,纳米片对Sr2+和Ba2+的吸附容量仅为理论值的40%和75%,说明片层间部分Na+无法进行离子交换。由于Sr2+和Ba2+与带有负电荷纳米片的作用力大于Na+与纳米片的作用力,离子交换后T3NL的片层间距(0.979nm) 发生减小(0.903nm 和0.938nm),致使离子交换无法继续,核素离子被永久固定。
二维纳米材料与一维纳米材料的吸附性质具有很大的相似性,但其结构明显不同,前者具有更高的比表面积,吸附位点更易于暴露并被充分利用,因此具有更高的吸附效率。然而,前者具有较小的尺寸和较好的分散性,不易于吸附后回收。二维纳米材料对放射性核素的吸附性能见表3。
2.4 三维纳米材料
用于放射性核素吸附的三维纳米材料是指由上述各种纳米材料为基本单元构成的具有多级结构的纳米复合物,它结合了多种纳米材料的特性,能够更有效地吸附水体中的放射性核素。Liu 等[26]将零维纳米Ag2O 颗粒(直径1~4nm)负载到零维TiO2球表面,制成了三维纳米Ag2O/TiO2复合材料,TiO2的光学特性使得Ag2O 对I-的吸附效果可被光照调控。Yang 等[57]利用零维纳米Ag2O 颗粒(5~10nm)修饰一维钛酸盐纳米管(T3NF)和钛酸盐纳米纤维(T3NT),制备成具有三维纳米结构的Ag2OT3NF 和Ag2O-T3NT 复合纳米材料,同步去除放射性阳离子和阴离子。Chen 等[58]将零维纳米Ag2O 颗粒(直径5nm)负载到的二维纳米Mg(OH)2片(厚度5nm,白色),形成稳定的三维Ag2O/Mg(OH)2复合材料(深棕色),克服了Ag2O基纳米复合材料只能在有限pH范围内使用的缺陷。
因此,三维纳米材料是吸附材料未来发展的重要内容,它能够集合多种纳米结构和纳米材料的优势,多方面满足吸附去除水体放射性核素的需要。但是,三维纳米材料的制备通常需要比较精巧的结构设计和相对复杂的工艺流程。部分三维纳米材料的吸附性能见表4。
3 膜分离
微滤(MF)、超滤(UF)、纳滤(NF)、反渗透(RO)和膜蒸馏(MD)等膜分离过程具有截留效率高、能耗低、操作便捷等特点,在放射性废水处理领域得到广泛关注[65]。在放射性废水处理中,膜分离技术常与吸附、沉淀等工艺联合使用,以提高核素离子的去除效率。例如,Rao 等[66]对比了沉淀-UF 和吸附-UF 对Sr2+和Cs+的去除能力;Khedr等[67]研究了NF-RO 工艺处理地下水中放射性同位素的效果;Zhang 等[68]利用亚铁氰化钾锌吸附-MF去除水体中的除Cs+。加拿大的Bruce核电站、美国的Wolf Creek 核电站、Dresden 核电站和Comanche Peak核电站均采用超滤-反渗透组合工艺处理地面排水、清洗废水等放射性废水[69]。然而,膜分离法在处理放射性废水中通常面临通量偏低、膜污染、膜分离性能衰减等问题。
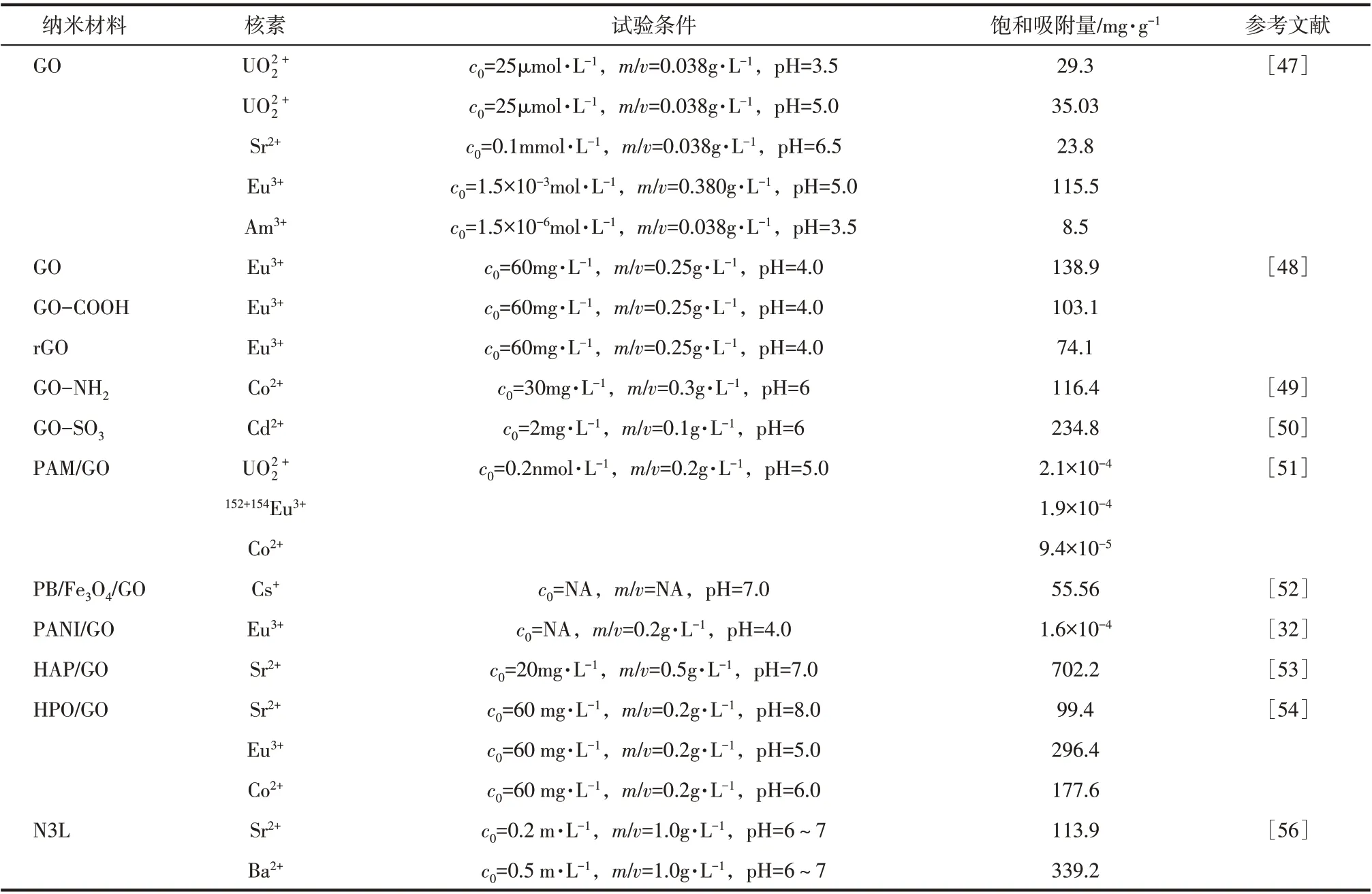
表3 二维纳米材料对放射性核素的吸附特性对比

表4 三维纳米材料对放射性核素的吸附特性对比
纳米材料既可直接作为膜材料,也可作为制膜添加剂以增加分离膜制备的调控维度,改善膜分离技术在放射性废水处理中的应用效果。根据放射性废水处理领域中分离膜的制备方法和纳米材料在放射性废水处理中的应用方式,纳米材料改善分离膜性能的方式可分为3 类:①纳米材料作为膜材料,单独制备成分离膜,即自支撑纳米分离膜;②利用纳米材料修饰分离膜,制备纳米材料改性复合膜;③纳米材料作为添加剂,在制膜过程中与膜材料结合,生成纳米杂化复合膜。
3.1 自支撑纳米分离膜
自支撑纳米分离膜是指仅依赖纳米材料之间的相互作用使其成为可用于分离的稳定薄膜。在现有文献报道中,可制备成自支撑纳米分离膜的常见纳米材料主要包括一维纳米管和二维纳米片。一维纳米管主要以CNTs 为主,因其典型的空腔结构,可快速传递分子、离子或原子[70]。CNTs 阵列常用于离子、气体分子、有机分子的分离[71-72],可看作是一种高效的纳米分离膜。二维纳米材料以石墨烯为主,单层石墨烯表面的纳米孔能够充当分子通道,已被用于海水淡化[73]和气体分离[74]等领域。因此,具有纳米孔的单层石墨烯可看作是最薄的纳米分离膜。另外,石墨烯折叠或堆积形成片层间隙,也可充当分子通道,已被广泛应用于脱盐[75]、油水分离[76]、气体分离[77]等领域。因此,具有片层结构的石墨烯膜也是一种优良的纳米分离膜。Rauwel等[78]在其综述文献中也探讨了将功能化石墨烯与普鲁士蓝制成薄膜用于分离Cs+的可能性。
纳米分离膜的应用研究多集中在常规离子的分离,在放射性核素分离方面的报道较少。Williams等[79]采用分子动力学模拟研究了GO 堆集膜对水中的去除行为,结果表明:GO堆集膜能够高效去除水体中的。普通阴离子进入GO膜毛细管会发生自由能增大的现象,而的情况相反。在进入高度为0.68nm GO 片层,和的自由能分别为-6.3kJ/mol 和+22.4kJ/mol,说明前者的水化性质较弱。模拟发现,当GO 片层高度为0.48nm 时,和的自由能差值最大,此时GO 膜对具有最高的选择性。Wen 等[80]将含有交联剂聚乙烯亚胺(PEI)的钛酸钠纳米带(TNB)(宽度21~80nm)分散液在微滤膜上过滤,通过层层自组装的方式形成自支撑TNB 膜,并用于放射性核素90Sr2+和137Cs+的去除。静态吸附实验表明,在初始浓度为1.5mmol/L,接触时间为30min 时,TNB 膜对90Sr2+和137Cs+的吸附量可达101.4mg/g 和90.3mg/g。当吸附平衡时,TNB膜对90Sr2+和137Cs+的去除率分别是97.6%和57.5%。TNB 膜可通过HCl浸泡实现再生,且再生实验表明TNB 膜的吸附性能基本保持不变。然而,研究者没有考察其在连续过滤条件下对放射性核素的去除情况。
自支撑纳米分离膜的稳定性较差,限制了其使用范围,在水处理方面的应用主要集中在模拟研究和验证性试验。因此,制备稳定的自支撑纳米分离膜成为其处理放射性废水的首要任务。
3.2 纳米材料改性复合膜
纳米材料改性复合膜是指采用过滤、层层自组装等方式将纳米材料以共价键或者静电作用等方式结合到支撑层表面而形成的复合膜。纳米材料对传统分离膜的改性能够增强分离膜的分离性能、耐污染性、化学稳定性等。
Fang 等[49]将氨化GO 过滤沉积在聚偏氟乙烯(PVDF)微滤膜表面制成GO-NH2/PVDF 复合膜,并在死端流条件下测定Co2+的去除效果。当Co2+初始浓度为30mg/L时,随着GO膜厚从0.2mm增加到1.2mm,该膜对Co2+的截留率从68%增至94%。Wu 等[50]采用类似的方法制备了具有多孔结构的GO-SO3H/PVDF复合膜,在死端流条件下处理浓度为2mg/L 的Cd2+溶液,随着GO 膜厚从30μm 增至180μm,该膜对Cd2+的截留率从32%增至96%。Zhang 等[81]利用乙二胺和超支化聚乙烯亚胺(HPEI)对氧化石墨烯进行双面改性,通过过滤法在聚碳酸酯(PC)膜表面制备了GO/PC 复合膜。在死端流条件下处理浓度为1000mg/L的模拟废水,复合膜对Pb2+的去除率可达95.7%。此外,该团队还验证了纳米材料改性中空纤维膜的可行性,他们通过层层自组装将GO 沉积在聚酰胺-酰亚胺(PAI)中空纤维膜表面,所得复合膜对Pb2+的去除率高于95%[82]。Ding 等[83]以PVDF 微滤膜为支撑,将SiO2纳米颗粒固定于膜表面,再将CuFC 负载于SiO2纳米颗粒和膜表面,制备成CuFC/SiO2/PVDF复合膜。该膜对Cs+的截留率可达99.9%。上述复合膜的离子去除能力主要源于纳米材料的吸附特性,其中,纳米材料作为主要分离层,提供离子吸附位点,而PVDF膜、PC膜和PAI膜作为底膜,主要起机械支撑作用。虽然纳米材料赋予微滤底膜去除离子的能力,但两者间作用力较弱,复合膜仅能在死端流条件下处理模拟低放废水。而且,此类纳米复合膜存在离子穿透现象,一旦纳米材料吸附饱和,复合膜就会丧失离子去除能力。因此,此类纳米复合膜主要为纳米材料吸附溶液中离子提供接触场所,膜自身的分离特性未被充分利用。
在本文作者团队的一项研究中[84],MWNTs 与GO 经化学交联后通过过滤法在聚丙烯腈(PAN)膜表面沉积,制备成稳定的MWNTs/GO/PAN 膜,具有良好的纳滤分离特性。与前述报道不同,该复合膜的MWNTs/GO 层非常稳定,能够在错流条件下实现对放射性核素离子的选择性截留。在处理经乙二胺四乙酸(EDTA)螯合的模拟低放含锶废水([Na+]=1.71mmol/L,[Ca2+]=1.33mmol/L,[Mg2+]=0.49mmol/L,[Sr2+]=0.047mmol/L)时,该复合膜对经Sr2+的截留率可达93.4%,成功实现Na+/Sr2+的有效分离。该膜的分离机理主要是MWNTs/GO 间纳米孔的筛分作用以及MWNTs/GO 与Sr-EDTA 螯合物间的电荷排斥作用。因此,该复合膜不存在离子穿透现象。此外,该膜的透水很好,纯水通量可达211L/(m2·h·MPa),远高于商业化纳滤膜,在放射性废水处理中表现出广阔的应用前景。
3.3 纳米杂化复合膜
纳米杂化复合膜是指在分离膜制备过程中将纳米材料作为一种添加剂掺杂入聚合物溶液中形成混合基质膜。MWNTs/聚砜(PSF)超滤膜[85]、iGO/PSF超滤膜[86]、MWNTs/聚酰胺(PA)反渗透膜[87]、GO/PA反渗透膜[88]等研究表明,纳米材料能够从多方面改善传统分离膜的性能:①增加分离膜的调控维度,有利于分离膜的精细设计;②具有丰富的纳米孔可充当分子通道,能改善分离膜的渗透性;③携带有大量活性基团,可增加分离膜的表面亲水性和耐污染性;④机械强度比较高,具有一定的耐压、耐高温等特性,可以增强膜材料的机械稳定性、化学稳定性等。因此,纳米杂化复合膜同时具备纳米材料和传统膜材料的部分性质,更易满足放射性废水处理的使用需求。
纳米杂化复合膜的应用多集中于传统水处理,在放射性废水处理方面的报道也逐渐增多。Choi等[89-90]通过过滤的方式将纳米金(直径13nm)和纳米银(直径30nm) 嵌入醋酸纤维素膜(孔径0.22μm)内形成纳米复合膜,并将此膜用于去除水体中的125I-。实验表明,两种复合膜对125I-的饱和吸附量可达1.5mg/g和31mg/g,且对125I-的去除具有很高的选择性,基本不受Cl-的影响。Mukherjee等[91]将GO混入PSF铸膜液中(0.2%),制备成纳米杂化超滤膜。当操作压力为414kPa,初始离子浓度为50mg/L,该膜在1h内对Pb2+、Cu2+、Cd2+、Cr6+的去除率保持在90%~96%。复合膜在酸处理再生后通量恢复率可达90%,但截留率会明显降低。与大多数纳米材料改性复合膜类似,纳米杂化复合膜存在离子穿透现象,其离子去除能力主要源于纳米材料的吸附特性。不同之处在于,纳米材料被包裹于基膜内部,复合膜的稳定性得以改善,可在错流条件下处理放射性废水。纳米材料对放射性核素的膜分离特性对比如表5。
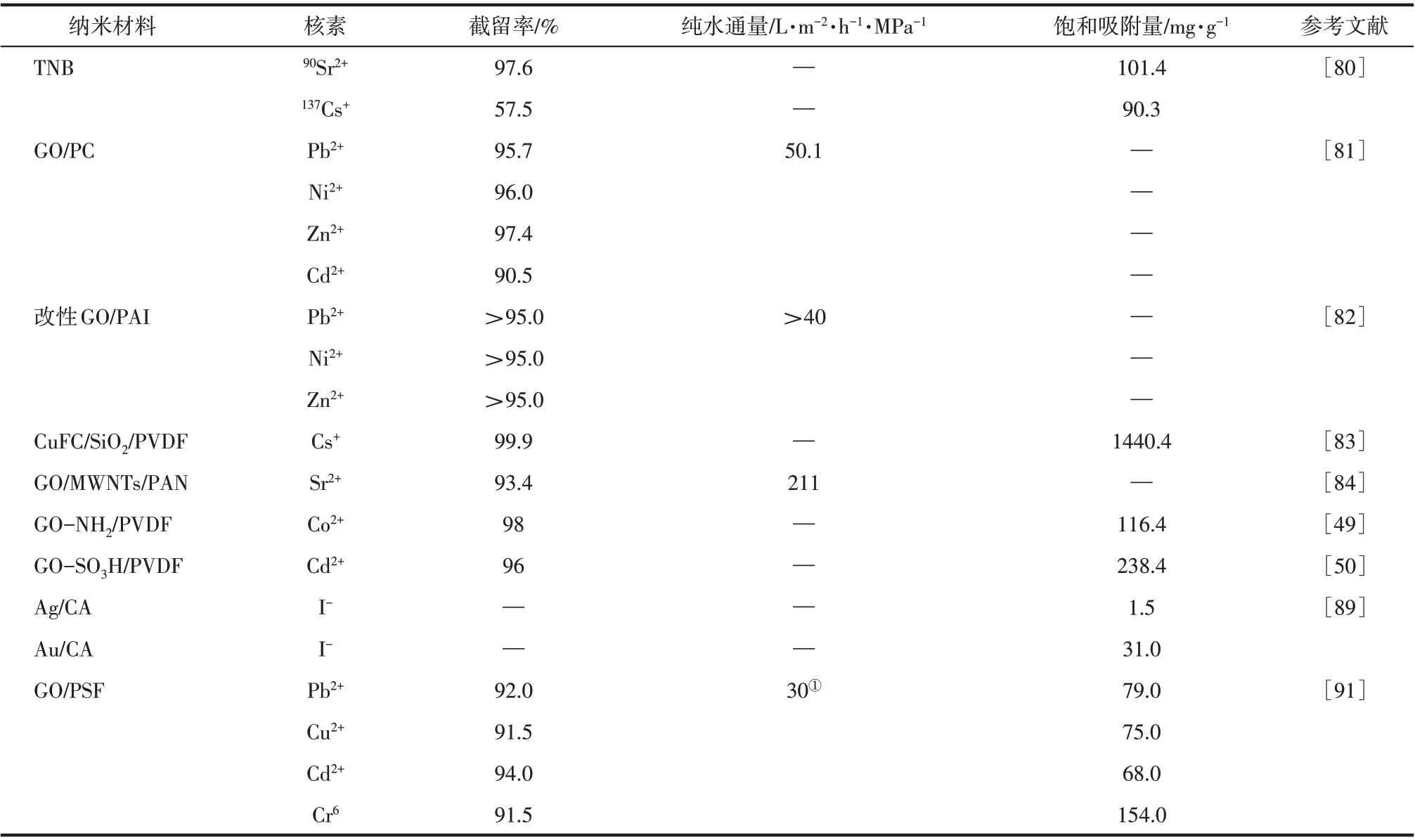
表5 纳米材料对放射性核素的膜分离特性对比
4 结语
纳米材料是传统吸附材料和膜材料的重要补充,在放射性废水处理中表现出良好的发展潜力。其中,选择适宜的纳米材料对高效处理放射性废水至关重要。对于吸附法处理放射性废水,纳米材料的选择依据包括:①纳米材料的活性基团含量和改性难易程度,包括羟基、羰基、氨基等。②吸附性能,主要包括吸附容量、特异性等。③适用环境,纳米材料吸附放射性核素受多种因素影响,如温度、pH、氧化还原条件以及与放射性核素形成络合物的无机或有机配体的浓度等。对于膜分离法处理放射性废水,纳米材料的选择依据如下:①纳米材料的活性基团含量和改性难易程度。活性基团越多,越有利于纳米材料与放射性核素和底膜材料发生反应,复合膜越稳定;②纳米材料所带电荷情况,主要包括电荷的性质、密度和分布;③纳米材料与底膜材料的相容性。相容性越高,越有利于纳米材料在复合膜中的均匀分布和纳米材料性质的充分表现。
纳米材料处理放射性废水还存在着许多问题需要研究。例如,目前的文献报道多集中在纳米材料的设计和制备以及对放射性核素吸附性能和机理研究,对实际应用研究尚少;吸附研究多采用序批试验,连续性较差;纳米材料对放射性核素的膜分离研究较少;试验多采用普通核素代替放射核素,缺乏辐射对纳米材料自身结构稳定性的影响研究等。因此,今后纳米材料的开发和放射废水处理应用可考虑如下几个方面。
(1)重视纳米材料在放射性废水处理中实际应用研究。目前与纳米材料有关的研究多为实验室试验,吸附和再生次数有限,操作时间比较短,试验研究与实际应用还有很大差距。另外,纳米材料与膜技术结合在水处理领域已取得不少突破,特别是纳米复合膜已实现商业化,建议加大纳米复合膜处理放射性废水中的应用研究。
(2)纳米材料的生物安全性是一个敏感话题,纳米材料的各种效应与放射性核素的辐射叠加,可能产生更加复杂的安全问题,值得引起重视。
(3)纳米材料通过任何方式与其他功能材料结合,脱落和流失难以避免,可能成为水环境污染的新因素。目前的研究基本都忽视此问题,尚未通过实验手段测定纳米复合材料的稳定程度。
(4)纳米材料处理放射性废水涉及到的纳米材料和放射性核素种类众多、实验条件千差万别、研究应用目的各异,缺乏统一的实验设计规范,难以对已报道数据开展深入对比分析。因此,制定适用于纳米材料处理放射性废水的指导性实验设计规范对提高实验研究效率具有重要的现实意义。
