纳米颗粒在岩石表面吸附—脱附规律研究
2020-04-01姜阿姣宋兆杰程婷婷侯吉瑞翟浩雅尚丹森李玉珍赵闯
姜阿姣 ,宋兆杰 *,程婷婷 *,侯吉瑞 ,翟浩雅 ,尚丹森 ,李玉珍 ,赵闯
1 中国石油大学(北京)非常规油气科学技术研究院,北京 102249 2 中国石油三次采油重点实验室低渗透油田提高采收率应用基础理论研究室,北京 102249 3 温室气体封存与石油开采利用北京市重点实验室,北京 102249
低渗透油田的勘探和开发已经成为全球关注的重点[1],而常规驱油技术通常存在注入压力高,效果差[2-3]等问题,导致地层能量无法得到有效补充,采油速度低(一般为0.7%左右[4],远低于高渗透油藏),初始产量递减率高,油井很快达到经济极限,最终造成地层储量动用程度偏低。因此,探索有效改善低渗透油藏采收率的方法成为研究热点。纳米颗粒具有比表面积大、表面活性高、尺寸小等特点,由其改性后制备的驱油剂可通过降低油水界面张力、乳化原油、润湿反转和楔形渗透等作用[5-6],有效提高原油产量,能够实现全油藏波及[7]。但是,纳米颗粒在驱油过程中会在岩石表面发生吸附,造成其在油藏中的损耗,不仅带来直接的经济损失,也对驱替效果造成影响。因此,研究纳米颗粒在岩石颗粒表面的吸附规律具有较为重要的意义[8]。
在油藏开发过程中,驱油剂在多孔介质中运移时涉及到多个界面,如固液界面(多孔介质与驱油剂)、液液界面(驱油剂与水、驱油剂与油)。其中,纳米颗粒在岩石的吸附现象属于固液界面[1]的吸附作用。固液界面的吸附涉及吸附剂、溶质、溶剂及各种外界因素的复杂关系,液相吸附时各组分间的竞争作用是不可避免的,是溶质—溶质、溶剂—溶剂、溶质—溶剂、溶质—吸附剂、溶剂—吸附剂间的综合结果。虽然固体自溶液中的吸附很早就有实际应用,并且有大量的吸附研究结果,但由于溶液成分复杂使得液相吸附的理论大多套用气体吸附的成果[10]。探索液相吸附机制,寻求具有较普遍意义的吸附等温式以指导实际应用,仍是当前液相吸附研究的主要内容。
本文实验利用亲水性、疏水性纳米颗粒溶液与石英砂、露头砂开展吸附—脱附实验,通过测定溶液浓度的变化值,计算纳米颗粒在固体表面的吸附量,考察纳米颗粒在岩石颗粒表面的吸附—脱附规律。
1 实验材料及方法
1.1 实验材料
实验仪器:旋转式恒温振动器(DSHZ-300A,江苏太仓市实验设备厂)、双光束扫描型紫外/可见分光光度计(G-9/MG-9PC,南京菲勒仪器有限公司)、台式高速离心机(H1650,湖南湘仪实验室仪器开发有限公司)、电子天平(1 mg)(BSA224S、赛多利斯科学仪器有限公司)、蓝盖瓶等。
实验试剂及岩心:本研究团队自主合成单分散亲水性纳米SiO2颗粒(粒径约50 nm)、单分散疏水性 纳 米SiO2颗粒(粒 径 约50 nm)、蒸馏水(25 °C,1.82×105Ω·m)。60~80目石英砂,四川侏罗系沙溪庙组致密砂岩露头岩心砸碎制成的露头砂。
1.2 实验方法与步骤
固体岩石处理方法:分别将石英砂和露头砂用蒸馏水清洗三遍,并用铬酸进行浸泡,24 h后取出清洗并干燥备用。
静态吸附—脱附实验采用密封振荡平衡法:将预处理过的岩石颗粒和纳米颗粒按固液比为1:10加入到洁净、干燥的蓝盖瓶中,密封后在50 ℃恒温条件下进行持续振荡,震荡速率为100 r/min。在震荡4 h、6 h、8 h、10 h、14 h、18 h、20 h、24 h、30 h、40 h、55 h、60 h、67 h、72 h、76 h、85 h、95 h、105 h时,用吸管分别取溶液至离心管中进行离心(5000 r/min,10 min),取出离心后的上层溶液进行纳米颗粒浓度测试,表征纳米颗粒在岩石表面的吸附—脱附规律。
紫外分光光度法[2-3]:根据物质在特定波长下对光形成的吸收光谱的不同,利用Lambert-Beer定律(即:物质在一定浓度的吸光度与其吸收介质的波长成正比)来鉴定或检测该物质的含量(浓度)。
在计算稀溶液的吸附量时,一般忽略因溶剂(水)吸附而导致的溶液浓度变化,即认为溶液浓度的变化完全是因为溶质(纳米颗粒)吸附所造成的。因此,可利用吸附前后纳米颗粒溶液浓度差值与固体(石英砂或露头砂)的加入量,计算纳米颗粒的静态吸附量,见公式(1)。
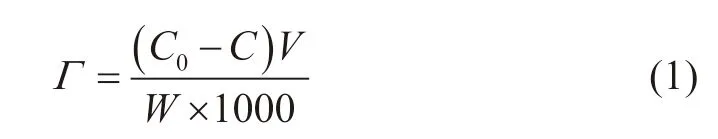
式中:C0、C——分别为纳米颗粒初始浓度和吸附一定时间后的样品浓度,mg/L;V—— 加入纳米颗粒溶液的体积,ml;W—— 加入石英砂或露头砂的质量,g;Γ—— 为纳米颗粒吸附量,mg/g。
1.3 实验方案
本文实验方案如表1所示。
通过对比实验1~5,分别研究不同浓度、不同类型的纳米颗粒在石英砂表面吸附规律;通过对比实验4、6,研究纳米颗粒在不同砂体表面的吸附规律以及在露头砂表面的脱附规律。
2 实验结果及分析
2.1 纳米颗粒浓度标准曲线
利用分光光度计对亲水性和疏水性纳米颗粒进行波长扫描,其中亲水性纳米颗粒的最大吸收峰位置在208 nm处,疏水性纳米颗粒的最大吸收峰位置在234 nm处。在特征波长下,以去离子水作为参比溶液,以10 ppm、20 ppm、30 ppm、40 ppm、50 ppm五个浓度的纳米颗粒溶液作为基准样品,利用分光光度计测量已知浓度的吸光值,并绘制吸光值—纳米颗粒浓度的标准曲线。亲水性纳米颗粒标准曲线方程为A1=0.001 17C1,拟合系数R2=0.9989;疏水性纳米颗粒标准曲线方程为A2=0.000 69C2,拟合系数R2=0.9992(其中A为物质的吸光度,C为吸光物质的浓度)。两条标准曲线的拟合程度好,可用于计算吸附后的溶液纳米颗粒浓度。
2.2 浓度对静态吸附量的影响
实验温度50 ℃,分别测定质量浓度分别为0.1%、0.2%的亲水性及疏水性纳米颗粒溶液在石英砂固体表面的静态吸附量。将四组实验结果进行对比分析,结果如图1所示。
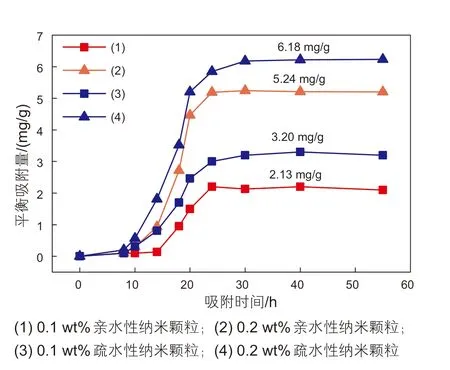
图1 不同浓度纳米颗粒在石英砂表面的吸附曲线图Fig. 1 Adsorption curves of different concentrations of nanoparticles on quartz sand surface

表1 纳米颗粒吸附—脱附实验方案Table 1 Experimental scheme of adsorption and desorption behavior of nanoparticles
实验测定了不同浓度的亲水性和疏水性纳米颗粒在石英砂固体表面的吸附量变化曲线。实验结果表明,在吸附时间小于30 h时,纳米颗粒在石英砂表面的吸附量随着吸附时间的增加逐渐增大;在超过30 h后,吸附量达到最大值,此时纳米颗粒在岩石表面的吸附达到吸附平衡。整个吸附过程可以分为三个部分:①纳米颗粒从溶液中扩散到固体表面的薄液层中,这个过程速度较快,主要由颗粒的外表面积以及颗粒在溶液中和在石英砂表面附近的浓度差决定的;②纳米颗粒在石英砂表面的细孔内扩散,与此同时已经吸附在石英砂表面的纳米颗粒在不离开固体表面的情况下转移到相邻的吸附位上,这个过程速度较慢,主要取决于石英砂的孔隙率、平均孔径等物性参数以及石英砂表面的吸附量梯度[13];③纳米颗粒吸附在细孔内的吸附位上,这个过程吸附速度很快,可以认为在细孔表面的各个吸附位上纳米颗粒的吸附量达到平衡。
本文研究的纳米颗粒在石英砂表面的吸附结果与C. H. Giles等[16]研究结果一致。研究表明,由于石英砂自身带有负电荷,纳米颗粒表面也带有负电荷,当纳米颗粒扩散到带石英砂表面时,一方面纳米颗粒通过静电作用吸附在石英砂表面的正电荷吸附位上,另一方面,由于亲水性纳米颗粒含有大量的亲水基团,会在石英砂表面产生强烈的氢键作用,从而导致亲水性纳米颗粒吸附在石英砂表面;而疏水性纳米颗粒的疏水基团朝向水相,形成吸附层。因此,纳米颗粒在石英砂表面发生吸附主要是由于静电作用、氢键和疏水作用。
利用上述实验方法,测试不同类型的纳米颗粒溶液在石英砂表面的平衡吸附量,绘制吸附等温线,实验结果如图2所示。
根据前人的研究表明[13],决定静态吸附性能的因素有两个:一个是吸附位数,相当于单位质量固体上的吸附容量,另一个是各个吸附位所具有的吸附力,即吸附位与吸附质之间亲和力的大小。由图2可知,在同一平衡浓度下,疏水性纳米颗粒比亲水性纳米颗粒的吸附量高。这是因为亲水性纳米颗粒中存在大量的亲水基团-OH,导致其与水分子之间的亲和力大于疏水性纳米颗粒与水分子之间的亲和力。纳米颗粒在溶液中的吸附过程类似于纳米颗粒从水溶液中析出,然后转移到石英砂表面的过程。所以,纳米颗粒在水溶液中越能够稳定存在,就越难从水溶液中析出,也就难吸附到石英砂表面。因此,在同样的实验条件下,疏水性纳米颗粒与水溶液之间的亲和力较小,越容易吸附到石英砂表面,平衡吸附量相对于亲水性的纳米颗粒也就越大。
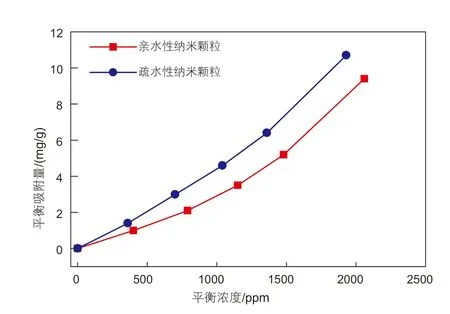
图2 不同类型纳米颗粒在石英砂表面的吸附等温曲线Fig. 2 Adsorption isothermal curves of different types of nanoparticles on quartz sand surface
另一方面,图2中的两条曲线均朝下凸,属于“S”型曲线[14]:等温线的起始斜率小,随着平衡浓度的增大,等温线有一较快升高的区域,这是由于被吸附分子(固体)对液相中溶质分子(纳米颗粒)吸引所造成的。这类“S”型等温吸附线主要有两个特点:①在低浓度时,石英砂表面吸附的纳米颗粒越多,溶液中的纳米颗粒就越容易被吸附,这表明固体表面的纳米颗粒单体促进了吸附;②溶剂(水)有强烈的竞争吸附能力,吸附层的纳米颗粒单体通常以单一端基垂直或近似垂直地分布。
纳米颗粒在石英砂表面表现出物理吸附的特点:van der Waals力吸附、吸附速度快,一般无选择性。为了更加了解纳米颗粒在石英砂表面的吸附状态,采用Freundlich吸附等温线模型对纳米颗粒在石英砂表面的吸附进行拟合[17-19]。
Freundlich等温吸附模型是由Langmuir理论推导出来,而Langmuir模型是基于一定的假设[15]提出的,它忽略了吸附分子之间的相互作用能,并假定固体表面是完全均一的,这些显然是不符合事实。Freundlich吸附式是纯经验式,认为固体表面存在不同能量的吸附位。Freundlich等温模型通常采用(2)式进行拟合,其中,KF、1/n为吸附常数。吸附等温线的形状与n值有关,当n<1,吸附等温线向下凸。有人解释KF和n的物理意义[21]:1/n与吸附剂-吸附质(固体-纳米颗粒)之间的亲和力有关,KF与亲和力和吸附量有关。

式中:q——单位吸附剂质量的吸附量;
KF——吸附平衡常数;
C——溶质的平衡浓度。
纳米颗粒的Freundlich等温吸附曲线拟合结果如图3所示。
通过拟合计算发现,亲水性、疏水性纳米颗粒的吸附等温线与Freundlich吸附模型重合度较高。拟合后的两条曲线的公式中的n均小于1,证明纳米颗粒的吸附等温线向下凸,确实符合图2的结果。实际上,对于亲水性纳米颗粒在石英砂表面吸附和疏水性纳米颗粒在其表面吸附,固体表面往往并不严格按照化学计量比与纳米颗粒相结合(即,不是每一个吸附位都能对应相同数量的纳米颗粒单体),即表面各吸附位的表面能不相同,故,石英砂表面是异质性的。
2.3 砂体对纳米颗粒吸附的影响
由于固体表面的物理化学性质会影响纳米颗粒的吸附量,因此本文对比研究了0.2wt%的亲水性纳米颗粒和疏水性纳米颗粒在露头砂上的静态吸附量。吸附—脱附实验结果如图4所示。
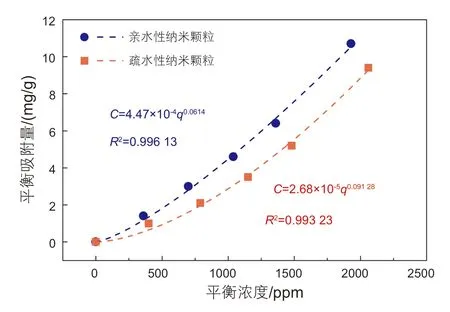
图3 Freundlich等温模型拟合曲线图Fig. 3 Fitting curve using Freundlich isothermal model
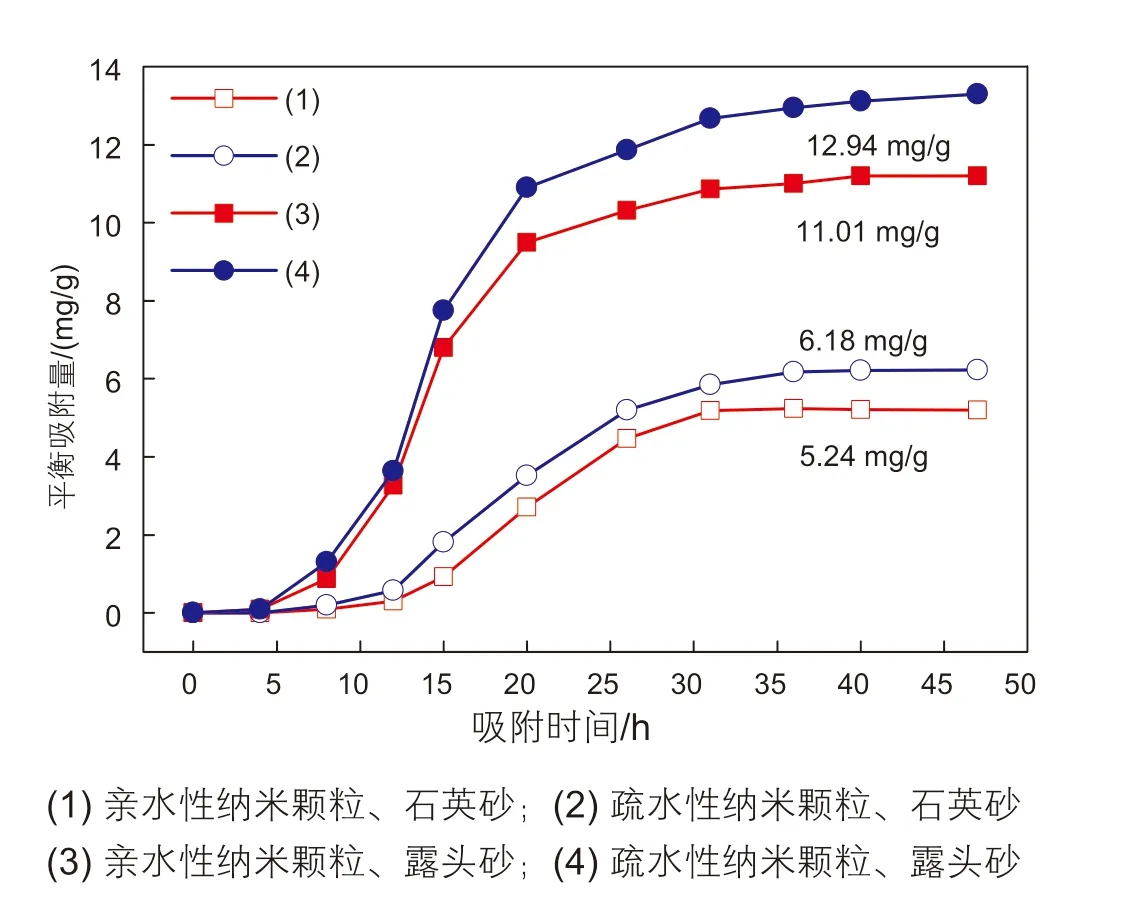
图4 不同类型纳米颗粒在不同砂体表面吸附曲线Fig. 4 Adsorption curves of different types of nanoparticles on different sands

表2 露头砂矿物含量表Table 2 Mineral content of outcrop sand
结合图4可以看出,纳米颗粒在露头砂表面的吸附曲线与石英砂表面的吸附曲线具有共同特征,分为三个阶段:吸附初期(0~15 h),吸附量上升较快,曲线趋势很陡。当吸附时间超过20 h以后,吸附量随时间变化开始缓慢增加;当超过40 h后,吸附量不再随着时间的变化而变化,此阶段也可称为吸附饱和阶段-吸附平衡。这种吸附趋势的原因是,在初期阶段由于石英砂表面有很多空缺的吸附位点,颗粒分子很容易能够扩散进入,导致吸附量快速增大,随着吸附时间的延长,石英砂表面空缺的吸附位点在减少,且已经吸附在表面的颗粒之间也存在相互排斥力,使得此时溶液中的颗粒占据表面吸附位点变得更加困难[22-23],导致吸附量随之减少直至达到平衡。
根据吸附平衡后的吸附量表明,亲水性、疏水性纳米颗粒在露头砂表面的吸附量分别是12.94 mg/g砂、11.01 mg/g砂,其值均大于在石英砂表面的吸附量5.24 mg/g砂、6.18 mg/g砂。为了分析纳米颗粒在不同固体表面吸附量差异的原因,对露头砂进行矿物含量分析,结果如表2所示。
如表2所示,是由于露头砂存在0.5%的长石,以及6%的黏土矿物,导致纳米颗粒在露头砂表面的平衡吸附量大于石英砂表面。黏土矿物根据吸附能力可分为有吸附活性(以蒙脱石为代表)的和无吸附活性(以高岭石为代表)两大类,因此,在众多黏土矿物中高岭石和蒙脱石最为重要。实验所采用的露头砂中黏土矿物分析结果如表3所示。
黏土矿物中高岭石为1:1型层状硅酸盐,其晶层间依靠氢键连接,形成层层堆积,也无可交换的阳离子,吸附能力小。蒙脱石属2:1型三层结构的黏土矿物,晶层之间由氧原子层和氧原子层构成,没有氢键,水和其他极性分子可进入晶层之间,可进行离子交换。一般来说,黏土的阳离子交换容量越大,其吸附能力就越强[24]。而蛭石是一种与蒙脱石相似的黏土矿物,具有良好的吸水性、膨胀性以及阳离子交换性,故蛭石也是有吸附能力的黏土矿物。实验所采用露头砂的黏土矿物中无蒙脱石含量,有38%的高岭石以及25%的蛭石,还有28%的混层(混层属于中间产物),因此,本实验中对比纳米颗粒在石英砂表面的吸附量,其在露头砂表面的吸附量有一部分是由于黏土矿物中蛭石以及混层的存在。

表3 露头砂中黏土矿物含量表Table 3 Clay mineral content of outcrop sand
2.4 纳米颗粒在固体表面脱附规律
本文分别测定浓度为0.2wt%的亲水性纳米颗粒和疏水性纳米颗粒在露头砂上的脱附实验(实验条件与吸附实验相同),其吸附/脱附量随时间的变化曲线如图5所示。
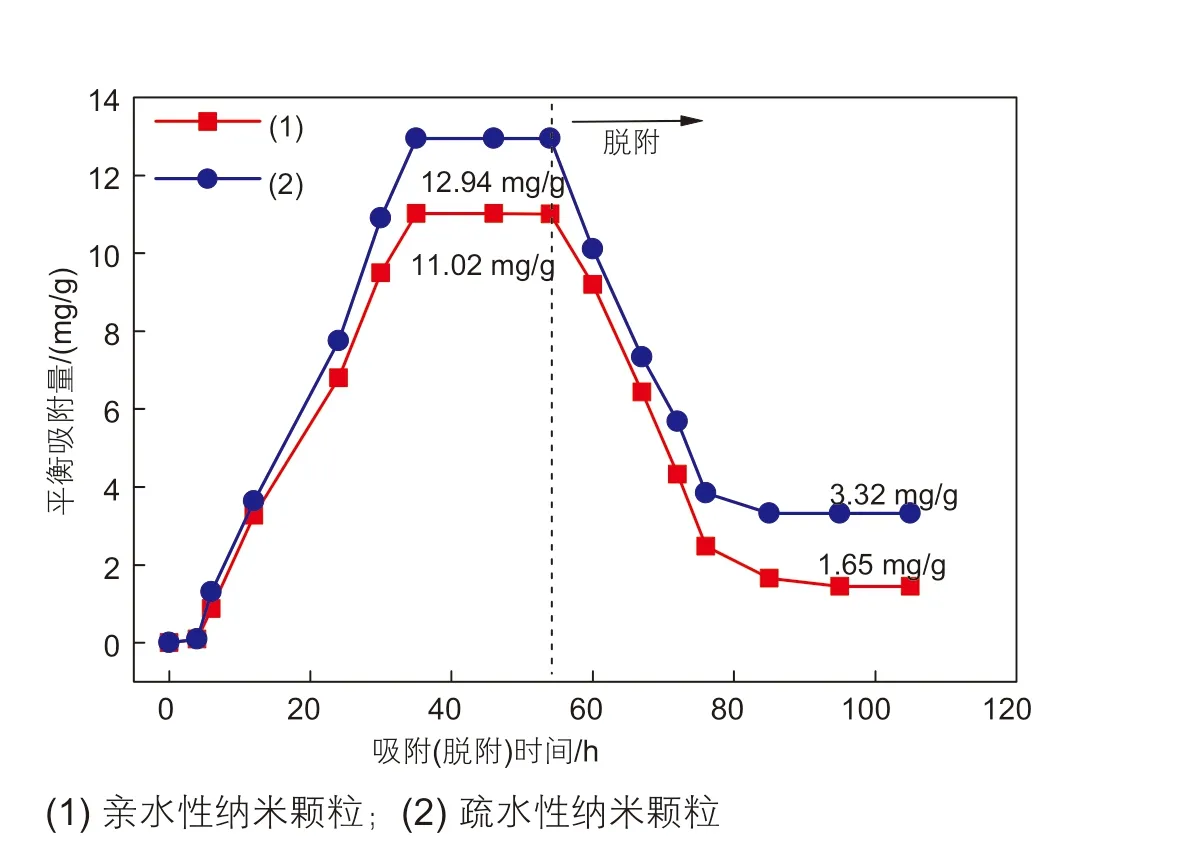
图5 不同类型纳米颗粒在露头砂表面吸附-脱附曲线图Fig. 5 Adsorption-desorption curves of different types of nanoparticles on outcrop sand surface

图6 疏水性纳米颗粒吸附—脱附前后电镜图对比Fig. 6 SEM images of adsorption and desorption of hydrophobic nanoparticles on outcrop sand
由图5可知,脱附初期,纳米颗粒能够快速从露头砂表面脱离,随后脱离速率逐渐变缓,最终达到脱附平衡。同时发现,脱附达到平衡后,疏水性纳米颗粒在露头砂表面吸附平衡时的吸附量大于亲水性纳米颗粒。同时,利用扫描电子显微镜(SEM)对两种纳米颗粒在露头砂表面吸附前后的状态进行观察(如图6、图7所示),发现脱附后纳米颗粒在露头砂表面的吸附量明显减小。露头砂表面往往存在含氢原子的极性官能团,如羟基、羧基等,其与纳米颗粒表面基团中的氢原子相互作用形成氢键,而氢键的强度是范德华力的5~10倍,通过氢键吸附的分子在室温很难脱附,需要在100~150 ℃真空除气才能脱附,对含有微孔的多空介质,脱附温度更高。故这部分最终脱附平衡的吸附量主要是由于氢键作用吸附在露头砂表面的。由于亲水性纳米颗粒在吸附过程中与水的亲和力较大,使得亲水性纳米颗粒相比于疏水性纳米颗粒更难吸附到砂体表面,故在发生脱附后,其表面的残余量更少,即最终测得的纳米颗粒的吸附量要明显小于疏水性纳米颗粒。

图7 亲水性纳米颗粒吸附—脱附前后电镜图对比Fig. 7 SEM images of adsorption and desorption of hydrophilic nanoparticles on outcrop sand
3 结论
(1)亲水性、疏水性SiO2纳米颗粒在石英砂表面的吸附分为三个阶段:吸附初期(0~15 h),吸附量上升较快;吸附中期(15~25 h),吸附量逐渐变缓;吸附末期(30~40 h),吸附量达到饱和。疏水性SiO2纳米颗粒的吸附量大于亲水性SiO2纳米颗粒;
(2)亲水性、疏水性SiO2纳米颗粒在石英砂表面是以物理吸附为主,且为单层吸附,其吸附等温线符合“S”型等温线特点,与Freundlich吸附等温式拟合程度较高;
(3)由于黏土矿物的存在,亲水性、疏水性SiO2纳米颗粒在露头砂表面的吸附量均比石英砂表面的吸附量大;
(4)脱附实验中,由于氢键作用,露头砂表面仍滞留有纳米颗粒,且疏水性SiO2纳米颗粒比亲水性SiO2纳米颗粒的最终吸附量大。
