大孔吸附树脂分离纯化牛蒡叶绿原酸的工艺研究
2020-03-31袁晓庆李莉刘言娟王振
袁晓庆 李莉 刘言娟 王振

摘要[目的]建立大孔吸附樹脂分离纯化牛蒡叶中绿原酸的工艺。[方法]通过单因素试验研究提取液种类、浓度、pH、提取温度、料液比以及提取时间等参数对绿原酸提取率的影响,确定最佳提取工艺;以大孔吸附树脂对牛蒡叶中绿原酸的分离效率为评价指标,通过静态和动态吸附/解吸附试验优化分离纯化工艺。[结果]pH=1的蒸馏水为提取溶剂,料液比1∶20(g∶mL)、提取温度80 ℃、回流1 h时对牛蒡叶中绿原酸的提取效果最佳,平均提取率为1.82%;考察了6种大孔吸附树脂对牛蒡叶绿原酸的分离纯化性能,以吸附/解吸附性能为评价指标,确定了LX-218为最佳大孔吸附树脂。LX-218型MAR分离纯化牛蒡叶绿原酸的最佳工艺条件为:上样量为30 BV(树脂床体积),上样浓度为0.7倍提取原液浓度(相当于原生药),上样液pH=3,以4 BV/h流速吸附,5 BV pH=5的60%乙醇以5 BV/h的流速解吸附。在优化的工艺条件下,牛蒡叶绿原酸得率为84.41%,纯度为55.26%。[结论]LX-218型大孔吸附树脂对牛蒡叶绿原酸有较好的吸附容量和解吸附率,优化的生产工艺条件适用于牛蒡叶绿原酸的工业化生产。
关键词牛蒡叶;大孔吸附树脂;绿原酸;分离纯化;工艺优化
中图分类号R284.2文献标识码A
文章编号0517-6611(2020)04-0168-07
doi:10.3969/j.issn.0517-6611.2020.04.049
开放科学(资源服务)标识码(OSID):
Study on the Technology of Separation and Purification of Chlorogenic Acid from Burdock Leaves by Macroporous Adsorption Resin
YUAN Xiao-qing,LI Li,LIU Yan-juan et al(Linyi University,Linyi,Shandong 276000)
Abstract[Objective]To establish the optimum technological conditions for the separation and purification of chlorogenic acid from burdock leaves by macroporous adsorption resin(MAR).[Method]The optimum extraction process was obtained by studying the effects of extractant type,concentration,pH,extraction temperature,ratio of solid-liquid ratio and extraction time with single factor experiment.Based on separation efficiency of chlorogenic acid from burdock leaves,the optimal separation and purification processes were obtained by static and dynamic adsorption/desorption experiments.[Result]The optimum extraction process as follows:the extractant was distilled water with pH=1,the ratio of solid-liquid ratio was 1:20(g:mL),the extraction temperature was 80 °C,the reflux time was 1 h.The average extraction rate was 1.82% with the above extraction process.The separation and purification performance of six kinds of macroporous adsorption resins for burdock chlorogenic acid were investigated.Taking adsorption / desorption performance as the evaluation index,LX-218 was determined as the best macroporous adsorption resin.The optimal process conditions on LX-218 MAR for the separation and purification of burdock chlorophyllic acid as follows:the loading amount was 30 BV(resin bed volume),the loading concentration was 0.7 times the concentration of the extracted stock solution(equivalent to raw material),and the loading solution pH=3,adsorption at 4 BV/h flow rate,respectively.For the desorption process,chlorogenic acid loaded MAR column was desorbed by 5 BV ethanol-aqueous solution(60∶40,V∶V) with pH value of 5 at flow rate of 5 BV/h.Under the optimal conditions,the yield of chlorogenic acid from burdock leaves and purity were 84.41% and 55.26%,respectively.[Conclusion]LX-218 macroporous adsorption resin has good adsorption and desorption performance for chlorogenic acid.The optimized technique is suitable for the industrial production of chlorogenic acid from burdock leaves.
Key wordsBurdock leaves;Macroporous adsorption resin;Chlorogenic acid;Separation and purification;Process optimization
牛蒡又名大力子、恶实、牛蒡子,属于菊科类植物,近年来作为保健型蔬菜受到人们的青睐。它全身是宝,其子、根均可入药,富含糖、纤维素、蛋白质、钙、铁等人体所需的多种营养物质和矿物质等[1-2]。我国是牛蒡生产大国,仅临沂市兰陵县的庄坞、层山、二庙等乡镇,种植面积达0.67万hm2以上,县外发展种植基地0.80万hm2以上,年总产量约70万t,占全国牛蒡产量的50%以上。每年会有大约15万t的牛蒡茎叶产生,但是这些牛蒡茎和叶绝大部分被废弃,没有被充分利用起来,这不仅给环境造成了严重污染也浪费了资源,通过MAR分离纯化牛蒡叶提取液中的绿原酸,可获得纯度较高的绿原酸,能很好地实现废物利用[3]。此工艺能够延长牛蒡的产业链,提高其附加值。目前,分离纯化天然产物的方法应用较多的有大孔吸附树脂(macroporous adsorption resin,MAR)柱色谱、硅胶柱色谱、制备液相色谱和逆流色谱等,这些技术方法在有效成分的分离纯化中得到了不同程度的应用。其中MAR技术因具有吸附量大、选择性好、再生容易等优点,在天然产物的分离纯化中有广泛应用。该技术已广泛应用于苷类、黄酮类、皂苷类、生物碱类等多种天然产物的分离与纯化中[4-6]。
绿原酸具有抗肿瘤、降压、抗氧化、提高人体免疫力等多种生物活性,且与同类药物相比,副作用较少。对急性咽喉炎症和皮肤病有明显疗效,临床上用于治疗急性细菌性感染疾病及放化疗时所致的白细胞减少症,对月经过多、子宫功能性出血有良好的止血效果[7-10]。该研究旨在确定牛蒡叶绿原酸的最佳提取工艺,优选出一种适合纯化牛蒡叶绿原酸的MAR,并对优选出的MAR纯化牛蒡叶绿原酸时的各项工艺条件及参数进行研究。
1材料与方法
1.1试验材料
1.1.1仪器。KQ-250DB超声仪(昆山市超声仪器有限公司);SHK-III型循环水式多用真空泵(郑州科泰试验设备有限公司); DHG-9035A型电热恒温鼓风干燥箱(上海一恒科技有限公司);ST-06型300 g多功能粉碎机(永康市帅通工具有限公司);Agilent1260 型高效液相色谱仪(G1329进样器,G1314F检测器,G1311C四元泵,G1316A柱温箱,ChemStation色谱工作站,美国安捷伦公司);SHA-B 多功能水浴恒温振荡器(江苏正基仪器有限公司);BS224S 型电子天平(北京赛多利斯仪器系统有限公司);DF-101集热式磁力搅拌器(巩义市予华仪器有限责任公司);ZD-85A气浴恒温振荡器(常州润华电器有限公司);TC-C18液相色谱柱(250 mm×4.6 mm,5 μm,美国安捷伦公司)。
1.1.2试剂。盐酸(分析纯,天津恒兴化学制剂有限公司);氢氧化钠(分析纯,天津恒兴化学制剂有限公司);醋酸(分析纯,阿拉丁试剂有限公司);乙醇(分析纯,天津永大化学制剂有限公司);甲醇(色谱纯,Tedia Company);碳酸钠(分析纯,天津恒兴化学制剂有限公司);绿原酸(纯度98%,中国食品药品检定研究院);LX-N2、LX-T28、AB-8、D101、LX-26 和LX-218型大孔吸附树脂(西安蓝晓科技新材料股份有限公司)。
1.1.3试材。牛蒡叶采自山东省临沂市兰陵县,经临沂大学药学院刘林教授鉴定为菊科类植物牛蒡Arctium lappa L.的叶。牛蒡叶洗净,于60 ℃烘箱中干燥后,粉碎过60目筛,备用。
1.2试验方法
1.2.1对照品溶液的配制。取绿原酸标准品约2.5 mg,精密称定,置于25 mL容量瓶中,用蒸馏水溶解,稀释并定容至刻度,配制成浓度为100 μg/mL的对照品溶液。
1.2.2供试品溶液的制备。分别取牛蒡叶提取液、过MAR柱的吸附残液和洗脱液各10 mL,分别置于蒸发皿中蒸干,所得残渣用甲醇溶解,分别将其转移至10 mL 容量瓶中,并用甲醇稀释定容至刻度,摇匀,过滤后取续滤液,即得供试品溶液。
1.2.3标准曲线的绘制。高效液相色谱条件:色谱柱为Agilent 5 TC-C18(250 mm×4.6 mm,5 μm);柱温25 ℃;流动相为甲醇(A)+2.5%醋酸(B);梯度洗脱程序为:0~5 min,25%A, 5~17 min,30%A;检测波长326 nm;进样量10 μL;流速1.0 mL/min。
精密吸取“1.2.1”对照品溶液0.5、1.0、2.0、3.0、4.0和5.0 mL,分别置于5 mL 容量瓶中,用蒸馏水稀释并定容至刻度,得一系列绿原酸标准溶液,按上述色谱条件,进样10 μL,测定峰面积,以峰面积(Y)为纵坐標、绿原酸质量浓度(X)为横坐标绘制标准曲线,得出其回归方程为Y=32 176X-97.517(R2=0.999 8),表明绿原酸对照品在10~100 μg/mL与峰面积呈现良好的线性关系。
1.2.4牛蒡叶绿原酸提取方法的优化。
对影响绿原酸提取率的各项参数包括提取溶剂、提取溶剂pH、提取时间、提取温度、料液比等进行考察,试验设计如表1所示。按照“1.2.3”中的方法对牛蒡叶提取物中绿原酸含量进行检测,按照公式(1)计算不同提取条件下牛蒡叶绿原酸的提取率。
提取率=提取液中绿原酸的质量浓度(μg/mL)×提取液的体积(mL)×10-6牛蒡叶粉末质量(g)×100%(1)
1.2.5MAR预处理。该研究考察LX-N2、LX-T28、AB-8、D101、LX-26 和LX-218型MAR对牛蒡叶绿原酸的分离纯化效果。6种MAR的各项理化参数如表2所示。在MAR的制备过程中,大量无机杂质、致孔剂以及高分子单体等物质会掺杂于其表面和空隙中,这些杂质会影响MAR的稳定性、洗脱物质和再生回收液的纯度等。因此在MAR使用前,必须对其进行预处理以除去杂质。预处理MAR的方法为:分别称取6种MAR一定量,分别将其浸泡至95%乙醇中24 h,浸泡完毕,用蒸馏水洗涤各型号MAR至无醇味;用5%的HCl浸泡3 h,然后用蒸馏水洗至中性;5%的NaOH浸泡3 h,用蒸馏水洗至中性[11]。
1.2.6MAR的筛选。
利用静态吸附/解吸附试验对MAR进行筛选。称取预处理好的各型号MAR(相当于干树脂约1.5 g),分别置于250 mL具塞锥形瓶中,分别加入牛蒡提取液100 mL,于25 ℃恒温振荡器中恒温振荡24 h,进行MAR的静态吸附。吸附完成后,根据“1.2.3”中的方法测定原提取液、吸附残液中绿原酸的含量,并根据公式(2)和(3)计算MAR的吸附量及吸附率。将静态吸附后的MAR用80 mL 60%乙醇恒温振荡24 h,进行解吸附,根据“1.2.3”中的方法测定解吸液中绿原酸含量,根据公式(4)和(5)分别计算各型号MAR的解吸附量和解吸附率[12-13]。
Qa=(Co-Cm )×V/W(2)
Ea=(Co-Cm )/Co×100%(3)
Qn=Cr×V/W(4)
Ed=Qn/Qa×100%(5)
式中,Qa为吸附量(mg/g);C0为吸附液起始浓度(mg/mL);Cm为吸附液平衡浓度(mg/mL);V为溶液体积(mL);W为树脂重量(g);Ea为吸附率(%);Cr为解吸液平衡浓度(mg/mL);Qn为解吸附量(mg/g);Ed为解吸附率(%)。
1.2.7MAR分离纯化工艺优化。
对影响MAR分离纯化效果的各项参数包括动态吸附流速、上样液pH、上样液浓度、上样量、解吸液浓度、解吸液pH、解吸液流速和解吸液用量进行考察。按照“1.2.3”中的方法对吸附残液和提取液中的绿原酸含量进行检测,根据公式(2)和(3)计算MAR的吸附量及吸附率。
2结果与分析
2.1提取溶剂对牛蒡叶绿原酸提取率的影响准确称取6份相同质量的牛蒡叶粉末,每份10 g,分别选用蒸馏水、30%、50%、60%、70%和90%乙醇作为提取剂,在温度为80 ℃、料液比1∶14、提取时间3 h的条件下对牛蒡叶进行提取,按照“1.2.3”中的方法对提取液中绿原酸含量进行检测,按照公式(1)计算牛蒡叶绿原酸的提取率。试验结果如图1所示。
由图1可知,在其他条件不变时,以蒸馏水为提取溶剂时牛蒡叶绿原酸的提取率最好,且利用水作为提取溶剂,经济环保,适合工业生产,所以该研究采用水作为提取溶剂进行后续试验。
2.2pH对牛蒡叶绿原酸提取率的影响
准确称取9份相同质量的牛蒡叶粉末,每份10 g,调节提取溶剂pH使其分别为1、2、3、4、5、6、7、8和10。在温度为80 ℃、料液比1∶14、提取时间3 h的条件下对牛蒡叶进行提取,按照“1.2.3”中的方法对绿原酸含量进行检测,按照公式(1)对绿原酸提取率进行计算,试验结果如图2所示。
由图2可知,随着pH的逐渐增大,牛蒡叶绿原酸的提取率逐渐降低。在其他条件不变时,提取液pH=1时绿原酸提取率最好。出现这一规律的原因可能是因为绿原酸的解离常数(pKa)为3.90,有研究报道[14],提取酸性物质时,提取溶剂的pH比目标物的pKa值低1~2时有较好的提取效果。综合以上条件,该研究选取提取液的pH为1进行后续试验。
2.3温度对牛蒡叶绿原酸提取率的影响准确称取5份相同质量的牛蒡叶粉末,每份10 g,用pH=1的蒸馏水为提取溶剂,分别在50、60、70、80、90和100 ℃温度下,在料液比1∶14、提取时间为3 h的條件下对牛蒡叶中的绿原酸进行提取,按照“1.2.3”中的方法对绿原酸含量进行检测,按照公式(1)计算不同提取温度时牛蒡叶绿原酸的提取率,结果如图3所示。
由图3可知,在50~100 ℃随着温度的升高,牛蒡叶绿原酸的提取率先增大后降低,90 ℃时提取率最高,但是80与90 ℃时的提取率相差很小。综合考虑能量消耗和绿原酸的稳定性问题,该研究选取80 ℃进行后续试验。
2.4提取时间对牛蒡叶绿原酸提取率的影响
准确称取5份相同质量的牛蒡叶粉末,每份10 g,以pH=1的蒸馏水为提取溶剂,料液比1∶14,在温度为80 ℃,提取时间分别为0.5、1.0、1.5、2.0、2.5、3.0 h的条件下对牛蒡叶中的绿原酸进行提取,按照“1.2.3”中的方法对绿原酸含量进行检测,按照公式(1)计算不同提取时间下牛蒡叶绿原酸的提取率,结果如图4所示。
由图4可知,在0.5~1.0 h时牛蒡叶绿原酸的提取率随着提取时间的延长而增大,1 h后随着时间的延长,提取率反而有所下降。这可能是由于绿原酸的二酚羟基结构不稳定,长时间加热,使其氧化分解,绿原酸含量降低,所以该研究选用提取时间为1 h进行后续试验。
2.5料液比对牛蒡叶绿原酸提取率的影响
准确称取6份相同质量的牛蒡叶粉末,每份10 g,以pH=1的蒸馏水为提取溶剂,在温度为80 ℃、提取时间1 h,料液比分别为1∶12、1∶14、1∶16、1∶18、1∶20、1∶30、1∶40的条件下对牛蒡叶中的绿原酸进行提取,按照“1.2.3”中的方法对绿原酸含量进行检测,按照公式(1)计算按不同料液比进行提取时牛蒡叶绿原酸的提取率,结果如图5所示。
由图5可知,在其他条件不变时,随着料液比的减小,提取率逐渐增大,但是在料液比1∶20以后,继续增大提取溶剂的量,提取率变化不大,所以该研究采用料液比1∶20进行后续试验。
2.6牛蒡叶绿原酸的最佳提取工艺
综上所述,牛蒡叶绿原酸的最佳提取工艺为提取溶剂为pH=1的蒸馏水,提取温度为80 ℃,提取料液比为1∶20,提取时间为1 h。
2.7最佳MAR的考察
利用静态吸附/解吸附试验对MAR进行筛选。分别考察各型号树脂对牛蒡叶绿原酸的吸附与解吸附性能,根据公式(2)和(3)计算MAR的吸附量及吸附率,根据公式(4)和(5)分别计算各型号MAR的解吸附量和解吸附率,结果如表3所示。
由表3可知,LX-218型MAR的吸附率(Ea)最高,AB-8树脂的解吸附率(Ed)最好,但吸附率比LX-218差。由于解吸液pH对解吸附率有较大影响,因此按照“1.2.6”中的方法考察60%乙醇在不同pH时对LX-218和AB-8这2种树脂上所吸附目标物的解吸附能力。调节60%乙醇解吸液的pH分别为1、3、5和7对LX-218和AB-8 2种树脂上的目标物进行解吸附,结果如表4所示。
由表4可知,解吸液pH对其洗脱能力有较大的影响,60%乙醇在pH为5时,LX-218型MAR对绿原酸解吸附能力最强。此时LX-218型MAR对牛蒡叶绿原酸的解吸附率达92.17%,远高于目标物在AB-8上的解吸附率。综合考虑吸附率与解吸附率,最终选择LX-218型MAR进行后续试验。
2.8MAR分离纯化工艺的优化
2.8.1动态吸附流速的考察。
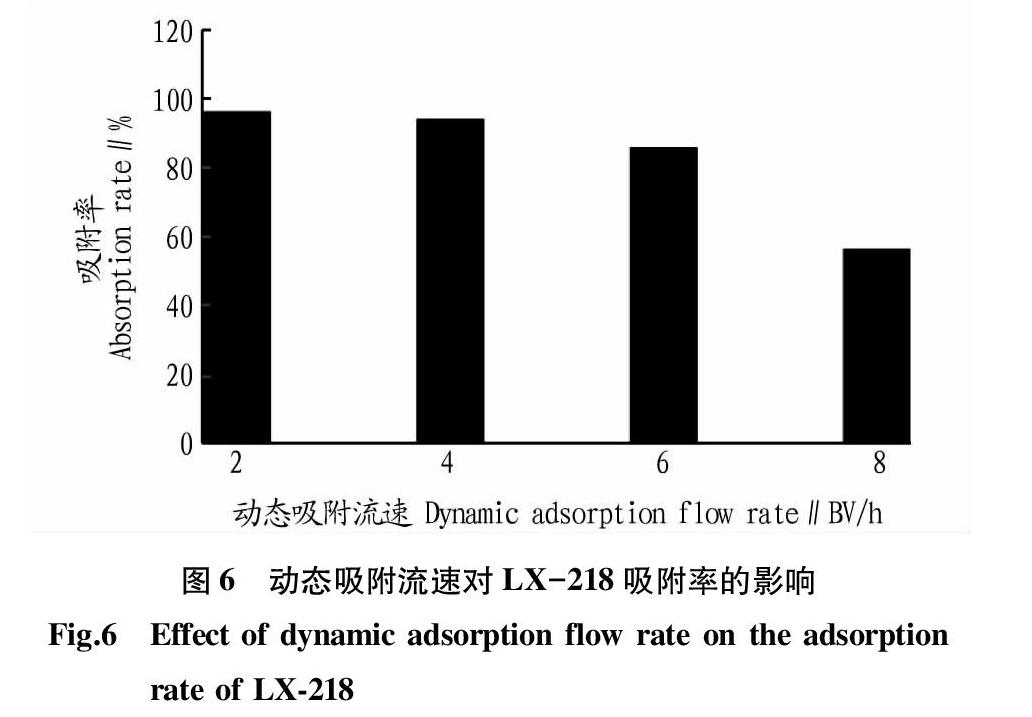
精密量取按“2.6”方法制备的提取液4份,每份20 BV,分别以2、4、6和8 BV/h的流速在规格、径高比等完全相同的MAR柱上进行吸附,收集吸附残液。分别将吸附残液和提取液浓缩,然后于60 ℃真空干燥箱中干燥,用10 mL甲醇复溶,按照“1.2.3”方法对吸附残液和提取液中的绿原酸含量进行检测,计算吸附率,结果如图6所示。
由图6可知,动态吸附流速越小,LX-218树脂对牛蒡叶绿原酸的吸附容量越大。一般来说,动态吸附流速增大对目标物在MAR柱上的吸附容量是不利的。出现这种现象的原因可能是由于流速增加会导致目标物分子没有足够的时间进入MAR的孔道,也没有足够的时间与MAR表面的活性位点发生充分作用。由图6可知,以4 BV/h上样的吸附率与2 BV/h 时没有明显差异,流速大于4 BV/h以后吸附率降低显著,从工业生产角度考虑,流速较低会延长生产周期,不利于生产效率。综合考虑,该研究选择4 BV/h作为最佳吸附流速进行后续试验。
2.8.2上样液pH的考察。
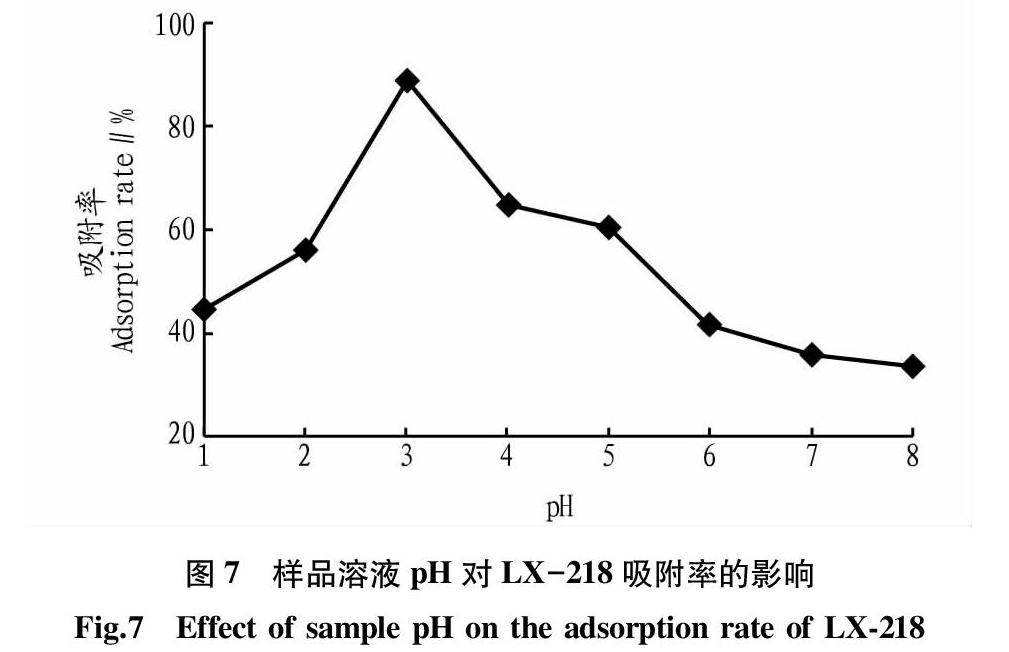
由于绿原酸是酸性物质,因此所处环境的pH对其存在形式有较大的影响,从而影响绿原酸与MAR之间相互作用力的强弱,该研究考察了样品溶液pH对吸附率的影响。精密量取按“2.6”方法制备的提取液8份,每份20 BV,分别将其pH调节为1、2、3、4、5、6、7和8,然后在相同的MAR柱上进行吸附,收集吸附残液。分别将吸附残液和提取液浓缩,然后于60 ℃真空干燥箱中干燥,用10 mL 甲醇复溶,按照“1.2.3”方法对吸附残液和提取液中的绿原酸含量进行检测,计算吸附率,结果如图7所示。
由图7可知,随着样品溶液pH的增大,LX-218型MAR对牛蒡叶绿原酸的吸附率先增大后降低,当上样液pH=3时,MAR对绿原酸的吸附率最高。出现这一现象的原因可能是绿原酸是咖啡酸与奎尼酸酯化得到的,因而既能被酸也能被碱催化水解。在pH为1~3时,绿原酸水溶液水解的一级动力学方程反应常数k值趋小,可推断其反应机制为酸催化的水解反应;在pH为3~8时,反应常数k值趋大,可推断其反应机制为碱催化的水解反应;其水溶液在pH=3时最稳定,因为绿原酸在pH为3时最稳定,以分子形式存在,与MAR活性位点之间的作用力较大,因此在该pH下,LX-218型MAR对牛蒡叶绿原酸有较大的吸附容量,该研究选取3作为样品溶液的最佳pH进行后续试验。
2.8.3上样液浓度的考察。取牛蒡叶提取液20 BV 4份,分别将其稀释至原提取液体积的1.0、0.7、0.5和0.3倍,取上述4种不同浓度的样品溶液20 BV,分别将其pH调节为3,以4 BV/h 的动态吸附流速上样,然后在相同的MAR柱上进行吸附,收集吸附残液。分别将吸附残液和提取液浓缩,然后于60 ℃真空干燥箱中干燥,用10 mL甲醇复溶,按照“1.2.3”方法对吸附残液和提取液中的绿原酸含量进行检测,计算吸附率,结果如图8所示。
由图8可知,随着上样液浓度的减小,树脂对绿原酸的吸附率下降,但原提取液浓度和0.7倍原提取液浓度时,吸附率变化不大,在试验过程中发现,当上样液为原液浓度时,流速会逐渐减慢,可能是因为LX-218树脂的粒径太小,上样液浓度过高,杂质较多造成柱子堵塞,流速减小[15]。考虑上述因素,该试验采用0.7倍原提取液浓度作为上样液浓度。
2.8.4上样量的考察。
调节牛蒡叶提取液pH为3,上样液浓度为0.7倍原液浓度,以4 BV/h的动态吸附流速上样,按照MAR柱床体积收集流出液,流出液经浓缩,60 ℃真空干燥箱中干燥,然后分别用10 mL甲醇复溶,按照“1.2.3”方法對吸附残液中的绿原酸含量进行检测,结果如图9所示。由图9可知,上样量为20 BV时树脂柱开始泄漏,当上样量达30 BV时达到吸附饱和,因此该研究选择30 BV作为最佳上样量进行后续试验[16]。
2.8.5解吸液浓度的考察。
精密量取提取液30 BV,上样液浓度为0.7倍原提取液浓度,调节溶液pH为3,在MAR柱上以4 BV/h的流速上样吸附,收集吸附残液。然后,分别用5 BV 的0、30%、60%和90%乙醇以6 BV/h的流速进行梯度解吸附,收集解吸液。将吸附残液和解吸附液浓缩后于60 ℃真空干燥箱中烘干,10 mL甲醇复溶,按照“1.2.3”方法对吸附残液和解吸液中绿原酸含量进行检测,计算解吸附率,结果如图10所示。
由图10可知,随着乙醇浓度的增大,树脂的解吸附率增大。当乙醇浓度为90% 时,解吸附率最大。但90%乙醇进行解吸附时,解吸液中杂质含量较高,达不到较好的纯化效果。当60%乙醇进行解吸附时,其解吸附率与90%乙醇的解吸附率相差不大,因此,综合经济消耗以及洗脱液纯度问题,该研究选择最佳的解吸液为60%乙醇。
2.8.6解吸液pH的考察。
精密量取牛蒡叶提取液30 BV,上样液浓度为0.7倍原提取液浓度,调节溶液pH为3,在MAR柱上以4 BV/h的流速上样吸附,收集吸附残液,分别用5 BV pH分别为1、3、5、7和8的60%乙醇进行解吸附,收集解吸液,将吸附残液和解吸附液浓缩后于60 ℃真空干燥箱中烘干,10 mL甲醇复溶,按照
“1.2.3”方法对吸附残液和解吸液中绿原酸含量进行检测,计算解吸附率,结果如图11所示。由图11可知,当pH为5时,解吸液对LX-218上的牛蒡叶绿原酸有最好的解吸附率,故该研究选用pH为5的解吸液进行后续试验。
2.8.7解吸液流速的考察。
精密量取牛蒡叶提取液30 BV,上样液浓度为0.7倍原提取液浓度,调节溶液pH为3,在MAR柱上以4 BV/h的流速上样吸附,收集吸附残液,取pH=5的60%乙醇5 BV,然后分别以2、3、4、5、6和7 BV/h的流速进行解吸附,收集解吸附液。将吸附残液和解吸液浓缩后于60 ℃真空干燥箱中烘干,10 mL甲醇复溶,按照“1.2.3”方法对吸附残液和解吸液中绿原酸含量进行检测,计算解吸附率,结果如图12所示。
由图12可知,随着解吸附流速的增大,牛蒡叶绿原酸在LX-218上的解吸附率逐渐减小。出现这一现象的原因可能是解吸液流速较大时,吸附在LX-218孔道中的牛蒡叶绿原酸不能及时地从中传质出来。图12显示,流速在3~5 BV/h增大时解吸附率降低程度较小,大于5 BV/h以后解吸附率迅速下降。综合考虑生产效率与目标物解吸附率,该研究采用5 BV/h作为解吸液流速进行后续试验。
2.8.8解吸液用量的考察。
吸附饱和的LX-218型MAR柱用pH=5的60%乙醇以5 BV/h的流速进行解吸附,按照树脂柱床体积收集解吸液,浓缩后于60 ℃真空干燥箱中烘干,10 mL甲醇复溶,按照“1.2.3”方法对解吸液中绿原酸含量进行检测,计算流出液中绿原酸的质量浓度,结果如图13所示。由图13可知,当pH=5的60%乙醇用量为5 BV时,目标物基本达到解吸附终点。因此,最佳解吸液用量为5 BV。
2.9最佳工艺放大验证
牛蒡叶粉末以pH=1的蒸馏水为提取溶剂,在料液比1∶20、提取温度80 ℃、提取时间1 h的条件下进行提取。量取pH=3的牛蒡叶提取液30 BV,上样液浓度为0.7倍原提取液浓度,于LX-218型MAR柱(4.5 cm×40 cm)上,以4 BV/h的动态吸附流速上样,收集吸附残液,再用5 BV pH=5的60%乙醇以5 BV/h的流速进行解吸附。收集解吸液,将吸附残液和解吸液浓缩后于60 ℃真空干燥箱中烘干,10 mL甲醇复溶,按照
“1.2.3”方法对吸附残液和解吸液中绿原酸含量进行检测,计算得吸附容量为38.21 mg/g、解吸附率为94.7%,绿原酸得率为84.41%,绿原酸纯度为55.26%。
3结论与讨论
该研究首先确定牛蒡叶绿原酸的最佳提取工艺,对提取溶剂、提取时间和料液比等影响因素进行了考察,最终确定最佳提取工艺为:提取溶剂为pH=1的蒸馏水,牛蒡叶粉末与提取溶剂的料液比为1∶20,提取温度为80 ℃,提取时间为1 h。通过静态吸附试验测定6种极性不同的MAR对牛蒡叶绿原酸的吸附特性,包括强极性的MARLX-N2、中等极性的MARLX-T28、弱极性的MARAB-8和D101以及非极性的MARLX-26和LX-218。MAR对目标物的分离纯化是基于其表面的活性位点与目标化合物之间的相互作用力(范德华引力或氢键作用)和树脂多孔性的筛分作用共同作用的结果。该研究中的6种MAR虽然极性不同,但是其对目标物的吸附容量差异不大,由此说明6种MAR对牛蒡叶绿原酸的吸附作用是以树脂孔道的筛分作用为主。综合比较6种MAR对牛蒡叶绿原酸的吸附量和解吸附率,结果表明,LX-218对绿原酸具有较好的吸附与解吸附性能,故确定LX-218作为最佳吸附树脂。该研究通过对MAR分离纯化牛蒡叶绿原酸工艺条件、影响参数等的系统研究,在优化的条件下,牛蒡叶绿原酸的回收率和纯度分别为84.41%和55.26%,该分离纯化工艺可应用于牛蒡叶绿原酸的工业化生产。
参考文献
[1]
刘丹赤.牛蒡叶中绿原酸的提取纯化工艺研究[D].济南:山东师范大学,2007:1-17.
[2] 徐传芬,孙隆儒.牛蒡的研究现状[J].天然产物研究与开发,2005,17(6):818-821.
[3] 郭秋娟,陈和平.响应曲面法设计优化牛蒡叶提取绿原酸工艺[J].江苏农业学报,2009,25(1):177-181.
[4] 王春民,刘刚,费艳,等.大孔吸附树脂法纯化黄芩总黄酮工艺的研究[J].中草药,2010,41(1):58-60.
[5] 芦晓芳,马清亮,王海香,等.大孔吸附树脂分离纯化酸枣仁皂苷影响因素探讨[J].分子科学学报,2019,35(1):40-49.
[6] 李俊,刘孟源,方升平,等.大孔吸附树脂分离纯化油橄榄叶总黄酮[J].中成药,2019,41(2):261-265.
[7] 祝明思,陈磊,张公亮,等.牛蒡叶中绿原酸超声波法提取工艺研究[J].安徽农业科学,2011,39(1):134 -136.
[8] 张莹,史益强,戴琳,等.大孔吸附树脂对金银花中绿原酸的纯化研究[J].化工时刊,2010,24(11):1-6.
[9] 杨军宣,尹蓉莉,陈金玉,等.金银花叶中绿原酸的大孔吸附树脂纯化工艺研究[J].中国实验方剂学杂志,2010,16(15):20-23.
[10] 孙阳,黄和,胡燚.绿原酸提取純化方法的研究进展[J].化学试剂,2017,39(3):257-260.
[11] 李岩,赵欣,李晓静,等.大孔树脂分离纯化天仙子总生物碱的研究[J].中成药,2015,37(1):89-94.
[12] 刘娟,罗佳函,刘德江,等.大孔吸附树脂纯化紫花地丁中绿原酸类成分的研究[J].黑龙江医药科学,2011,34(5):26-27.
[13] 高海立,郁吉锋,黄路瑶,等.铁皮石斛叶总黄酮的大孔树脂纯化工艺及抗氧化活性[J].浙江理工大学学报(自然科学版),2019,41(3):380-386.
[14] 张志荣,药剂学[M].2版.北京:高等教育出版社,2014:420.
[15] 王雅,樊明涛,赵萍,等.大孔树脂对沙枣多酚的动态吸附解析性能研究[J].西北农林科技大学学报(自然科学版),2010,38(12):215-220.
[16] 兰艳素,李长江,潘乐.大孔树脂纯化广豆根总黄酮工艺的优化[J].中成药,2016,38(7):1644-1647.
