基于聚多巴胺药物载体的制备及其性能研究
2020-03-31王永乐章晶晶施冬健陈明清
宋 冰,王永乐,章晶晶,施冬健,陈明清
(江南大学化学与材料工程学院,江苏 无锡 214122)
随着癌症发病率的逐年上升,开发具有优异性能的阿霉素类药物载体在生物医用中具有重要的意义与广阔的应用前景[1-4]。近年来,由于含儿茶酚基的多巴胺(DA)具有自聚合性、优异的生物相容性、粘附性、可再反应性等性能而受到广泛关注,其聚合物聚多巴胺(PDA)常被作为药物载体。Cheng等[8]在PDA修饰的介孔二氧化硅纳米粒子表面引入了靶向聚(乙二醇)-叶酸(PEG-FA)聚合物,有效提高了药物负载率,提高了抗肿瘤能力。Tao等[9]通过迈克尔加成反应将带有亲核官能团的配体(如胺和硫醇)与PDA结合,制备得到新型的药物载体搭载紫杉醇用作乳腺癌治疗的靶向药物载体。其他多项研究也证明了PDA 修饰后的聚合物/纳米材料具有较好的药物包封率和药物可控释放性[10-12]。中空的纳米粒子具有更大的空腔,因而,如能制备稳定的中空PDA纳米粒子,则能进一步提高药物包封率。
据此,本研究构筑以聚多巴胺(PDA)为主要结构的纳米颗粒(如图1所示),根据课题组先前的工作[13]通过牺牲模板法来制备中空的聚多巴胺(HPDA)纳米粒子,为提高聚多巴胺纳米粒子在水中的分散稳定性,采用壳聚糖来改变聚多巴胺纳米粒子的亲水性,利用巯基化合物易与聚多巴胺可发生迈克尔加成反应的特点,在合成巯基壳聚糖(CS-SH)的基础上,制备壳聚糖包裹的中空聚多巴胺HPDA@CS复合纳米粒子;通过负载抗癌药物阿霉素,探究阿霉素的体外释放行为与特点,找到最符合该体系的药物释放模型,为潜在的应用提供理论依据。
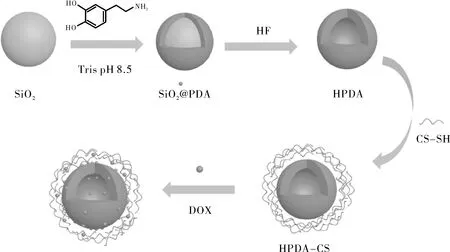
图1 合成路线示意图
1 实 验
1.1 原料与仪器
正硅酸四乙酯(APBA),国药集团化学试剂有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)、盐酸多巴胺(DA·HCl)、巯基丙酸(MPA)、半胱氨酸盐酸盐(Cys)及1-羟基苯并三唑(HOBt),阿拉丁试剂(上海)有限公司;盐酸阿霉素(DOX·HCl),卡通舒生化科技有限公司;低粘度壳聚糖(CS),麦克林生化科技有限公司。
HJ-6多头磁力搅拌器,金坛市医疗仪器厂;RW20 digital顶置式机械搅拌器,上海人和科学仪器有限公司;DZG-6050D真空干燥箱,上海森信实验仪器有限公司;AL104电子天平,梅特勒-托利多仪器有限公司;Coolsafe 110-4冷冻干燥机,环球分析测试仪器有限公司;GZX-GF101-2-S电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;Nicolet iS50 FTIR全反射傅立叶红外光谱仪,美国尼高力仪器公司;AVANCEⅢ 400 MHz核磁共振,德国布鲁克公司;S-4800场发射扫描电子显微镜,日本日立公司;JEM-2100Plus透射电子显微镜,日本电子株式会社;ZetaPALS Zeta电位及纳米粒度分析仪,美国布鲁克海文仪器公司;TU-1901紫外-可见光分光光度计,北京普析通用公司。
1.2 HPDA纳米粒子的制备
首先采用stober合成法制备二氧化硅纳米粒子(SiO2)。具体如下:将1 mL正硅酸四乙酯加入含有2 mL氨水、10 mL去离子水和100 mL乙醇的混合液中,反应3 h后停止搅拌,产物离心,用去离子水洗三遍,放入真空干燥箱干燥48 h,制得SiO2粒子。
取100 mg的SiO2纳米粒子分散于30 mL去离子水中,称取60 mg的盐酸多巴胺分散于上述溶液中,再加入200 μL NaOH(1M)溶液,混合液即变为黑色,室温下磁力搅拌反应12 h后离心分离,产物用去离子水洗涤三次,冷冻干燥。
最后,将干燥完成的产物分散于30 mL去离子水中,量取500 μL的氢氟酸,充分混合反应2 h,离心洗涤三次,冷冻干燥,即得空心的聚多巴胺纳米粒子。
同时,实心聚多巴胺纳米粒子(PDA)在无SiO2模板的NaOH溶液中制备,其实验方法同上。
1.3 CS-SH的制备
称取500 mg壳聚糖(CS,Mw=5000)与350 mg 1-羟基苯并三唑(HOBt)溶于40 mL去离子水中,滴加少量盐酸至CS完全溶解;量取 500 μL(625 mg)巯基丙酸,500 mg EDAC(1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐)加入CS溶液中,并用NaOH溶液调节pH至5并保持恒定,避光反应3 h后,用3.5 kDa的透析袋透析先后在5 mmol/L盐酸和1wt% NaCl中透析三天以除去反应中未完全反应的巯基丙酸,最后再用1 mmol/L 的盐酸溶液透析24 h,冷冻干燥得到白色产物。
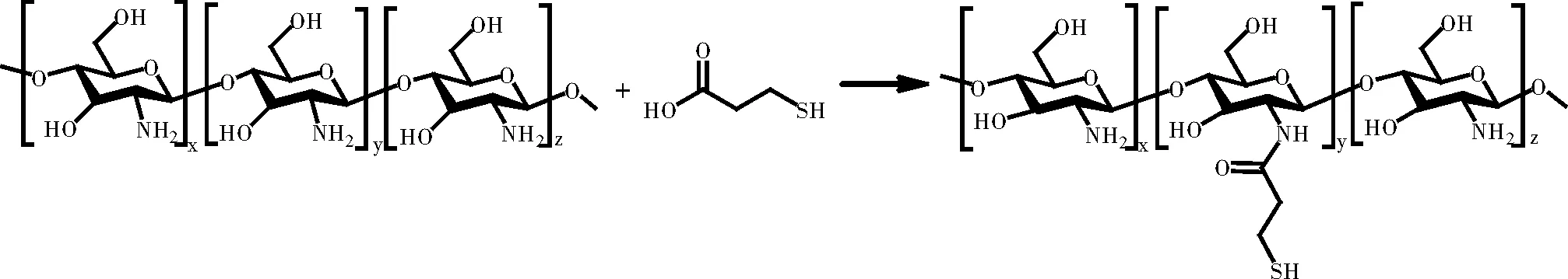
图2 巯基丙酸接枝壳聚糖的合成
1.4 HPDA@CS复合纳米粒子的制备
称取6 mg HPDA纳米粒子溶于30 mL的Tris-HCl(pH 8.5)缓冲溶液中,超声分散30 min,再将6 mg CS-SH溶于上述溶液中,反应12 h,离心并干燥。
同样,实心PDA与CS-SH复合粒子也用同样的方法制备得到。
1.5 阿霉素载药实验及体外释放
称取5 mg盐酸阿霉素溶于50 mL现配的PBS溶液中(pH 7.4),配制得0.1 mg/mL的盐酸多巴胺溶液,避光存放;分别称取4 mg的空心和实心的聚多巴胺基纳米粒子溶于4 mL上述配制的溶液中避光搅拌6 h,反应结束后离心保存上清液,再使用配制的pH为7.4的PBS缓冲溶液离心洗涤一次,除去未负载的阿霉素分子。阿霉素药物的释放实验在37 ℃下于pH为7.4的PBS缓冲溶液中进行,每隔1 h,2.5 h,4.5 h,9 h,9 h定时进行离心取上清液,沉淀物再重新分散于新的PBS缓冲溶液中。
2 结果与讨论
2.1 巯基壳聚糖的结构分析
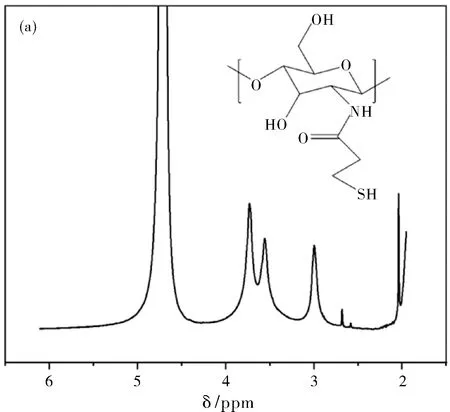
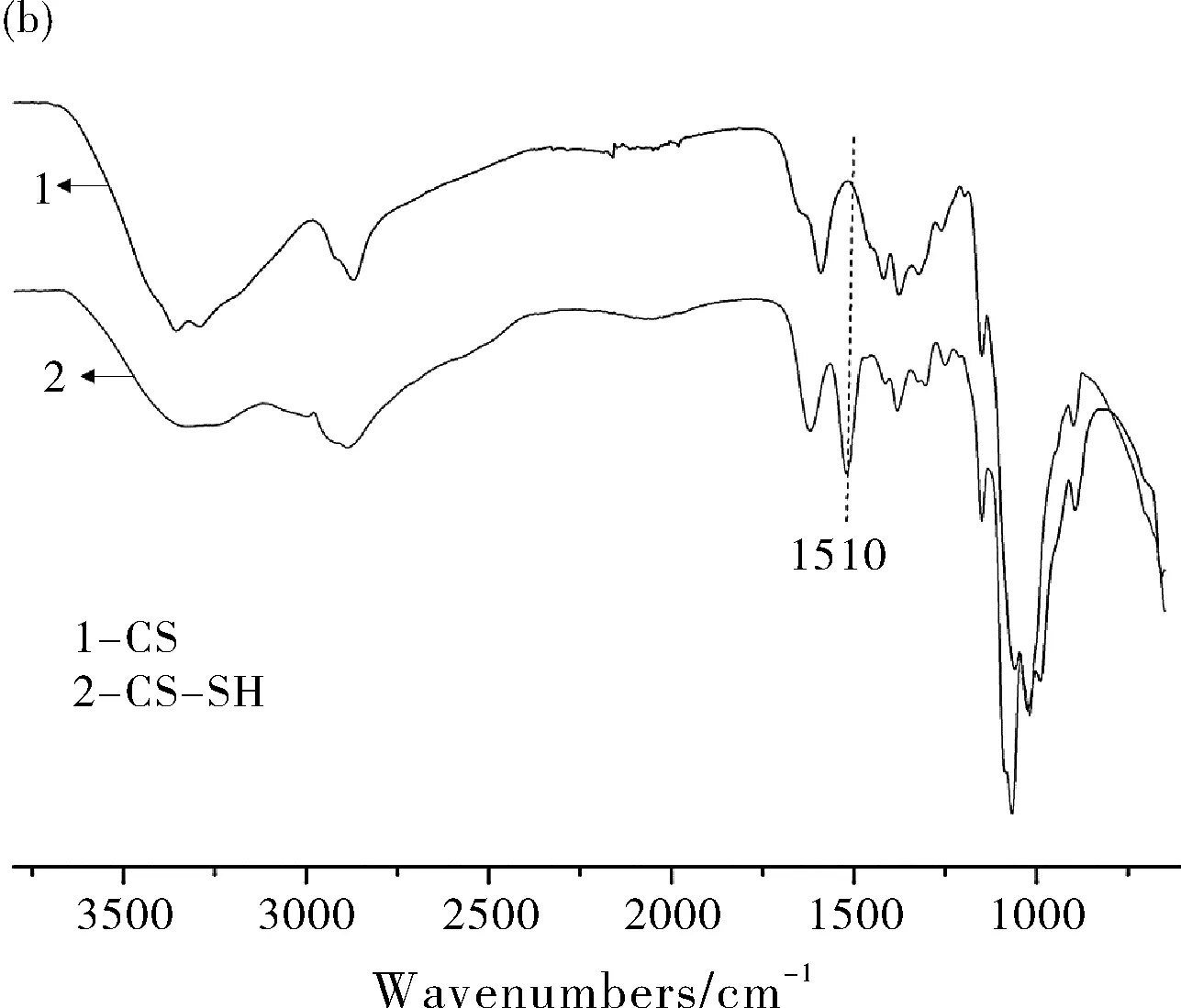
图3 壳聚糖接枝巯基丙酸的1H NMR图谱(a)和巯基壳聚糖与壳聚糖的红外谱图(b)
通过迈克尔加成反应将巯基丙酸接枝到壳聚糖分子链中,用核磁和红外对其结构进行表征。图3a所示的1H NMR谱图中化学位移为3~4之间的是壳聚糖上氢原子的峰,位于2.7附近的是巯基丙酸上亚甲基的峰,经过积分计算巯基丙酸的接枝率为3.7%;红外谱图(图3b)分别是CS、CS-SH,其中CS-SH在1510 cm-1处具有明显的吸收峰,归属于酰胺键上羰基的振动吸收峰,表明成功将巯基丙酸接枝到壳聚糖中。
2.2 纳米粒子的形貌

图4 SiO2(a),SiO2 @ PDA(b),HPDA-CS(c)的SEM照片和SiO2(d),SiO2 @ PDA(e),HPDA(f)的TEM照片
从图4分别是纳米粒子的SEM和TEM照片,图4a、4d显示制备的SiO2为直径为100 nm左右的球形粒子。DA在其表面自聚合形成PDA壳,因而其表面变得粗糙(图4b),从图4e的TEM图中可以明显看到SiO2@PDA为核壳结构,外层为PDA层,由此可以计算PDA层约为25 nm。用HF去除SiO2模板后,图4f显示其为中空结构的HPDA。当在HPDA外层包覆壳聚糖后,如图4c所示,纳米粒子表面变得不规整,粒径与HPDA的基本保持不变。
2.3 载药性能
通过紫外分光光度计建立阿霉素溶液浓度对吸光度的关系,将阿霉素溶于pH为7.4的PBS溶液中,配置一系列不同浓度的阿霉素溶液;检测其230 nm的特征吸收峰,得到标准曲线,其回归方程为A=14.96c(R2=0.99703)为吸光度和浓度的关系式。
包封率(ER)和载药量(DL)是考察药物载体性能的一个重要指标,它能直接反应出药物载体能负载药物的量,ER和DL的计算公式如下所示:
本次试验中均采用4 mL 0.1 mg/mL的阿霉素溶液,故上式中W为0.4 mg;W0为上层清液中剩余的药物量,即负载到载体上的药物量,通过对比负载前后阿霉素溶液的吸光度的变化即可计算得出;W载为药物载体的质量,4 mg;将实心PDA纳米粒子标记为A组,HPDA纳米粒子标记为B组。经过计算:PDA对药物的包封率为17.4%、载药量为1.74%;而HPDA包封率为21.6%、载药量为2.16%,如图5所示,说明空心纳米粒子较大的空腔而使其具有更大的载药效率。

图5 不同类型的药物载体的包封率
2.4 释放性能
测量不同浓度梯度的阿霉素溶液吸光度,PDA(A)、HPDA(B)与阿霉素溶液混合搅拌之后,测量离心所得上清液吸光度,测量在药物载体PBS缓冲溶液中相隔一定时间进行离心所得上清液的吸光度。表1为离心所得上清液药物浓度随时间变化表,上清液累积药物释放量由上清液浓度与体积的乘积计算得出,并与负载的药物量计算得出图6所示累积释放百分比与时间的折线图。
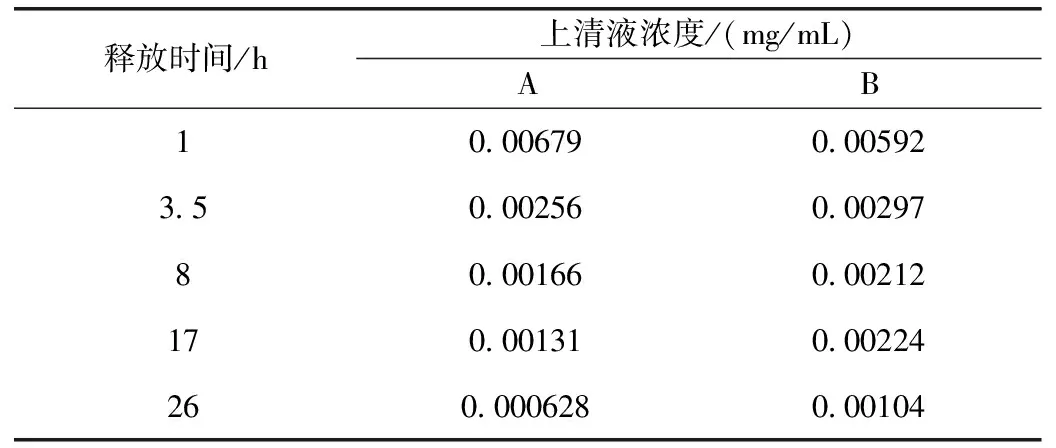
表1 离心所得上清液药物浓度随时间变化表
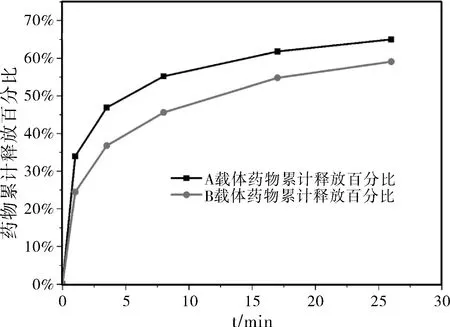
图6 载体PDA(A)和HPDA(B)负载的阿霉素的体外释放百分比
药物的释放一般遵循4种数学模型[14],如表2所示,根据HPDA(载体B)的释放百分比计算得出拟合方程。

表2 根据载体B累积释放百分比的数据拟合出来的四个模型方程
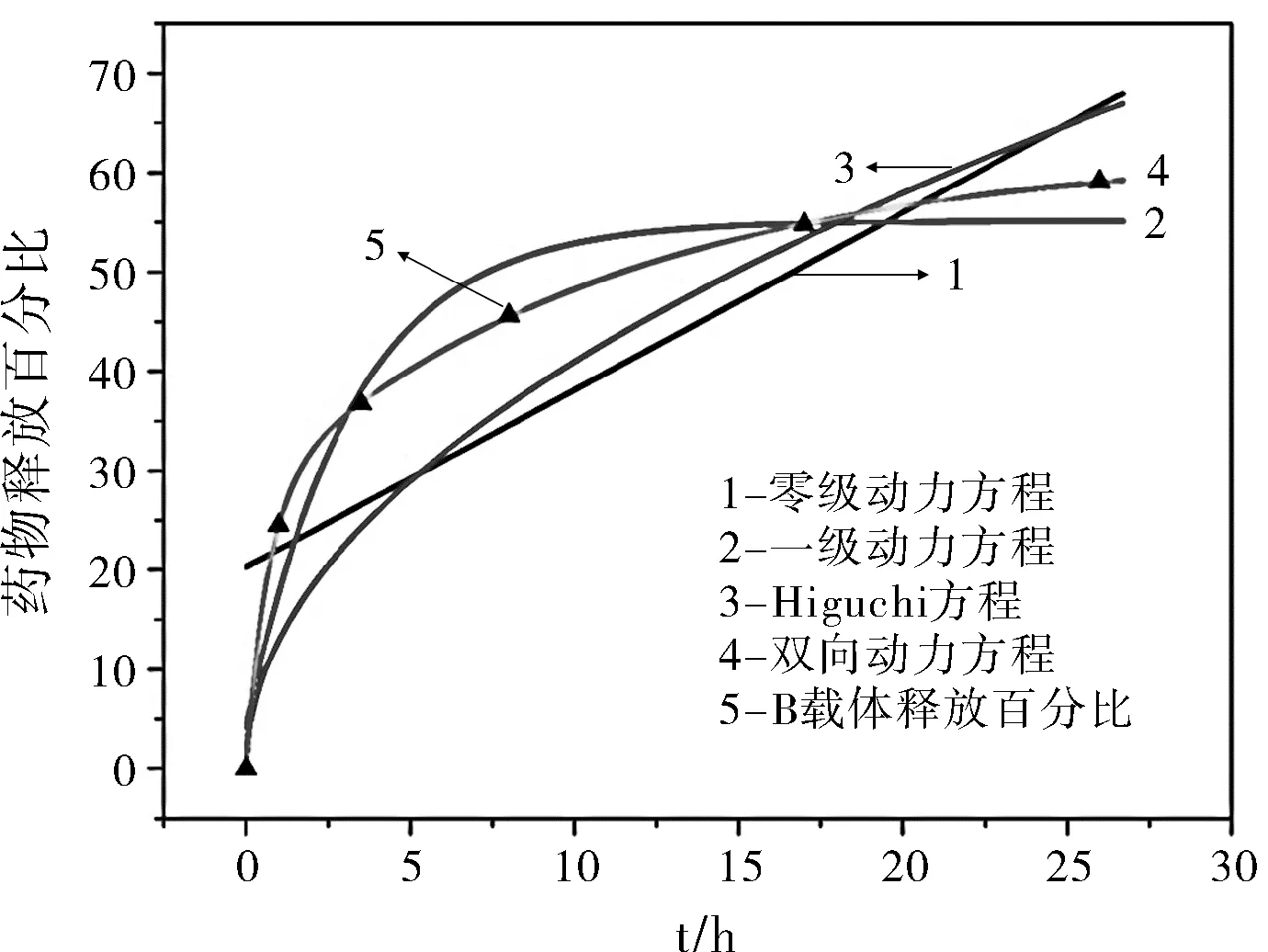
图8 四个动力学模型针对载体B的阿霉素体外累计释放百分比拟合出的曲线与实际载体B的阿霉素体外累计释放百分比
根据载体B累积释放百分比拟合出来的四个模型方程绘制曲线与载体A和B所绘制出的药物累计释放量占载药量的百分比绘制图像比较、匹配可以判断出双相动力曲线方程是最符合载体B累计释放量占载药量的百分比。双相动力方程符合聚多巴胺复合纳米粒子为载体时阿霉素体外释放模型,即在释放初期,由于pH值的变化,导致纳米粒子的结构相应的发生变化,负载在其上的阿霉素此时会大量的释放出来,即形成了一定的突释效应;当释放进行到一定程度,此时聚多巴胺复合纳米颗粒会有一个缓释作用,降低药物的释放速率;同时载体A和载体B作比较时可以发现,实心的聚多巴胺复合纳米颗粒在释放初期的释放速率会略大于空心的聚多巴胺复合纳米颗粒,但是实心的聚多巴胺纳米粒子的释放更加的缓和,在释放后期,同等时间内空心的聚多巴胺复合纳米颗粒能够释放出更多的阿霉素。推测可能是由于空心的聚多巴胺复合纳米颗粒在其腔室内能够容纳一定量的阿霉素分子,在释放后期能够源源不断的释放阿霉素分子;同时由于有空腔的存在,空心的聚多巴胺复合纳米颗粒也能够负载更多的阿霉素分子。
3 结 论
以二氧化硅纳米粒子为模板制备得到中空PDA纳米粒子,巯基化壳聚糖能通过迈克尔加成接到HPDA表面得到聚多巴胺复合纳米颗粒,提高聚多巴胺纳米粒子稳定性。负载到HPDA的阿霉素可在PBS缓冲溶液中缓慢释放,符合双相动力学方程。并且通过对比实心聚多巴胺复合纳米颗粒作为载体时和空心的聚多巴胺复合纳米颗粒在载药量、包封率以及释放特点进行了比较,发现空心聚多巴胺复合纳米颗粒相比较实心聚多巴胺复合纳米颗粒的各项性能均有不同程度的提高,在关于阿霉素的体外释放时,由于有空腔的存在,相当于有一个口袋般的存在使阿霉素的释放更加的缓和,相比较而言,实心的聚多巴胺复合纳米颗粒一开始突释作用很明显,在1 h内,释放量就已经达到了35%,后续释放就明显不如空心的聚多巴胺复合纳米颗粒。
