慢病毒介导长链非编码RNA BACE2-IT1过表达抑制胃癌细胞的增殖和侵袭
2020-03-31杨杰智杨明月吕红琼
杨杰智 徐 倩 杨明月 吕红琼 黄 静
胃癌是我国最常见的恶性肿瘤之一,发生率和病死率在我国位居第3位,仅次于肺癌和肝癌[1]。胃癌的早期症状并不明显,多数患者确诊时已处于中晚期,手术治疗以及放疗、化疗的效果并不理想,临床迫切需要基因靶向治疗、免疫疗法等新兴治疗方法[2]。人类细胞长链非编码RNA(lncRNA)是一类长度大于200nt的内源性单链RNA,本身不具有编码蛋白的功能[3]。lncRNA可在转录、转录后等多个水平调控基因的表达,与肿瘤细胞的活动密切相关, 在肿瘤细胞的增殖、分化、凋亡、转移等恶性生物学行为中发挥重要的调控作用,参与肿瘤的发生、发展[4, 5]。越来越多的lncRNA被归类为抑癌基因或癌基因[6]。BACE2-IT1是一种长度为382nt的lncRNA,其在细胞特别是肿瘤细胞中的作用未见报道。本研究通过检测BACE2-IT1在胃癌组织和胃癌细胞株中的表达,并以胃癌细胞株为研究对象进行体外研究, 探讨BACE2-IT1对胃癌细胞增殖和侵袭的影响及其可能的分子机制, 为lncRNA的分子靶向治疗提供一定理论和实验依据。
材料与方法
1.实验材料: 收集2017年1月~2018年9月笔者医院行手术切除治疗的胃癌临床标本26例,包括胃癌组织和癌旁组织(距离肿瘤边缘超过5cm),术后标本均经病理医生确认无误,研究经笔者医院医学伦理学委员会批准, 参与患者均签署知情同意。载有BACE2-IT1的慢病毒和空载慢病毒由上海汉恒科技有限公司合成;人胃癌细胞株MGC803、BGC-823、SGC7901、HS-746T、AGS和永生化胃黏膜上皮细胞GES-1购自中国科学院上海细胞库;DMEM培养基、RPMI-1640培养基、小牛血清均购自美国Gibco公司;实时定量聚合酶链反应(qPCR)试剂盒购自大连宝生物试剂公司;CCK-8试剂盒和BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;Transwell小室购自美国Costar公司;抗体(HACE1、Wnt、β-catenin、GSK-3β、APC、α-Tubulin)、Matrigel基质胶购自美国BD公司; qPCR引物由上海生工生物工程有限公司合成。
2.细胞培养与慢病毒感染:人胃癌细胞株MGC803、BGC-823、SGC7901、AGS和永生化胃黏膜上皮细胞GES-1复苏后,培养于含10%胎牛血清的RPMI-1640培养基中,胃癌细胞株HS-746T复苏后,培养于含10%胎牛血清的DMEM培养基,置于37℃、5%CO2培养箱中。收集对数期生长的BGC-823细胞,接种于6孔细胞板。待细胞融合度为60%,以感染复数(MOI)=40将慢病毒颗粒液体感染BGC-823细胞,加10μmol/ml聚凝胺以增加感染效率,24h后观察细胞状态并更换新鲜培养基。
3.实时定量聚合酶链反应(qPCR)检测BACE2-IT1和HACE1 mRNA的表达:Trizol法提取胃癌组织和胃癌细胞株总RNA,检测RNA浓度和纯度后,反转录合成cDNA后行qPCR检测。qPCR反应条件:95℃预变性8min, 95℃变性1min, 56℃退火30s, 72℃延伸1min, 共35个循环。数据采用2-ΔΔCt方法进行处理,以GAPDH为内参基因,检测组织或细胞中BACE2-IT1和HACE1 mRNA的相对表达量。GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT- 3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′;BACE2-IT1上游引物:5′-GCTAGTGCTCAGTTTGGTCTGA-3′,下游引物:5′-GCTCCTTAGATCAGGTATCCAGAG-3′;HACE1上游引物:5′-AGTTGCCCGAGGATAATGAAAC-3′,下游引物:5′-TCCACCGATCCACAATTTGCT-3′。
4.CCK-8检测感染后BGC-823细胞的增殖能力:将感染后的BGC-823细胞按5×103个/孔接种于96孔板,每组平行4个孔。CCK-8检测方法:每孔加5mg/ml的CCK-8试剂10μl,继续在培养箱内培养4h,弃去培养基,每孔加150μl二甲基亚砜,采用SpectraMax plus384型全波长酶标仪检测每孔在波长450nm处的吸光度(A)值。连续检测5天,绘制细胞生长曲线。
5.Transwell侵袭实验检测感染后BGC-823细胞的侵袭能力:采用RPMI-1640培养基稀释Matrigel基质胶,平铺至Transwell小室上室内,培养箱内凝固1h。将感染后的BGC-823细胞消化、离心收集,采用RPMI-1640培养基重悬并调整细胞浓度为2×105个/毫升。均匀加入200μl细胞悬液至Transwell小室上室,加入含10%FBS的RPMI-1640培养基600μl至Transwell小室下室,在培养箱中培养24h。取出Transwell小室上室,棉签擦去上室未穿膜的细胞, PBS溶液漂洗,采用多聚甲醛固定25min,吸去固定液,采用0.1%的结晶紫染液染色25min,PBS溶液漂洗3次,晾干后在倒置显微镜下, 每组随机选4个视野计数穿膜细胞数并取平均值。
6.蛋白质印迹法(Western blot法):将感染后的BGC-823细胞采用细胞裂解液裂解并提取总蛋白,BCA蛋白定量试剂盒分析蛋白浓度。十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳,聚偏氟乙烯(PVDF)膜转膜,5%脱脂牛奶封闭1h。加入一抗HACE1(1∶1000稀释)、Wnt(1∶2000稀释)、β-catenin(1∶500稀释)、GSK-3β(1∶2000稀释)、APC(1∶2000稀释)、α-Tubulin(1∶3000稀释), 4℃下孵育过夜,加入二抗在室温下孵育1h。滴加ECL显影液至条带,采用凝胶成像系统显影并拍照。
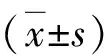
结 果
1.BACE2-IT1在胃癌组织中的表达:qPCR结果显示BACE2-IT1在胃癌组织和癌旁组织中的表达分别为1.34 ± 0.35和5.66 ± 1.09,BACE2-IT1在胃癌组织中低表达,详见图1。

图1 BACE2-IT1在胃癌组织和癌旁组织中的表达
2.BACE2-IT1在胃癌细胞中的表达:qPCR结果显示BACE2-IT1在MGC803、BGC-823、SGC7901、AGS细胞株和永生化胃黏膜上皮细胞GES-1中的表达量分别为0.51±0.05、0.10±0.01、0.81±0.03、0.69±0.06、0.35±0.03和1.00±0.04,与永生化胃黏膜上皮细胞GES-1比较,BACE2-IT1在胃癌细胞株中表达下调,差异有统计学意义(P均<0.01)。BACE2-IT1在BGC-823细胞表达降低最明显(P<0.01),故以BGC-823细胞为对象进行研究,详见图2。

图2 BACE2-IT1在永生化胃黏膜上皮细胞株和胃癌细胞株中的表达与GES-1细胞比较,*P<0.05,**P<0.01
3.qPCR检测感染后BGC-823细胞中BACE2-IT1的表达:qPCR结果显示,对照组和实验组胃癌BGC-823细胞中BACE2-IT1的表达分别为1.07±0.23和8.08±0.63,差异有统计学意义(P<0.01),证明外源性BACE2-IT1在BGC-823细胞中成功表达。
4.BACE2-IT1对胃癌BGC-823细胞增殖能力的影响:采用CCK-8法检测BACE2-IT1过表达对 BGC-823细胞增殖能力的影响,结果显示,与对照组比较,实验组BGC-823细胞从第2天开始,细胞增殖能力明显降低,差异有统计学意义(P<0.05),详见图3。

图3 BACE2-IT1过表达对胃癌BGC-823细胞增殖能力的影响与对照组比较,*P<0.05,**P<0.01
5.BACE2-IT1对胃癌BGC-823细胞侵袭能力的影响:采用Transwell侵袭实验检测BACE2-IT1过表达对 BGC-823细胞侵袭能力的影响,对照组和实验组BGC-823穿膜细胞数分别为87.82±9.57和36.65±5.78,差异有统计学意义(P<0.01),证明BACE2-IT1过表达能抑制胃癌细胞BGC-823的侵袭能力,详见图4。

图4 BACE2-IT1过表达对胃癌BGC-823细胞侵袭能力的影响
6.qPCR检测感染后BGC-823细胞中HACE1 mRNA的表达:qPCR结果显示,对照组和实验组胃癌BGC-823细胞中HACE1 mRNA的表达分别为1.01±0.09和4.31±0.52,差异有统计学意义(P<0.01),证明BACE2-IT1过表达可上调BGC-823细胞中HACE1 mRNA的表达。
7.BACE2-IT1过表达对胃癌BGC-823细胞HACE1蛋白及Wnt/β-catenin信号通路蛋白表达的影响:Western blot法检测结果显示,与对照组比较,实验组的 HACE1蛋白表达上调,而Wnt/β-catenin信号通路蛋白Wnt、β-catenin、GSK-3β、APC表达下调,详见图5。

图5 BACE2-IT1过表达对胃癌BGC-823细胞中HACE1蛋白及Wnt/β-catenin信号通路蛋白表达的影响
讨 论
胃癌在我国的发生率和病死率呈迅速上升趋势,严重威胁人群健康,分子靶向治疗研究是胃癌治疗研究领域的热点[7]。长链非编码RNA(long non-coding RNA,lncRNA)是一类具有组织特异性的非编码RNA,大多数lncRNA由RNA聚合酶Ⅱ转录生成[8]。lncRNA可参与染色质核内运输以及原癌基因活化等重要过程,在多种癌症如前列腺癌、乳腺癌、肝癌、胃癌等中发挥癌基因或者抑癌基因的角色,lncRNA具有成为可靠生物学标志物和治疗靶点的潜力[9~12]。近年来的大量研究表明,lncRNA的异常表达与胃癌的发生、发展密切相关[13]。lncRNA如ZFPM2-AS1、MAP3K20、TP73-AS1、GACAT3在胃癌组织和细胞株中过表达,与胃癌的不良预后密切相关,促进胃癌的恶性生物性行为[14~16]。lncRNA如LINC00675在胃癌组织和细胞株中低表达,参与抑制胃癌的增殖、迁移和侵袭,与胃癌的病理特征和预后等密切相关[17]。BACE2-IT1是一个新发现的lncRNA,BACE2-IT1在胃癌中的表达模式、作用机制尚不清楚。
本研究检测BACE2-IT1在胃癌中的表达模式发现,BACE2-IT1在胃癌组织和细胞株中明显低表达,提示BACE2-IT1可能在胃癌中发挥抑癌基因作用。本研究进一步通过CCK-8实验和Transwell侵袭实验发现,BACE2-IT1过表达可明显抑制胃癌细胞BGC-823的增殖能力和侵袭能力,进一步提示BACE2-IT1在胃癌中发挥抑癌基因作用。HECT家族E3泛素连接酶1(HACE1)是E3泛素接酶HECT家族成员之一,位于6q21染色体[18]。HACE1在结直肠癌、胃癌、乳腺癌等多种肿瘤中低表达,HACE1过表达可抑制肿瘤的生长和转移,是一种潜在的抑癌基因[18]。有研究表明,与癌旁组织比较,胃癌组织中HACE1的表达显著降低;HACE1的表达水平与胃癌的病理分级、分期呈负相关;HACE1过表达在体内和体外均可明显抑制胃癌的生长和转移[19]。本研究通过qPCR和Western blot法验证,BACE2-IT1在胃癌细胞BGC-823中过表达后,HACE1基因的表达明显上调,表明BACE2-IT1可促进HACE1基因的表达。HACE1主要通过抑制Wnt/β-catenin信号通路的活化,干扰肿瘤的生长和转移[19]。Western blot法检测结果显示,胃癌细胞BGC-823中HACE1基因表达上调后,Wnt、β-catenin、GSK-3β、APC等Wnt/β-catenin信号通路蛋白的表达明显降低,Wnt/β-catenin信号通路的活化被抑制。
综上所述,本研究验证BACE2-IT1在胃癌组织和胃癌细胞株中的表达减少,BACE2-IT1过表达能抑制胃癌细胞的增殖和侵袭,其分子机制可能是BACE2-IT1正调控对HACE1的表达并抑制Wnt/β-catenin信号通路的活化,为探索胃癌的发生机制以及发现分子治疗靶点提供理论依据。BACE2-IT1调控HACE1基因表达的作用机制仍不明确,是今后研究的重点。
