二甲双胍通过调节氧化应激、内质网应激和自噬减轻大鼠肾缺血再灌注损伤的作用研究
2020-03-31金领微叶菡洋叶白如潘殊方
金领微 潘 敏 叶菡洋 陈 琰 叶白如 郑 育 潘殊方 施 珍 张 静
肾缺血再灌注损伤(ischemia/reperfusion,I/R)是急性肾衰竭的常见原因,与住院时间长、病死率高有关,在肾移植、心血管手术等许多临床环境中不可避免[1]。肾I/R损伤是一个复杂的病理生理过程,其机制是多因素和相互依赖的,其中包括氧化应激损伤和炎性反应。内质网(endoplasmic reticulum, ER)应激是过度I/R状态的结果之一,研究表明ER应激可激活自噬[2,3]。自噬作用是一个保守的分解代谢过程,主要功能是降解损伤、错误折叠或聚集蛋白质和细胞内细胞器。此外,ROS被发现在自噬过程中发挥重要作用,这表明氧化应激和自噬密切相关[4]。同样,炎症过程被认为是肾I/R损伤的关键机制, ROS是炎性反应中的重要介质[5]。故认为ROS过度产生、炎性反应、ER应激和自噬之间存在密切联系。
二甲双胍作为经典降糖药,对肾脏具有保护作用,它通过激活AMPK通路上调抗氧化的硫氧还蛋白的表达发挥其抗氧化活性,从而减弱ROS的过度形成[6]。此外,它还可抑制多种代谢性疾病相关的炎性因子[7]。二甲双胍预处理减轻I/R损伤的有效性已有报道[1]。然而,其对肾I/R中内质网应激自噬和炎性反应的影响尚不清楚。因此,本研究着重阐述二甲双胍和大鼠肾I/R后氧化应激、炎症、ER应激和自噬的关系。
材料与方法
1.主要药物与试剂:二甲双胍购自美国Sigma公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)、丙二醛(MDA)及蛋白试剂盒购自南京建成科技有限公司;细胞质细胞核蛋白抽提试剂盒购自碧云天生物技术有限公司;GRP 78(#3183)、CHOP(#2895)、p-Eif2-α(#9721)、Beclin-1(#3738)、β-actin(#5125)抗体购自美国Cell Signaling 公司;XBP-1(sc-8015)购自美国Santa Cruz公司;ATF-6α(SM7007P)购自美国Acris Antibodies公司;LAMP-2(ab13524)购自美国Abcam公司;TRIzol试剂购自美国Invitrogen公司。
2.动物模型制备及分组:健康雄性Wistar大鼠,体质量200~250克,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2017-0005]。动物腹腔注射戊巴比妥麻醉(5%),肾缺血再灌注操作按Mahfoudh-Boussaid等[8]所述的方法进行,动物进行常规剖腹手术,并用平滑的血管钳钳住双侧肾蒂,导致局部缺血。将大鼠随机分为3组(每组6只),即假手术组(Sham):肾蒂切开,但血管未发生闭塞;缺血再灌注组(I/R):大鼠肾脏缺血1h,再灌注2h;二甲双胍组(metformin):对动物的处置与I/R组相同,但在模型建立前腹腔注射二甲双胍0.125mg/(kg·d),共14天,Sham组和I/R组给予等容量0.9%氯化钠注射液。实验结束后对大鼠实施安乐死,采集大鼠组织和血液样本。
3.血浆肌酐和乳酸脱氢酶活性测定:采用AU5821全自动生化分析仪(美国Beckman Coulter有限公司)测定血浆样品中肌酐(Cr)和乳酸脱氢酶(LDH)含量。
4.抗氧化酶活性和脂质过氧化评估:根据说明书采用各试剂盒进行检测,通过UV759紫外可见分光度计(上海圣科仪器设备有限公司)分别测定大鼠肾脏组织匀浆中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)、丙二醛(MDA)含量。
5.蛋白印迹分析:按细胞核蛋白抽提试剂盒说明操作,提取肾组织细胞核蛋白,蛋白浓度采用BCA 法测定,加入上样缓冲液煮沸 5min,经12% SDS-PAGE 凝胶上电泳,并转移至 PVDF 膜,5%脱脂牛奶封闭 2h,与一抗(GRP 78、CHOP、p-Eif2-α、Beclin-1、β-actin、XBP-1、ATF-6α、LAMP-2)1∶1000 在 4℃孵育过夜,TBST 洗膜,二抗(羊抗兔,1∶5000)室温孵育 1h,洗膜,ECL 化学发光显影。Image 6.0 软件量化蛋白质水平。
6.实时反转录聚合酶链式反应(RT-PCR):采用TRIzol试剂按说明书从肾组织中提取总RNA,分离RNA进行定量及反转录。在循环的实时PCR系统中对白介素(IL)1β、IL-6、单核细胞趋化蛋白1(MCP-1)的表达进行RT-PCR分析。β-actin作为内参。引物序列如下:IL-1β, F:5′-CTCTGACAGGCAACCACTTAC-3′, R:5′-GTCCAAATTCAATTCATCCC-3′; IL-6, F: 5′-TTGCCTTCTTGGGACTGATG-3′, R: 5′-ACTGGTCTGTTGTGGGTGGT-3′; MCP-1, F: 5′-TTGCCTTCTTGGGACTGATG-3′, R: 5′-ACTGGTCTGTTGTGGGTGGT-3′; β-actin, F: 5′-CCGTAAAGACCTCTATGCCAACA-3′, R: 5′- GCTAGGAGCCAGGGCAGTAATC-3′。
7.肾组织学:肾活检在10%的甲醛中固定,石蜡包埋,5μm切片,标准苏木精-伊红(HE)进行染色。由经验丰富的肾脏病理医生在不知晓实验组的情况下进行组织学评估(每个肾取10个切片),使用徕卡光镜观察,放大倍数400倍。采用Jablonski半定量评分(0~4分)评价肾小管损伤程度[9]。
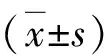
结 果
1.二甲双胍预处理对肾脏损伤及功能的影响:I/R组大鼠肾脏血浆肌酐浓度较假手术组明显升高,而二甲双胍治疗可以缓解肌酐水平的升高(P<0.05)。肾损伤的结果与肌酐浓度一致,I/R组LDH明显高于假手术组(P<0.05)。与I/R组比较,二甲双胍预处理可显著降低血浆中LDH的活性,详见图1。

图1 3组血浆肌酐浓度(A)及乳酸脱氢酶活性(B)与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
2.二甲双胍预处理对抗氧化酶活性和氧化应激的影响:二甲双胍预处理对维持抗氧化酶活性和肾组织氧化应激程度的影响如图2所示,与假手术组比较,I/R组大鼠肾脏SOD、CAT、GPX活性和GSH含量较假手术组明显下降,MDA浓度明显增加 (P<0.05),而二甲双胍组显著逆转了所有这些结果(P<0.05)。
3.二甲双胍预处理阻止内质网应激:免疫印迹分析二甲双胍预处理对ER应激的影响如图3所示, GRP78、ATF-6α、p-eIF-2α、XPB-1和CHOP在I/R组水平高于假手术组(P<0.05),而与I/R大鼠比较,二甲双胍处理的大鼠蛋白的表达均明显减弱(P<0.05)。

图2 肾组织中SOD(A)、CAT(B)、GPX(C)、GSH(D)和MDA(E)水平与Sham组比较,*P<0.05;与I/R组比较,#P<0.05

图3 免疫蛋白印迹分析GRP 78、ATF-6、p-eIF-2α、XBP-1、CHOP的蛋白表达水平β-actin为内参;与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
4.二甲双胍预处理阻止自噬作用:自噬相关蛋白Beclin-1和LAMP-2来评估二甲双胍对自噬通量的影响,如图4所示,大鼠I/R后Beclin-1和LAMP-2的蛋白表达均升高(P<0.05)。与I/R组比较,二甲双胍处理的大鼠蛋白表达显著降低(P<0.05)。

图4 免疫蛋白印迹分析Beclin-1和LAMP-2的蛋白表达水平β-actin为内参;与Sham组比较,*P<0.05;与I/R组比较,#P <0.05
5.二甲双胍预处理对炎症的影响:对大鼠肾脏组织进行实时定量PCR以确定二甲双胍预处理对炎性反应的影响(图5),再灌注24h后,与假手术组比较,I/R大幅度增加炎性因子 (IL-1β、IL-6和MCP-1)的mRNA水平(P<0.05)。与I/R组比较,二甲双胍处理能够显著降低再灌注24h后的促炎性因子的表达(P<0.05)。

图5 RT-PCR分析 IL-1β(A)、IL-6(B)和MCP-1(C)基因表达水平与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
6.二甲双胍处理后组织学改变:肾脏损伤的组织学特征证实了生化指标的变化(图6),在I/R组观察到严重的损伤,包括刷状缘缺失、核凝结、细胞肿胀。与假手术组比较,I/R术后出现肿胀、细胞核丢失和出血。与I/R组比较,二甲双胍预处理显示肾损伤的组织学特征明显减弱,肾损伤评分也显著降低(P<0.05)。

图6 肾脏组织的组织学照片(HE,×400)(A)及采用Jablonski评分评价肾损伤程度(B)蓝色箭头所指为刷状缘缺失,红色箭头所指为管状梗阻,H为出血,L为细胞核丢失;与Sham组比较,*P <0.05;与I/R组比较,#P <0.05
讨 论
在I/R损伤下,二甲双胍对肾脏组织的有益作用已得到充分证明[1, 6, 7]。然而,其对肾I/R损伤引起的内质网应激和自噬信号通路的影响尚未阐明。因此,本研究旨在评估二甲双胍预处理对肾I/R损伤的影响,结果发现二甲双胍可以降低氧化应激,同时抑制炎性因子表达。同样,这些机制之间的密切关系可能是由活性氧的过度形成所引起的,故二甲双胍的保护作用可能通过清除活性氧发挥抗氧化功能。
本研究证实了关于肾I/R在功能和结构改变方面的有害后果[8]。与假手术组比较,肾I/R结果显著增加了血浆肌酐浓度和LDH活性,而二甲双胍可显著降低I/R大鼠的上述指标。MDA水平也被称为脂质过氧化标志物,在I/R后增加[10]。与假手术组比较,二甲双胍处理后细胞脂质氧化显著降低。这可以稳定细胞质膜和线粒体膜,因此有助于降低LDH释放所出现的细胞溶解。这种细胞坏死的直接后果是维持肾脏结构,特别是坏死细胞,肾小管充血和出血更少。既然自由基释放或增加是细胞结构氧化和降解的主要原因,可以认为二甲双胍的有益作用与抑制活性氧生成过多的作用密切相关。SOD代表机体清除自由基的能力,负责清除机体释放自由基,SOD和CAT、GSH在正常生理状态下能将体内生成的氧自由基逐步催化还原,生成对人体无害的水和氧[11,12]。本研究证明了二甲双胍处理通过增加抗氧化酶SOD、CAT、GPX的活性和GSH的水平来刺激细胞抵抗自由基,是一种抗氧化应激的保护剂。这些结果表明,二甲双胍的外源性供应可以增强肾缺血大鼠的抗氧化能力。
氧化应激通过破坏蛋白折叠通路和上调错误折叠蛋白的产生而加剧ER应激[13]。另一方面,ER应激可通过ROS积累促进氧化应激[14]。研究表明肾I/R与GRP78、p-PERK、ATF4、ATF6、XBP-1、CHOP水平升高有关[8, 15]。本研究结果表明,肾I/R诱导GRP78、ATF-6、 p-eIF-2α、XPB-1水平升高。此外,通过定量CHOP水平来评估内质网应激,发现I/R后CHOP水平也增加了,而二甲双胍能够抵消以上ER应激的上调。与此一致,研究表明二甲双胍可降低小鼠肝组织中GRP78、IRE-1α表达,提示二甲双胍可改善内质网应激[16]。
自噬作用或称细胞自消化,是基于双膜泡(自噬体)的形成,它吞噬受损的成分并与溶酶体融合进行降解。大量研究表明ER应激激活自噬。Andriana等[17]研究表明,XPB-1和Ire1α的下游转录因子可通过转录激活Beclin-1诱导自噬作用,证实了本研究中XPB-1和 Beclin-1的高表达。同时,抑制PERK也显著降低了c-myc诱导的人淋巴瘤细胞自噬作用[3]。本研究通过量化自噬体形成指标Beclin-1和LAMP-2(自噬体-溶酶体融合所需的蛋白)来评估自噬的动态变化,结果发现I/R后它们的水平显著升高。此外,笔者的结果与Wu等[18]的研究结果一致,显示缺血肾中Beclin-1和LAMP-2蛋白水平升高。既往研究表明ER应激诱导自噬的保护作用[2]。然而,当自噬作用过度时,笔者发现它是有害的,并促进细胞死亡。此外,Ding等[19]研究发现抑制自噬作用可抑制ER应激诱导的细胞死亡。而本研究发现二甲双胍可显著降低自噬的过度激活。
本研究也证实了二甲双胍对炎症过程的影响,二甲双胍减少肾I/R后促炎细胞因子IL-1β、 IL-6、MCP-1的分泌。再灌注过程中,活化的浸润细胞进入受损肾组织,释放大量促炎细胞因子。实验结果表明,在缺血再灌注2h后,促炎细胞因子IL-1β、IL-6和MCP-1的分泌处于低水平,但再灌注24h后显著增加。炎性细胞因子的产生,在某种程度上可能有助于ER应激通过炎性复合物NLRP3 刺激IL1-β释放[20]。有报道称CHOP与炎性反应相关,故ER应激可能会引发炎症。反过来,炎症导致ROS的过度产生,有研究表明,自噬通过促进炎性复合物降解并通过自噬体隔离它们来抑制炎性反应。
综上所述,二甲双胍能够有效保护肾脏免受缺血再灌注(I/R)诱导的损害,其对调节氧化应激、ER应激通路和自噬过程具有潜在作用。此外,二甲双胍还具有抑制细胞炎性损伤的作用。
