活体肝移植全腹腔镜保留肝中静脉右半肝供肝切取术3例报告
2020-03-31代宇范伟
代 宇 范 伟
(贵州省人民医院肝胆外科二部,贵阳 550002)
随着腹腔镜技术的发展和尸肝供应的紧缺,近年来,活体肝移植(living donor liver transplantation,LDLT)得到飞速发展。在LDLT中对于儿童受体腹腔镜左肝外叶切取已逐渐成为标准术式,对于成人受体仍需右半肝或左半肝才能满足生理需要,但传统开放性手术创伤大、恢复慢、住院时间长,腹腔镜右半肝切取操作复杂、难度大大增加[1~3]。我院经过多年腹腔镜右半肝和开放性供肝切取术的经验积累后,2017年9月~2018年7月对3例供者施行全腹腔镜下右半肝切取,效果满意,现报道如下。
1 临床资料与方法
1.1 一般资料
病例1:女,45岁,因拟作为亲体肝移植供体2017年9月29日入院。BMI 22.1。体格检查:腹平软,全腹无压痛,Murphy征(-),移动性浊音(-)。上腹部增强CT:肝脏大小、形态及各叶比例协调,表面光滑,肝实质信号均匀,未见异常信号灶,肝内血管走行正常;胆囊不大,壁未见增厚,腔内未见明显异常信号;胰腺及脾脏大小形态正常,信号均匀,未见异常信号灶,主胰管未见扩张。肝硬度:7.2(F2),肝脏脂肪变性提示脂肪变<11%。术前吲哚菁绿试验(indocyanine green,ICG) 15 min滞留率(ICGR 15)6%。肝脏储备功能量化评估Child-Pugh分级A级,术前移植物与受体体重比(graft-recipient weight ratio,GRWR)为0.875%。供体全肝体积899.71 ml,残肝体积373.94 ml(41.6%),右半肝体积 525.77 ml(58.4%)。受体标准体积1024.50 ml,供体与受体关系为母子关系。
病例2:女性,47岁,因拟作为亲体肝移植供体2017年11月12日入院。BMI 23.1。体格检查:腹平软,全腹无压痛,Murphy征(-),移动性浊音(-)。上腹部增强CT:肝脏大小、形态及各叶比例协调,表面光滑,肝实质信号均匀,未见异常信号灶,肝内血管走行正常;胆囊不大,壁未见增厚,腔内未见明显异常信号;胰腺及脾脏大小形态正常,信号均匀未见异常信号灶,主胰管未见扩张。肝硬度:7.5(F2),肝脏脂肪变性提示脂肪变<10%。ICGR 15 min 7%。Child-Pugh分级A级,术前GRWR为0.95%。供体全肝体积1047.58 ml,残肝体积471.41 ml(45.0%),右半肝体积576.17 ml(55.0%)。受体标准体积1036.01 ml。供体与受体关系为母子关系。
病例3:女,50岁,因拟作为亲体肝移植供体2018年7月1日入院。BMI 22.4。体格检查:腹平软,全腹无压痛,Murphy征(-),移动性浊音(-)。上腹部增强CT:肝脏大小、形态及各叶比例协调,表面光滑,肝实质信号均匀,未见异常信号灶;胆囊正常大小,腔内未见明显异常信号;胰腺及脾脏大小形态正常,信号均匀未见异常信号灶,主胰管未见扩张。肝硬度:7.3(F2),肝脏脂肪变性提示脂肪变<10%。ICGR 15 min 7.5%。Child-Pugh分级A级,术前GRWR为0.85%。供体全肝体积1035.32 ml,残肝体积434.83 ml(42.0%),右半肝体积600.49 ml(58.0%)。受体标准体积1139.56 ml。供体与受体关系为母子关系。
1.2 方法
供体术前三维重建:将原始CT数据利用CT自带软件对数据进行调整、分析,推至层厚1 mm,将数据以DICOM格式导出进行三维重建,病例2发现解剖变异,为门静脉变异(门静脉右前支汇入门静脉左支)。
全身麻醉。取“大”字体位,术者站患者右侧。气腹压控制在13~15 mm Hg,中心静脉压控制在0~5 cm H2O。脐上2 cm为观察孔,左侧锁骨中点与脐水平线上2 cm处及剑突下1 cm为副操作孔分别置入12 mm trocar,右侧锁骨与脐水平线上2 cm处及右侧腋前线与同侧肋缘交点各置入12 mm trocar,形成扇形分布,将手术区域囊括其中(图1)。首先,探查肝脏,根据术中超声明确肝中静脉位置后,电钩划出肝中静脉走行。游离第一肝门后预置阻断带备用。其次,离断肝周韧带(肝圆韧带、镰状韧带、冠状韧带、右侧三角韧带、肝肾韧带及右肾上腺);切除胆囊,残端钛夹夹闭,经胆囊颈管残端插入造影管注入造影剂行术中胆道造影,再次明确有无胆道变异。降低肝门板,分别游离右肝动脉、右肝门静脉及右肝管备用。无损伤血管夹夹闭右肝门静脉及右肝动脉,见明显缺血线后电钩沿缺血线标记,松开血管夹。依次离断肝圆韧带、镰状韧带、右侧冠状韧带、右三角韧带完全游离右半肝。术中一般不阻断肝血流, 若肝断面渗血较多, 可行Pringle法阻断第一肝门,阻断15~20 min。沿标记的缺血钱利用超声刀离断肝实质,遇渗血较少处用双极电凝或电凝棒止血,较粗大管道Hem-o-lok夹闭两端中间离断。逐步游离至第二肝门,显露肝右静脉,套入阻断带牵拉肝右静脉,以便充分游离出足够的肝右静脉。向两侧牵拉肝脏,游离第三肝门,遇粗大肝短静脉近端Hem-o-lok夹闭,远端钛夹夹闭后离断以便行血管重建。最后依次使用Hem-o-lok夹闭右肝管、右肝动脉、门静脉右支近端剪刀依次离断,最后肝右静脉近端无损伤血管夹夹闭,远端Hem-o-lok夹闭离断(图2)。取右上腹小切口,快速取出肝脏。UW液灌注供肝后并修整后送至受体手术室进行移植。观察肝断面出血情况,出血较多时可行Pringle法阻断第一肝门,4-0血管缝线缝扎出血点,渗血点可用双极或单极电凝止血,同时需注意检查断面有无胆汁渗出。断面覆盖止血纱,于肝断面放置24号引流管1根。
2 结果
3例供者手术均成功完成保留肝中静脉供肝右半肝切取。均未输血,术中、术后情况见表1、2。1例门静脉变异右前支汇入门静脉左支(图3)。术后1、3、6、9个月随访,供者肝功能正常,肝脏体积明显增大,无死亡及严重并发症。
受者:1例术后出现严重肺部感染死亡;1例胸腔积液,1例胆漏,最终均治愈出院。
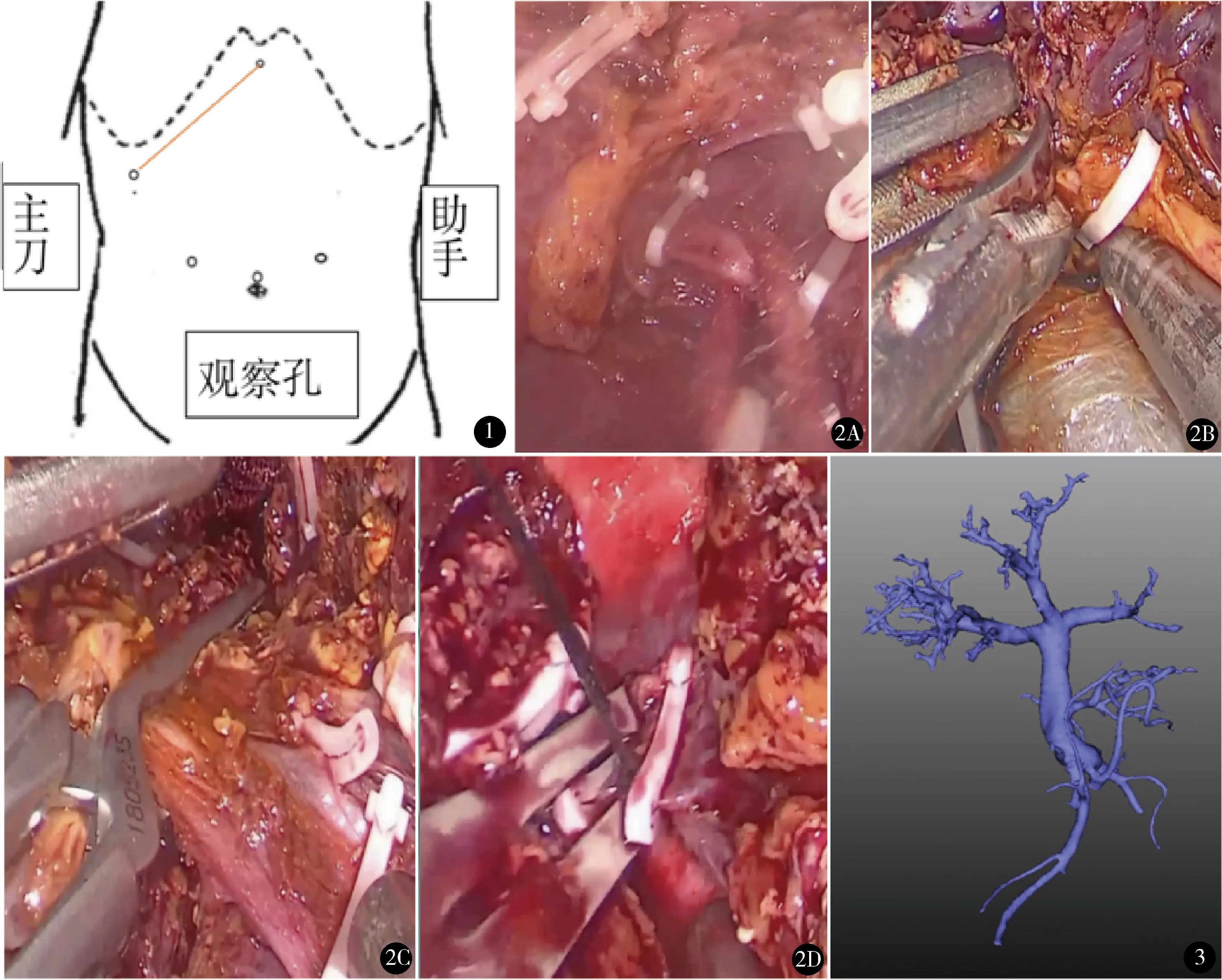
图1 术中trocar位置 图2 腹腔镜右半肝切取术 A.离断肝右动脉;B.离断门静脉右支;C.离断门静脉右支;D.离断肝右静脉 图3 门静脉右前支汇入门静脉左支
3 讨论
2006年Koffron等[4]报道成功完成腹腔镜辅助右半肝切取术。此后美国及日本报道使用相同方法完成手术[5,6]。全腹腔镜下活体肝移植供肝右半肝切取手术目前只有少数几个移植中心开展。2017年吴泓等[7]报道6例全腹腔镜下活体肝移植供肝右半肝切取。2010~2016年我中心共完成10例活体肝移植,250例腹腔镜下半肝、肝段切除,具备腹腔镜肝切除及活体肝移植的技术积累。
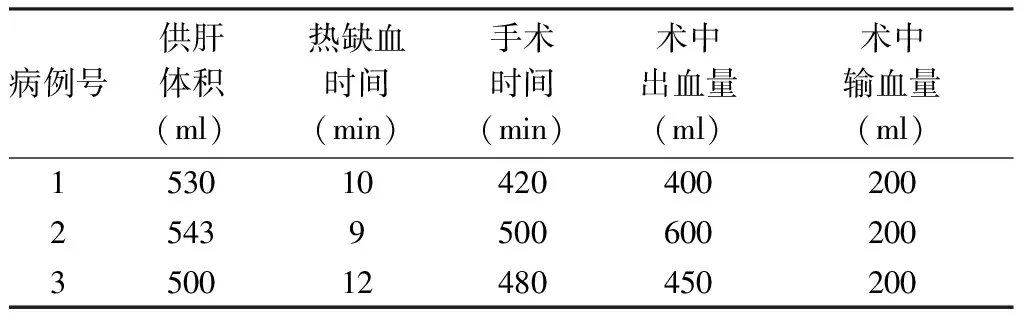
表1 3例供者术中情况
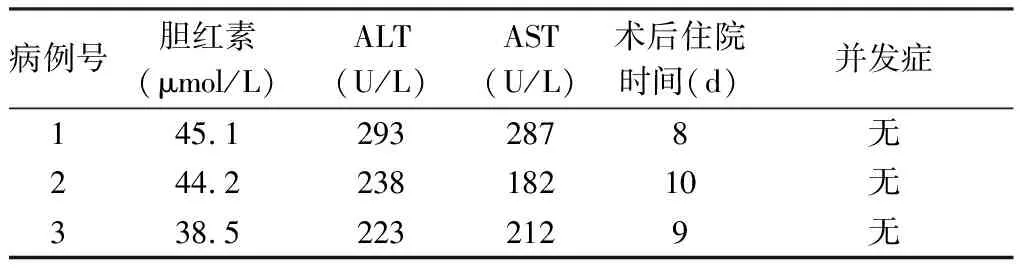
表2 3例供者术后情况
ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶
目前,开展的腹腔镜下肝移植主要分为:左肝外叶供肝切取、左半肝切取、右半肝切取,其中左半肝及右半肝又分为手辅助及全腹腔镜手术。手辅助腹腔镜肝切取相对于全腹腔镜手术切口较大,术后恢复相对较慢[8]。
2017年以来我中心完成3例全腹腔镜下活体肝移植供肝右半肝切取手术,经验总结如下。
3.1 如何控制出血
①为保证供肝质地,常规情况下不行全肝阻断,仅预置阻断带,如出血较多仍需阻断第一肝门,我们的经验是利用超声刀游离肝实质,较粗血管经夹子夹闭后离断,渗血较少可用自制电凝棒或双极电凝止血,效果较好。②腹腔镜的放大效果可以很好暴露肝实质内小管道,加上精细操作及解剖可以减少出血[9,10],与肝切除的肝质地相比,肝切取患者质地较好,无肿瘤粘连,易于解剖,肝门暴露清晰;另外,腹腔镜气腹压可减少肝断面静脉血逆流,减少出血,至于高气腹压是否会导致气体栓塞,理论上有相关性,但缺乏相关研究支持,我们一般将气腹压控制在13~15 mm Hg。③控制性中心静脉压目前已广泛应用至肝脏切除、肝移植手术中,已证实可明显减少出血。我们将中心静脉压控制在0~5 cm H2O,主要通过减少输液、调整体位(头高足低15°左右)、适当利尿、使用血管活性药物等方法。同时,可以通过观察肝静脉主干有无塌陷、空虚、肝静脉随呼吸而波动来判断中心静脉压是否控制较好。
3.2 技术难点
①供肝流出道及流入道保护:首先,充分游离肝周韧带;其次,游离第一肝门,再次游离肝实质显露第二、第三肝门;最后,依次离断右肝动脉、门静脉及右肝静脉。②保留足够长的肝右静脉:以往右肝静脉用切割闭合器离断损失较大,术后行血管重建难度大,术后可能出现流出道狭窄导致该段肝脏受损,术后出现小肝综合征,经改良后近端无损伤血管夹夹闭,远端Hem-o-lok夹闭离断,可以较好保留右肝静脉。③精准切取:游离右门静脉及肝动脉后可用血管夹先夹闭该血管,待出现缺血线后做标记,随后开放血管,结合术前三维重建及术中B超确定肝中静脉位置,确定预切线。
3.3 供体选择及评估
术前需完善上腹部增强CT、MRI、三维重建、肝硬度、脂肪变等检查。明确有无胆道、血管变异,术前模拟手术切除,制定预切线,与术中B超结合做到精准肝切除,避免变异胆管、血管损伤,减少术后胆道狭窄、胆漏、血栓及小肝综合征。1例门静脉右前支汇入门静脉左支,需切除重建。入腹后首先探查肝脏有无硬化、脂肪变;其次,术中冰冻活检了解肝脏质地再次确认供肝可用性。
目前,腹腔镜技术在肝切除手术广泛应用,许多大型医院已作为常规开展术式,但腹腔镜右半肝切取应用较少,对术者有较高要求,手术医师不仅需要具备丰富的腹腔镜肝切除经验,还需要肝移植手术经验的支持。本组例数少,存在一定局限性,需要多中心、大样本的对照研究证实腹腔镜活体供肝切取是否优于其他术式(如开放式供肝切取、腹腔镜辅助供肝切取等)。
