不同冷藏条件下金枪鱼的水分迁移与脂肪酸变化的相关性
2020-03-31王馨云
王馨云,谢 晶
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海冷链装备性能与节能评价专业技术服务平台,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
大眼金枪鱼又称鲔鱼、吞拿鱼,具有高蛋白、低脂肪等特点,同时含有大量不饱和脂肪酸、维生素和矿物质,深受消费者的喜爱[1-2]。大眼金枪鱼富含很高的二十碳五烯酸(icosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoci acid,DHA)等营养成分。杨金生等[3]对黄鳍金枪鱼、蓝鳍金枪鱼和鲣鱼的DHA和EPA含量进行测定,其DHA与EPA相对含量之和超过30%。邹盈等[4]发现大眼金枪鱼、黄鳍金枪鱼和蓝鳍金枪鱼的不饱和脂肪酸含量分别占总脂肪酸的64.30%、66.28%和89.03%,其中EPA和DHA含量较高。但在冷藏过程中,脂肪氧化以及微生物的侵染[5-6]导致金枪鱼营养价值降低,品质难以得到保证。学者们对金枪鱼脂肪酸等营养成分进行了不少的研究,但对冷藏过程金枪鱼的脂肪酸变化却鲜有报道。
水分是水产品中含量最高的化学组分,水分含量是评价水产品品质的重要指标之一。水分含量和分布状态在水产品冷藏过程中呈动态变化,是决定水产品品质、风味、质构和货架期的重要因素[7]。根据水分的状态不同可分为结合水(与蛋白质等大分子紧密结合的水分)、不易流动水(肌原纤维内及间隙的水)和自由水(纤维束外水)[8]。传统测量方法操作复杂,且只能测出水分总含量,无法确定水分的状态及分布情况。而低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)技术所测的横向弛豫时间T2的变化规律可反映水分的迁移情况及各状态水分含量的变化,它作为一种快速、准确、无损、非侵入的技术已逐步应用于农业、高分子材料、医学以及水产品行业[9-10]。Wang Xinyun[11]和Al-Habsi[12]等研究了水产品贮藏过程中水分变化,随着贮藏时间的延长,在微生物的作用下,鱼肉组织微观结构遭到破坏,水分发生迁移,不易流动水向自由水转变,使水产品品质下降,证明了水产品的品质变化与水分迁移有一定关系。Greiff等[13]借助LF-NMR技术分析不同浓度添加剂对鳕鱼鱼糜蛋白结构的影响,发现随着添加剂浓度增加,不易流动水(T21)和自由水(T22)含量逐渐增大,蒸煮损失率和持水力降低,这是由于肌肉纤维内的水分子与蛋白质之间的相互作用被抑制,表明LF-NMR技术可用于评价添加剂对水产品品质的影响。Geng Shaote等[14]应用LF-NMR技术分析干海参复水过程的水分变化,根据T2的变化测定水分含量并推断预渗时间分别为24 h和96 h,通过主成分分析(principal component analysis,PCA)得到干燥海参的复水比、硬度、咀嚼性之间呈现良好的相关性,并在PCA得分图上能明显区分干制和盐制海参。说明利用LF-NMR技术可间接检测水产品质构特性,其结果与水产品质构参数的结果一致。
目前,国内外学者已有应用LF-NMR技术检测水产品品质的研究[15-16],但鲜有针对水产品脂肪酸变化与水分迁移之间关系的研究。本实验模拟家庭贮藏(0、4 ℃)过程中金枪鱼的品质变化,利用LF-NMR技术研究金枪鱼在冷藏过程中水分迁移与脂肪酸变化的相关性,为水产品的快速无损检测提供参考。
1 材料与方法
1.1 材料与试剂
材料为真空冻藏于-55 ℃的大眼金枪鱼背部肌肉,购自浙江丰汇远洋渔业有限公司。
硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸、甲醇、氯仿(均为分析纯) 生工生物工程有限公司;标准品十九碳酸甲酯(C19:0) 美国Sigma-Aldrich公司。
1.2 仪器与设备
Aqualab 4TE Duo水分活度仪 美国Decagon公司;PQ001 LF-NMR分析仪 上海纽迈公司;XB220A-SCS分析天平 北京普利赛斯科技有限公司;H-2050R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;UV-2100紫外-可见分光光度计 美国尤尼柯仪器有限公司;7890A-5975C气相色谱-质谱联用仪 美国安捷伦公司;PB-10 pH计 德国赛多利斯公司。
1.3 方法
1.3.1 金枪鱼预处理
将购得的金枪鱼块放在0 ℃恒温冰箱解冻12 h后,快速分割每块质量为100.00 g,用聚乙烯保鲜袋分装(1 块/袋)后,立即贮藏于0、4 ℃恒温冰箱。每天测定金枪鱼的pH值、水分活度(water activity,aw)、水分质量分数、TBA值、横向弛豫时间T2。每隔3 d测定金枪鱼的脂肪酸含量、核磁伪彩成像图。每组做3 个平行实验。
1.3.2 指标测定
1.3.2.1 pH值测定
称取剁碎金枪鱼肉5.00 g,加入45 mL蒸馏水搅抖并静置1 h,取上清液,用pH计测定其pH值。
1.3.2.2 aw测定
取1.00 g金枪鱼片置于样品杯中,然后将样品杯放置于水分活度仪中。测量温度为25 ℃,持续20 s,在稳定时测定aw。
1.3.2.3 水分质量分数测定
水分质量分数的测定参照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》。
1.3.2.4 TBA值测定
采用李念文[2]和Cai Luyun[17]等的方法,并略有改动。准确称取5 g已绞碎鱼肉,加入15 mL 20 g/100 mL三氯乙酸溶液和10 mL蒸馏水,匀浆60 s,静置1 h后过滤。滤液用蒸馏水定容至50 mL,取5 mL滤液,加入5 mL 0.02 mol/L TBA溶液,沸水浴中反应20 min后用流动水冷却5 min,在532 nm波长处测定吸光度,TBA值按下式计算。
TBA值/(mg/100 g)=7.8×A532nm
1.3.2.5 横向弛豫时间T2和核磁成像测定
横向弛豫时间T2和核磁成像(magnetic resonance imaging,MRI)参考Wang Shuo等[18]的测定方法,并稍加修改。将约10 g样品保鲜膜封闭包装,防止水分蒸发,放入线圈直径为70 mm的核磁管中进行测定。质子共振频率21 MHz,磁体强度0.55 T,磁体温度32 ℃。选择CPMG序列测定鱼肉样横向弛豫时间T2,主要参数设置为:射频信号频率偏移量(O1)=171 005.93 Hz,采样点数(TD)=400 004,90°脉宽(P1)=17.00 μs,180°脉宽(P2)=32.00 μs,采样频率(SW)=100 kHz,回波时间(TE)=0.5 ms,采样等待时间(Tw)=4 000 ms,射频延时(RFD)=0.08 ms,模拟增益(RG1)=20.0 db,数字增益(DRG1)=6 db,累加次数(NS)=2,回波数(NECH)=8 000。使用NMRAS分析软件采集信号,反演后对数据进行归一化处理。MRI测定鱼肉的质子密度图谱,得到的质子密度图通过Image Evaluation软件测定图像的灰度。
1.3.2.6 脂肪酸含量测定
称取0.2 g样品,加2 mL甲醇、4 mL氯仿,25 ℃ 180 r/min振摇20 min,加入2 mL去离子水,漩涡2 min,再1 000 r/min离心10 min,取下层清液至新离心管,氮气吹干。加入3 mL正己烷、25 μL 10 mg/mL C19:0内标,漩涡振荡2 min,加入3 mL 0.4 mol/L KOH-甲醇溶液,漩涡振荡1 min。37 ℃水浴反应30 min后,加入2 mL去离子水,漩涡振荡2 min,静置分层,取上清液至新离心管,氮气吹干。再加入200 μL正己烷,漩涡振荡2 min,静置,取上清液至进样小瓶中。
气相色谱参数:色谱柱:DB-5(30 m×0.25 mm,0.25 µm);进样量:1 μL;进样温度:270 ℃;分流比:5∶1;载气:氦气(99.999%);流量:1 mL/min。柱温70 ℃保持5 min,以25 ℃/min升至200 ℃,再以2 ℃/min升至240 ℃,保持10 min。接口温度:280 ℃;离子源温度:230 ℃;四极杆温度:150 ℃;电离方式:电子电离(正离子模式),70 eV;扫描方式:全扫描;分子质量范围:33~500 Da。
1.4 数据处理与分析
采用Excel 2016软件处理数据,数据结果以平均值±标准差表示。采用Origin 8.6软件绘图。采用SPSS 15.0软件进行方差分析(analysis of variance,ANOVA),通过Pearson相关系数法分析LF-NMR的横向弛豫时间T2与脂肪酸含量的相关性,显著性水平设置为α=0.05。
2 结果与分析
2.1 冷藏期间金枪鱼的pH值变化

图 1 金枪鱼在0 ℃和4 ℃贮藏期间pH值的变化Fig. 1 Changes in pH of tuna during storage at 0 or 4 ℃
如图1所示,在贮藏前期(0~2 d)pH值呈现下降的趋势,是由于金枪鱼在僵直期肌肉组织中发生糖酵解反应,大量生成乳酸等酸性物质,从而使pH值下降。2 d后,两组金枪鱼pH值呈上升趋势,在第6天0 ℃贮藏条件下pH值上升至6.9,4 ℃贮藏条件下pH值达到7.2。主要由于在微生物和酶的作用下,蛋白质被分解为氨基酸、氨、三甲胺等碱性物质,从而使鱼肉pH值上升。与0 ℃相比,4 ℃下金枪鱼pH值上升趋势更为明显,说明贮藏温度较高会促进蛋白质加速分解,生成碱性物质。王尊等[10]也发现冷藏过程中带鱼的pH值呈先下降后上升的相同趋势。
2.2 冷藏期间金枪鱼的aw、水分质量分数变化
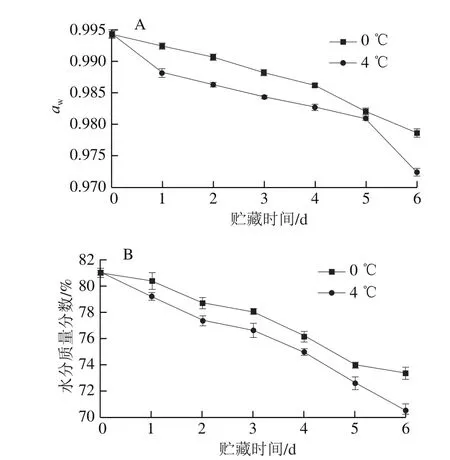
图 2 金枪鱼在0 ℃和4 ℃贮藏期间aw(A)和水分质量分数(B)的变化Fig. 2 Changes in aw (A) and moisture content (B) of tuna during storage at 0 or 4 ℃
aw和水分质量分数是评价水产品保水性的重要指标,并且能够反映水产品的品质、质构和风味变化[19-20]。由图2可知,随着贮藏时间的延长,aw和水分质量分数逐渐降低,金枪鱼的初始aw为0.990,贮藏第6天时0、4 ℃条件下分别下降到0.978、0.972(图2A),主要因为在贮藏过程中,金枪鱼肉受到微生物的侵染,肌肉组织结构被破坏,造成大量的水分流失,导致鱼肉品质的劣化[21]。在0 ℃贮藏的第6天,水分质量分数下降至73.36%,而4 ℃贮藏条件下的第6天已下降至70.51%(图2B),说明4 ℃条件下的下降趋势更为明显,贮藏温度较高加速了水分的流失。
2.3 冷藏期间金枪鱼的TBA值变化
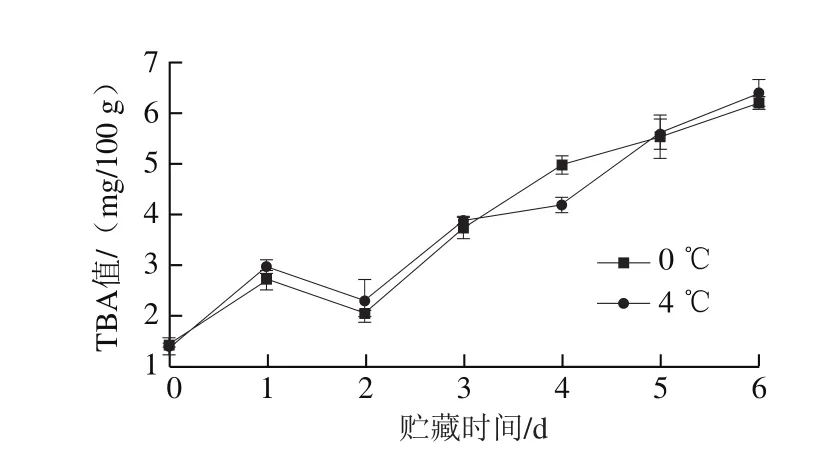
图 3 金枪鱼在0 ℃和4 ℃贮藏期间TBA值的变化Fig. 3 Changes in TBA value of tuna during storage at 0 or 4 ℃
TBA值能反映水产品不饱和脂肪酸的氧化程度,测定原理是产生的丙二醛与硫代巴比妥酸反应生成稳定的红色化合物[22]。如图3所示,0 ℃和4 ℃条件下,TBA值总体呈明显上升趋势,这主要是因为贮藏过程中鱼肉发生自动氧化和水解作用,产生的低级醛、酮类物质会促使鱼肉的品质劣变[23]。0 ℃条件下金枪鱼的TBA初始值为1.41 mg/100 g,贮藏结束时(6 d)上升至6.18 mg/100 g,而4 ℃条件下TBA值上升到6.48 mg/100 g,温度高使鱼肉更容易氧化。
2.4 冷藏期间金枪鱼的水分迁移的情况
通过LF-NMR技术可分析金枪鱼肉中水分的分布状态、不同状态水的含量以及水分迁移过程[24]。LF-NMR横向弛豫时间T2能反映金枪鱼内部氢质子所处的环境,与氢质子所受的束缚力及其自由度有关。金枪鱼在低温贮藏过程中不同状态水分的分布和水分迁移的情况见表1,LF-NMR图中一共出现3 个组分峰,分别为T2b(强结合水)在0~1 ms之间,表示与金枪鱼肉紧密结合的水,在贮藏期间变化趋势不显著。T21(不易移动水)在4~100 ms之间,表示在金枪鱼肉肌原纤维内及间隙的水。随着贮藏时间的延长,T21左移,这是因为蛋白质空间结构的氨基酸残基被破坏,疏水性降低,部分空间结构外的水开始被束缚。在贮藏后期,鱼肉的微生物繁殖速度变快,疏松多孔结构遭到破坏,造成空隙体积的缩小,引起不易流动水的迁移,4 ℃条件下T21变化趋势更明显,说明贮藏温度较高时,肌丝网收缩,肌原纤维内部空间变小,存在于肌原纤维间隙的水分被挤出,不易流动水流失,加速鱼肉品质劣变。T22(自由水)在40~600 ms之间,代表在肌原纤维外的水。冷藏前期,T22左移,原因可能是低温使金枪鱼肉中水分子自由度降低,束缚力较强,自由水与金枪鱼肉蛋白质的结合程度降低。在冷藏期间后期,微生物和酶类物质作用使得肌原纤维内部结构遭到破坏,并且导致肌原纤维间隙的水向外流出,不易流动水向自由水迁移,使得T22开始增大。

表 1 金枪鱼在0 ℃和4 ℃横向弛豫时间T2变化Table 1 Changes in transverse relaxation time T2 of tuna during storage at 0 or 4 ℃

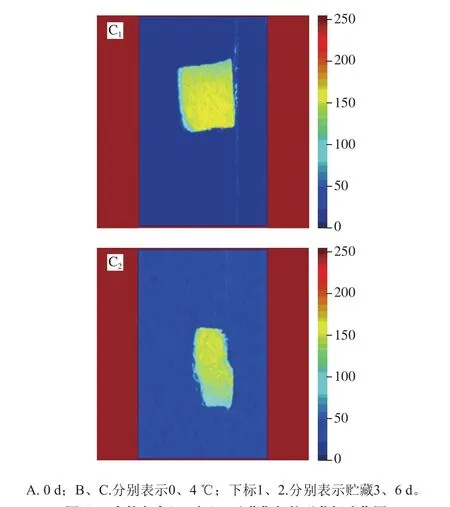
图 4 金枪鱼在0 ℃和4 ℃贮藏期间核磁共振成像图Fig. 4 Magnetic resonance images of tuna during storage at 0 or 4 ℃
通过MRI可直观地观察水分分布以及迁移情况[25]。图4显示金枪鱼在低温贮藏(0、4 ℃)的第0、3、6天的水分质子密度伪彩图,灰度范围为0~250,不同颜色表示灰度的大小,灰度越大表示水分质子密度越高,反之亦然[9,26]。根据金枪鱼伪彩图的颜色分布,能够直观观察水分的分布。随着贮藏时间的延长,红色逐渐向蓝色转变,说明金枪鱼水分质子密度降低,水分含量逐渐减少。0 ℃贮藏组第3天伪彩图有部分变成黄色,而4 ℃贮藏组第3天几乎全变黄色,表明4 ℃组质子密度更低,有部分水分流失。贮藏到第6天,颜色已有部分变蓝,组织结构被破坏,腐败区域从内部扩散到表面。且4 ℃贮藏金枪鱼水分含量和迁移变化程度比0 ℃的金枪鱼更为明显,说明较高温度对会加速金枪鱼品质的劣变。
2.5 冷藏期间金枪鱼的脂肪酸变化
水产品的脂肪酸含量和组成作为评价水产品营养价值具有重要作用[27]。由表2可知,从金枪鱼肉中共检测出30 种脂肪酸,其中11 种为不饱和脂肪酸。在第0天不饱和脂肪酸DHA含量(892.486 2 μg/g)最高,EPA含量(103.991 2 μg/g)较高,EPA和DHA具有在防治心脑血管疾病、抗癌、抗炎症等功效,具有很高的营养价值。随着贮藏时间的延长,在0 ℃条件下DHA和EPA含量在贮藏末期(6 d)分别下降至250.675 8 μg/g和82.645 4 μg/g,且4 ℃条件下DHA和EPA含量下降得更多。而在0 ℃和4 ℃条件下饱和脂肪酸含量有所升高,其中C16:0含量升高尤为显著。说明在冷藏过程中金枪鱼肉脂肪酸发生降解现象,有部分不饱和脂肪酸转化成饱和脂肪酸,且温度高加速脂肪酸的降解。脂肪酸降解会产生游离脂肪酸和氧化产物,其中氧化产物与蛋白质反应,影响鱼肉的风味以及质构,导致鱼肉品质及营养价值的降低[28]。
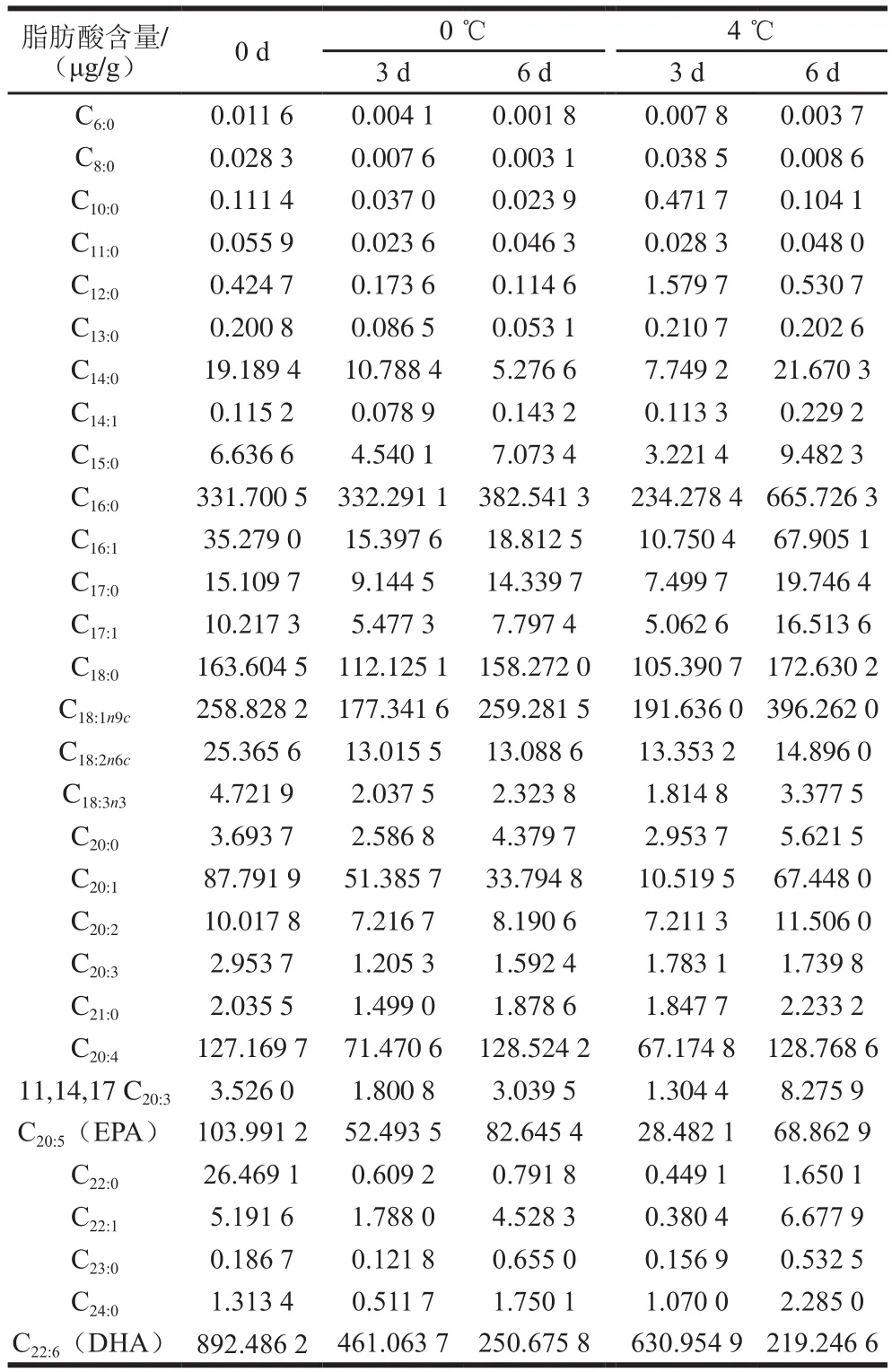
表 2 金枪鱼在0 ℃和4 ℃的脂肪酸组成变化Table 2 Changes in fatty acid composition of tuna during storage at 0 or 4 ℃
2.6 相关性分析结果
表3是根据Pearson相关分析法得出的金枪鱼在冷藏条件下T2与脂肪酸(含量较高的前6 种脂肪酸)含量之间的相关性。脂肪酸含量与T2呈现良好的相关性,T2b与C18:0、EPA含量呈显著负相关(P<0.05)。结合水以氢键的形式与脂肪酸、蛋白质和多糖等结合[29],贮藏时间和温度会影响氢键与脂肪酸结合的能力,从而影响鱼肉的品质。T21与DHA含量呈极显著正相关(P<0.01),说明T21增大,DHA含量随之增大。T22与C18:0、C18:1n9c含量分别呈极显著(P<0.01)和显著(P<0.05)正相关。在冷藏过程中不易流动水对DHA含量影响显著,自由水对C18:0和C18:1n9c含量影响显著。自由水可被用于微生物生长、酶促以及氧化反应,进而影响部分脂肪酸氧化代谢程度[24,30-31]。金枪鱼在贮藏过程中T22逐渐增大,说明水分自由度逐渐增加,可促进物质代谢,加速部分不饱和脂肪酸转化为饱和脂肪酸。由于多不饱和脂肪酸分子中富含不饱和双键,对温度敏感,易被氧气氧化降解,在水分和微生物的共同作用下发生氧化作用,以上结果说明T2与脂肪酸含量有良好的相关性,可以通过LF-NMR横向弛豫时间T2表征部分脂肪酸的变化,实现快速评价金枪鱼品质变化。
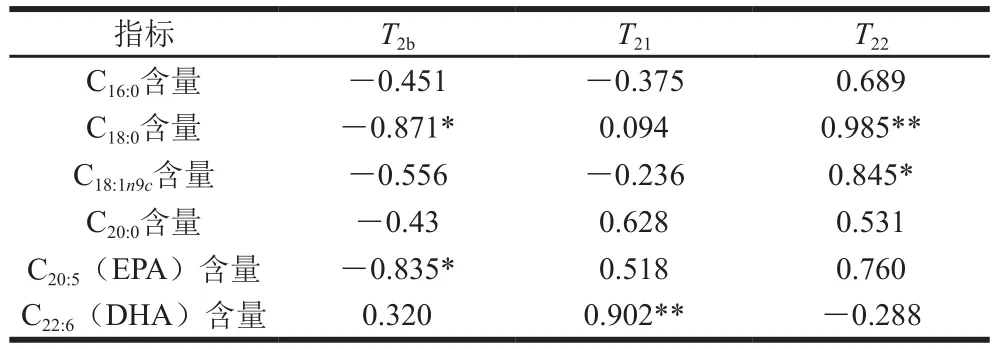
表 3 金枪鱼在冷藏期间水分迁移与脂肪酸各指标间的相关性分析Table 3 Correlation between water migration and fatty acids of tuna during cold storage
3 结 论
随着贮藏时间的延长,pH值先降低后升高,TBA值逐渐升高,而水分含量和aw逐渐下降,金枪鱼的品质发生了劣变。LF-NMR横向弛豫时间T2和核磁伪彩图的结果表明,表征不易流动水的T21左移,氢质子的密度逐渐变小,表明在贮藏过程中肌原纤维内的水流失,肌肉的保水性降低。在冷藏过程中金枪鱼肉脂肪酸发生降解,部分不饱和脂肪酸转化成饱和脂肪酸。T2b与C18:0、EPA含量呈显著负相关(P<0.05),T21与DHA含量呈极显著正相关(P<0.01),T22与C18:0、C18:1n9c含量分别呈极显著(P<0.01)和显著(P<0.05)正相关。因此,可以通过LF-NMR技术检测金枪鱼肉水分迁移来评定金枪鱼肉脂肪酸降解程度,从而快速无损监测金枪鱼在冷藏期间品质变化,为水产品快速检测提供了理论依据。
