黑参多糖抗疲劳作用的分子机制
2020-03-31刘兴龙赵迎春陈雪艳佘欣鑫SADIAKhatoon解慧勇蒋白楠郑毅男刘文丛丁传波
刘兴龙,赵迎春,陈雪艳,佘欣鑫,SADIA Khatoon,姜 颖,解慧勇,蒋白楠,郑毅男,刘文丛,,丁传波,
(1.吉林农业大学中药材学院,吉林 长春 130118;2.吉林省健维天然生物科技有限公司,吉林 临江 134300;3.参之道(通化)生物科技有限公司,吉林 通化 134001)
人参(Panax ginseng C. A. Meyer)是五加科(Araliaceae)植物人参干燥根及根茎,也是我国传统的名贵中药材,具有补脾益肺、生津养血、安神益智的功效[1]。近年来,人参常被用作促进健康的药用和功能性食品,市场上也因此出现了一些新的人参深加工品,如红参、黑参等。黑参为生晒参在高温条件下反复蒸制烘干制成。现代研究表明,黑参的主要活性成分为皂苷[2],包括多糖、多酚及多种氨基酸等黑参提取物都具有比生晒参、红参有更强的生物活性,如抗氧化、抗肿瘤、降血糖、提高免疫、抗炎等[3-5],而目前对黑参多糖成分抗疲劳的研究鲜见报道。
现代医学对疲劳的治疗有限,已有学者研究具有抗疲劳作用的潜在替代品,包括传统中草药及预防疾病和促进健康的药用或功能性食品[6-7]。本实验研究了黑参多糖成分对疲劳小鼠机体的改善作用,测定疲劳小鼠血清中相关生化指标,并对肝脏组织中白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)促炎因子分析,以及肌肉组织中过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)、过氧化物酶体增殖物激活受体α(atherosclerosis peroxisome proliferator activated receptory α,PPARα)等相关基因mRNA表达的相关性进行研究,评价黑参多糖对疲劳机体的延缓和改善效果,为黑参作为功能性食品和药品的开发提供依据。
1 材料与方法
1.1 动物、材料与试剂
90 只SPF级ICR雄性小鼠,体质量18~22 g,由吉林省长春市亿斯实验动物技术有限公司提供,生产许可证号:SCXK(吉)2018-0023。所有实验程序经吉林农业大学实验动物伦理委员会批准。
黑参样品购自吉林省珲春市华瑞参业有限公司,经吉林农业大学郑毅男教授鉴定为五加科人参新型深加工产品,烘干后粉碎成粉,过60 目筛。
白细胞介素-6(interleukin-6,IL-6)、血尿素氮(serum urea nitrogen,SUN)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、肝糖原测定试剂盒南京建成生物公司研究所;UNIQ-10柱式TRIzol总RNA提取试剂盒 生工生物工程(上海)股份有限公司;TB Green Premix Ex Taq(2×)(Tli RNaseH Plus)、ROX Reference Dye(50×) TaKaRa(北京)生物技术公司;抗兔二抗 北京索莱宝科技有限公司。
1.2 仪器与设备
AE224电子天平 上海恒平仪器;BGZ-246电热鼓风干燥箱 北京东南仪诚实验室设备有限公司;旋转蒸发仪、冷冻干燥机 瑞士BUCHI公司;酶标仪美国Thermo Electron公司;StepOnePLUS实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 ABI(美国)有限公司;TG16-WS高速离心机 湖南湘仪离心机仪器有限公司;电泳仪、凝胶成像仪 北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 供试药液的制备
黑参样品粉碎,精密称量100.001 5 g,加入5 倍体积的体积分数70%乙醇溶液,常温条件下搅抖提取3 h,8 000 r/min离心。去除上清液,取沉淀,加入8 倍体积的水,90 ℃水浴2 h,间歇搅抖,待冷却后,于8 000 r/min离心45 min。静置30 min,收集上清液,同时进行浓缩,浓缩液加入3 倍体积的无水乙醇醇沉,静置过夜。8 000 r/min离心,取沉淀并冻干,得到黑参多糖(black ginseng polysaccharide,BGP)样品,经此方法所提黑参多糖经分析计算多糖质量分数为86.4%。
1.3.2 实验分组
在专业动物房中适应性饲养7 d,疲劳小鼠模型的建立按如下方式操作:90 只ICR小鼠随机分为9 组:1)无游泳对照组(NS-cont);2)负重游泳对照组(SW-C,0 mg/kg mb);3)负重游泳低剂量组(SW-L,50 mg/kg mb);4)负重游泳中剂量组(SW-M,100 mg/kg mb);5)负重游泳高剂量组(SW-H,200 mg/kg mb);6)不负重游泳对照组(SW-cont,0 mg/kg mb);7)不负重游泳黑参多糖低剂量组(SW-BGP-L,50 mg/kg mb);8)不负重游泳黑参多糖中剂量组(SW-BGP-M,100 mg/kg mb);9)不负重游泳黑参多糖高剂量组(SW-BGP-H,200 mg/kg mb)。对照组每天灌胃生理盐水,给药组每天按不同剂量灌胃,连续28 d。所有动物饲养在具备动物饲养标准许可的专业动物房内,在特定的无病原体条件下(控制温度18~28 ℃,相对湿度30%~80%),每笼饲养4~5 只,并饲喂标准实验室食品且保证自由饮水喂食。
1.3.3 负重游泳实验
通过负重游泳实验,对小鼠进行肌肉疲劳锻炼,进而测定小鼠力竭游泳时间。而力竭游泳时间是机体抗应激、抗疲劳能力的综合体现,也是衡量机体运动能力的重要体外指标[8-9]。按照给药剂量灌胃给药28 d,末次给药30 min后,在负重游泳组小鼠尾端系上小鼠体质量5%的铅皮,置于(30±2)℃的水箱(水深度为(50±2)cm,以确保小鼠完全进入水中而不触碰水底)进行游泳锻炼,自小鼠入水时开始计时,至其沉入水底超过10 s时作为其力竭时间。
1.3.4 脏器指数及血清生化指标的检测
按剂量灌胃给药28 d,末次给药30 min后,对非负重游泳组小鼠在安静状态下断尾取血,用血乳酸仪测定其BLA含量,立即止血,置于同1.3.3节水箱中游泳30 min,立即吹干并休息10 min后测定其游泳后BLA含量。之后将所有小鼠用异氟烷麻醉以进行采血,血样静置15 min然后4 ℃、4 000 r/min离心10 min,分取血清,按照试剂盒说明书方法测定生化指标。然后处死取骨骼肌,液氮保存备用;同时收集小鼠肝脏、脾和肾,生理盐水洗去血渍,滤纸吸干称质量,并按照下式计算各脏器指数。将分取的肝脏用锡纸保存于-80 ℃,用于匀浆制备、蛋白质印迹分析。
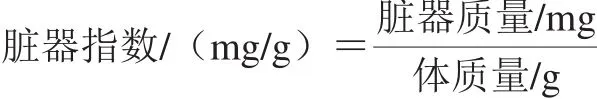
1.3.5 逆转录qPCR
称取小鼠骨骼肌50 mg,置于经过高压灭菌的研钵中,加入液氮进行充分研磨;将研磨好的粉末分取放入1.5 mL离心管中,静置5 min,加入1 mL的裂解液裂解1 min,再按照提取总RNA试剂盒提取组织中RNA;分取1 μL总RNA加入逆转录反应体系,合成cDNA模版,并以此为模版利用TB Green Premix Ex Taq(2×)试剂盒进行扩增。qPCR所使用的引物序列如表1,反应条件为95 ℃预变性30 s,95 ℃变性5 s,退火温度为55 ℃、30 s,40 个循环。
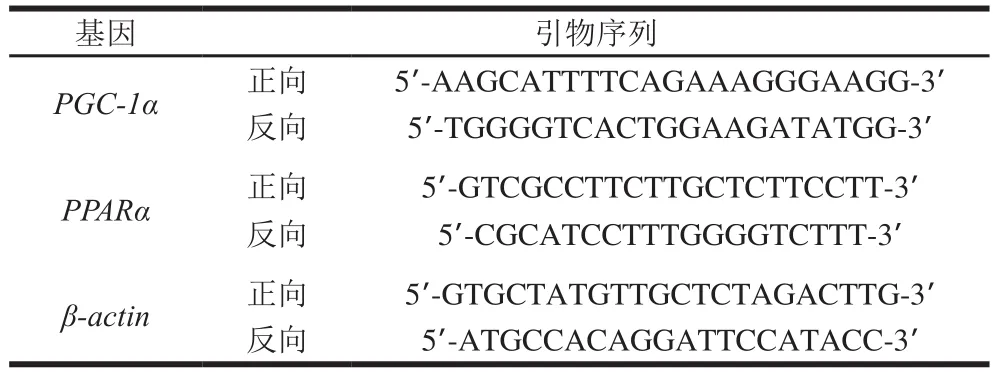
表 1 引物序列Table 1 Sequence sequences of primers used in this study
1.3.6 免疫印迹分析
小鼠肝IL-1β、TNF-α蛋白表达水平采用Western blot法测定。称取部分肝组织,加入蛋白裂解液,匀浆离心,提取总蛋白,并通过蛋白质试剂盒测定浓度。蛋白质通过质量分数10%十二烷基硫酸钠-聚丙烯酰胺凝胶分离,并随后转移至聚偏氟乙烯(poly(vinylidene fluoride),PVDF)膜。将PVDF膜在质量分数5%脱脂牛奶中封闭60 min,在4 ℃下一抗孵育过夜,再于二抗中室温孵育60 min。β-肌动蛋白被用作内标,检测炎症蛋白因子IL-1β、TNF-α在肝脏中的表达。
1.4 数据统计分析
使用SPSS 24.0软件进行统计分析,采用单因素方差分析对各组数据的差异性进行比较,P<0.05表示差异显著,所得数据以 ±s表示。结果数据图表用GraphPad Prism 6.0软件制作。
2 结果与分析
2.1 黑参多糖对小鼠力竭游泳时间的影响
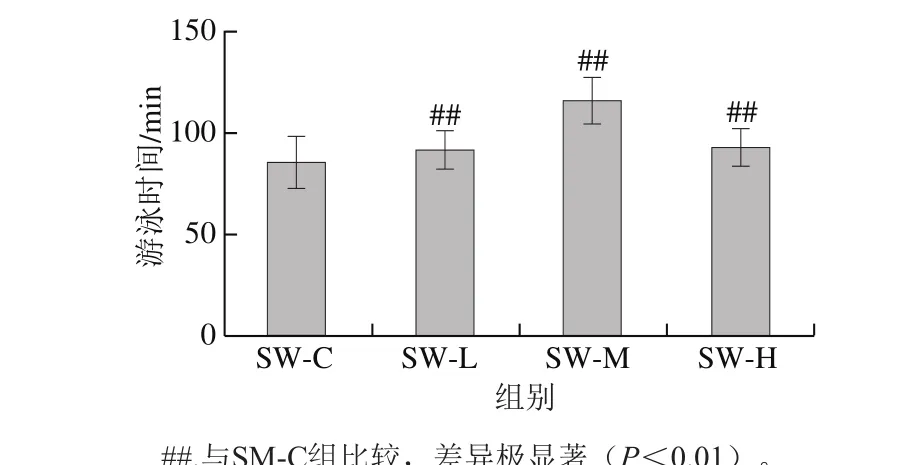
图 1 黑参多糖对小鼠负重游泳时间的影响Fig. 1 Effect of BGP on exhaustive swimming time of mice
如图1所示,3 个剂量组的小鼠负重游泳时间比SM-C的游泳时间极显著延长,低、中、高剂量组分别延长6.61%、34.92%、8.14%。结果表明,黑参多糖增强了小鼠的强迫游泳能力,说明黑参多糖具有抗疲劳作用。
2.2 黑参多糖对小鼠体质量及脏器指数的影响
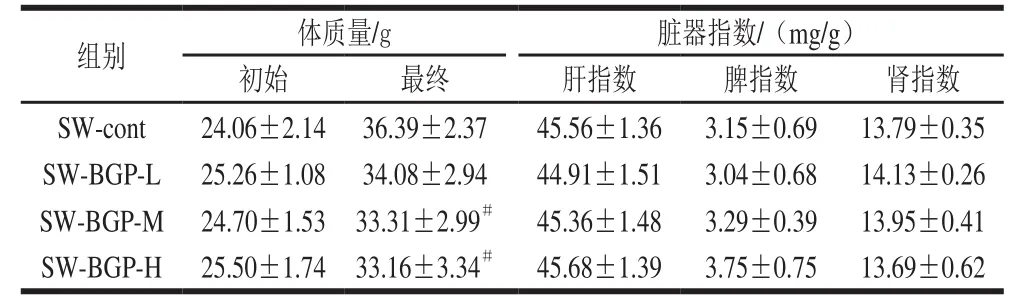
表 2 黑参多糖对小鼠体质量及脏器指数的影响Table 2 Effect of BGP on body mass and organ indices in mice
如表2所示,对小鼠的体质量及脏器指数进行测定。与对照组小鼠相比,黑参多糖中剂量组和高剂量组小鼠体质量略有下降,但各给药组小鼠肝脏、肾脏和脾脏指数并无显著差异。结果表明,在增强小鼠肌肉方面会有部分改善,而对小鼠的脏器并不会造成损伤,并可能形成保护作用。
2.3 黑参多糖对小鼠血清生化指标的影响

图 2 黑参多糖对小鼠血清中BUN(A)、BLA(B)及IL-6(C)水平的影响Fig. 2 Effect of BGP on the levels of BUN (A), BLA (B) and IL-6 (C) in mice
如图2A、B所示,与空白对照组相比,强制游泳组小鼠血清中BUN和BLA水平显著升高,表明通过强制游泳引起的小鼠机体疲劳模型建立成功。然而,通过黑参多糖处理的低、中、高剂量组小鼠血清中BLA和BUN水平极显著下降(P<0.01),高剂量组(200 mg/kg)具有更好的效果。如图2C所示,在强迫游泳的小鼠中,与NS-cont组相比,SW-cont组IL-6水平极显著增加,而经黑参多糖处理后各给药组抑制了机体血清IL-6水平的升高。这些结果表明,黑参多糖显著减少了BUN、BLA因运动疲劳在血清中的堆积,同时又能显著抑制血清中IL-6水平的升高,因而起到抗疲劳作用。
2.4 黑参多糖对小鼠肝脏中相关生化指标的影响
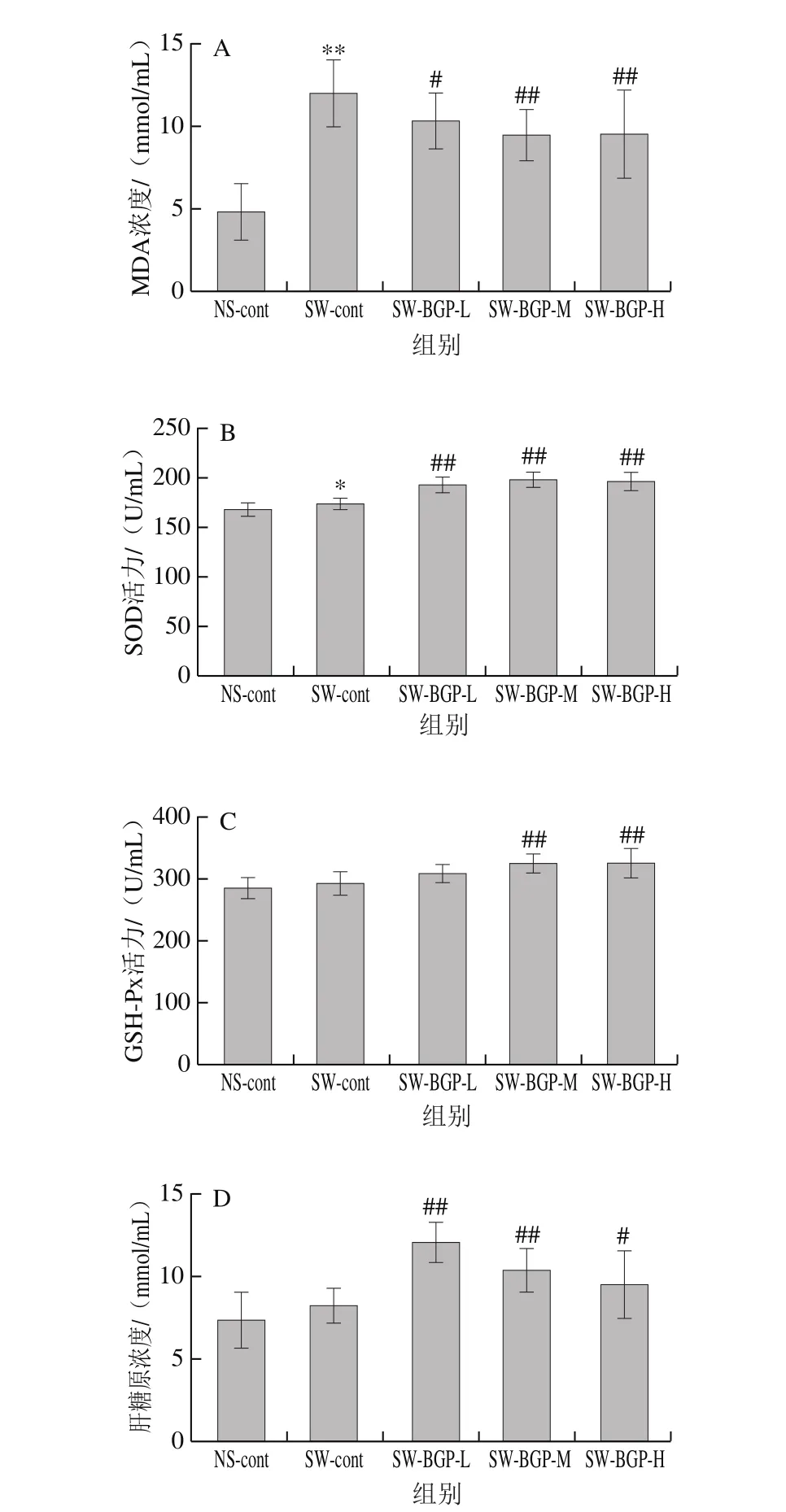
图 3 黑参多糖对小鼠肝脏中MDA(A)、SOD(B)、GSH-Px(C)及肝糖原(D)水平的影响Fig. 3 Effect of BGP on the levels of MDA (A), SOD (B), GSH-Px (C)and glycogen (D) in liver tissues of mice
图3A显示了与NS-cont组相比,SW-cont组小鼠肝脏中MDA水平极显著升高(P<0.01),而黑参多糖给药组能够极显著降低因运动疲劳引起的小鼠肝脏中MDA水平(P<0.01)。如图3C所示,强制游泳的小鼠肝脏中GSH-Px含量与空白组相比略有升高但并无显著区别,只有100、200 mg/kg高剂量组处理后有显著提高(P<0.05)。图3B、D则显示了经黑参多糖处理可极显著提高小鼠运动疲劳后体内肝糖原水平(P<0.01),升高肝脏中SOD的活性。
这些结果表明,黑参多糖可明显降低小鼠因运动疲劳导致的肝部脂质过氧化水平,加速清除自由基能力,同时又能增强机体肝糖原的储备,提高运动耐力而缓解机体疲劳。
2.5 黑参多糖对骨骼肌中PGC-1α、PPARα基因表达的影响
2.5.1 提取总RNA的检测
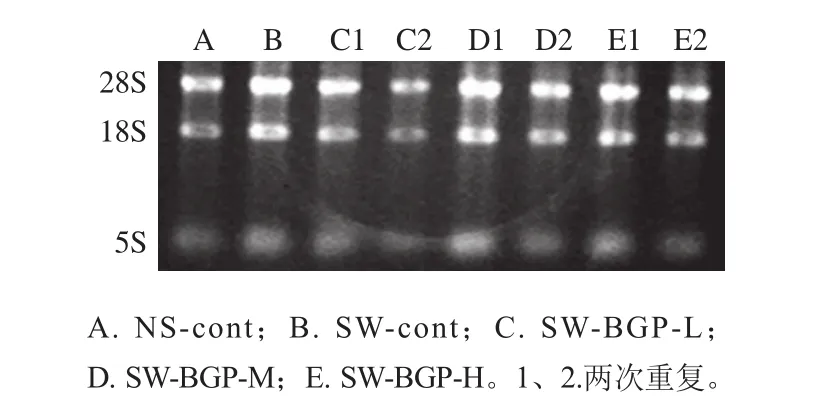
图 4 骨骼肌组织总RNA质量检测Fig. 4 Quality detection of total RNA extracted from skeletal muscle tissues
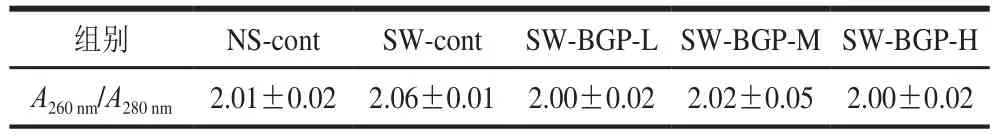
表 3 各组总RNA A260 nm/A280 nm比值Table 3 A260 nm/A280 nm ratio of total RNA in each group
如图4所示,从疲劳小鼠骨骼肌中提取的总RNA在18S、28S具有清晰的条带,并且A260nm/A280nm比值均在2.00~2.10之间,如表3所示,证明运用此方法提取的骨骼肌中总RNA具有较高的纯度和完整性。
2.5.2 qPCR分析结果
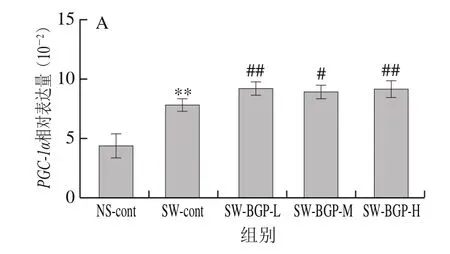

图 5 小鼠运动后骨骼肌中PGC-1α(A)、PPARα(B)基因的表达量Fig. 5 Expression of PGC-1α (A) and PPAR-α (B) genes in skeletal muscle of mice after exercise
图5 A、B显示了PGC-1α、PPAR-α基因在疲劳小鼠骨骼肌中的表达情况。与SW-cont组相比,黑参多糖各剂量组小鼠骨骼肌中PGC-1α、PPARα基因的表达量相比显著升高(P<0.05),表明黑参多糖调节与运动相关的基因,其响应于肌肉疲劳而发生。
2.6 黑参多糖对疲劳小鼠肝脏中IL-1β和TNF-α蛋白表达的影响

图 6 黑参多糖对疲劳小鼠肝脏中IL-1β、TNF-α蛋白表达的影响Fig. 6 Effect of BGP on IL-1β and TNF-α protein expression in liver of fatigued mice
如图6所示,疲劳会导致肝脏组织中IL-1β、TNF-α炎症蛋白表达量极显著上升(P<0.01)。而与SW-cont组比较,黑参多糖给药组可以下调IL-1β、TNF-α蛋白因子的表达,并具有极显著差异(P<0.01)。结果说明,黑参多糖可以用来改善小鼠机体疲劳是通过减轻疲劳致损的肝脏组织中炎症反应和提高机体免疫功能而发挥作用。
3 讨 论
目前,随着生活节奏的加快,工作和生活的压力不断加剧。因此,机体疲劳是常见的,甚至影响了人们的日常生活。一般认为,疲劳是连续工作或运动后效率下降的复杂现象,可分为精神疲劳和身体疲劳[10]。疲劳是一种生理性改变,主要表现为代谢产物积累而引起的肌肉张力和运动耐力降低[11-12]。由于现代医学手段对于诸如疲劳等一些轻度功能障碍还难以治愈,尤其是目前对于体内分子机制的认识还是有限的,人们逐渐关注功能性食品或传统药材潜在替代品,对这些替代物进行生物医学研究,以期解决这些复杂机体问题并促进健康状况。图1的结果显示,黑参多糖显著延长了小鼠力竭游泳时间(P<0.05),其中以SW-M组效果最佳,比SM-C游泳对照组延长了34.92%,表明其具有强效的抗疲劳作用。
通常来讲,运动会引起机体疲劳,加剧血乳酸在体内的堆积,积聚越多,疲劳程度就越严重。图2的结果显示,与NS-cont组相比,运动后血清中BLA含量显著升高(P<0.01),黑参多糖处理后会显著减少运动中BLA的生成,达到缓解机体疲劳的效果。血清中BUN一般用来评价机体代谢能力和承受负荷能力的指标。研究结果表明,与SW-cont组相比,黑参多糖可以极显著降低小鼠血清中BUN含量(P<0.01),表明黑参多糖可以减少疲劳机体内蛋白质的分解,提高机体运动负荷能力。而运动导致疲劳机体损伤同样会引发炎症反应并产生促炎因子IL-6,其是促炎细胞因子和肌肉疲劳的生物标志物[12]。由于IL-6水平在肌肉疲劳反应中增加[13-14],并且刺激对创伤或组织损伤的免疫应答,导致肌肉炎症。研究结果表明,运动后各剂量组IL-6水平均极显著高于NS-cont组(P<0.01),但与SW-cont组相比,经黑参多糖处理后又可防止肌肉疲劳介导的血清IL-6水平升高,表明黑参多糖可通过调节IL-6水平预防肌肉功能障碍或损伤达到抗疲劳作用目的。
肝脏组织中SOD作为生物体内清除自由基的首要物质,是生物体防御体系重要的抗氧化物酶[15-17],也是衡量机体自由基代谢的敏感指标;体内SOD活性维持一定水平,可反映机体过氧化程度,同时保护机体组织细胞免受损伤[17-21]。GSH-Px是体内重要的抗氧化剂和自由基清除剂,还能特异性催化谷胱甘肽对过氧化氢的还原反应,起到保护细胞膜的作用[22-25]。随着运动时间的延长,机体血糖水平下降会加剧机体疲劳,为维持正常功能,机体会过度分解储存在肝脏中的糖原转化成能量。所以,增加肝糖原储备,是保持血糖浓度稳定、延缓机体疲劳和维持正常生命体征的重要方式之一[26]。本研究结果显示,黑参多糖各剂量组可提高SOD和GSH-Px的活力,降低MDA含量,升高肝脏中肝糖原含量,这与姚乐辉[27]在评估化橘红抗疲劳活性和龚频等[28]研究魔芋多糖抗疲劳作用时得到的结果相似,表明黑参多糖可能是通过提高机体的抗氧化酶活性起到抗疲劳作用。
机体疲劳受损会在机体内会释放一些炎症因子,加剧炎症反应。而TNF-α、IL-1β作为重要的促炎因子,在加剧慢性炎症恶性循环的同时,对维持和延续炎症反应起到重要作用[29-31],而运动造成的疲劳损伤同样会诱导肝脏组织中的促炎因子IL-1β和TNF-α水平升高[32]。在本研究中,采用Western blotting分析方法,进一步测定黑参多糖对促炎因子IL-1β和TNF-α的影响。如图6所示,与NS-cont组相比,游泳对照组中IL-1β、TNF-α的表达量明显升高,导致小鼠炎症反应加剧,而经各剂量黑参多糖处理后抑制了肝脏中与炎症反应相关的IL-1β和TNF-α表达。
PGC-1α是能量代谢途径中众多转录因子的共激活因子和多效调节因子,参与到机体调节氧化代谢反应过程[33],在能量代谢平衡中起到至关重要的作用。PPARα是配体激活的转录因子核激素受体超家族的成员,主要在脂肪酸代谢水平高的组织中表达,如肝脏、骨骼肌等。同时,PPARα可通过调控靶基因的表达,提高对脂肪酸的利用,增强机体抗氧化能力,调节机体许多生理功能包括能量代谢、生长发育[34]。qPCR分析结果显示,黑参多糖各剂量组小鼠骨骼肌中PGC-1α、PPARα mRNA表达显著高于游泳对照组,表明黑参多糖可通过上调与运动相关的能量代谢调节因子来改善机体运动能力,发挥抗疲劳作用。
本研究成功建立一种由肌肉锻炼引起的疲劳模型,通过喂饲黑参多糖研究其抗疲劳作用,结果表明黑参多糖可通过增强机体抗氧化酶系统的活力,调节因机体疲劳受损而诱发的炎症反应,同时显著提高PGC-1α、PPARα的表达水平发挥抗疲劳作用。
