6 种5,7-二羟基黄酮对巨噬细胞M1极化的影响
2020-03-31郑梦菲
郑梦菲,刘 健,屈 玮
(合肥工业大学食品与生物工程学院,安徽 合肥 230009)
巨噬细胞是机体最重要的免疫细胞之一,在炎症反应中发挥着重要作用,而炎症又与代谢性疾病的发生与发展息息相关[1-3]。在不同的微环境影响下,巨噬细胞可以极化为不同的亚型,发挥不同的作用[4]。在体外培养条件下,不同的刺激方式也可以诱导巨噬细胞向不同方向极化。脂多糖(lipopolysaccharide,LPS)可以诱导巨噬细胞转化为经典活化型巨噬细胞,也称作M1型巨噬细胞[5]。LPS通过与细胞膜表面Toll样受体4结合,进而激活炎症信号通路,促进细胞高表达表面抗原分化簇(cluster of differentiation,CD)274、CD38、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),并且分泌多种促炎性因子,如白介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP1)等[6-8]。
黄酮类化合物泛指由2 个苯环(A环与B环)通过中间三碳原子相连而成的一系列化合物(图1),水果、蔬菜以及茶、红酒等植物来源的饮品是人体摄取黄酮类化合物的主要食物来源[9-10]。黄酮类化合物根据其结构不同可分类为黄酮类、黄酮醇类、二氢黄酮类、异黄酮类等亚型[11]。有研究报道,目前发现数目最多且最常见的天然黄酮主要是黄酮类和黄酮醇类,木犀草素、芹菜素、白杨素和槲皮素、杨梅素、山柰酚是食物中最常见的黄酮类和黄酮醇类化合物[9,12]。另一方面,这6 种黄酮类化合物还都具有5,7-二羟基黄酮的结构特征,如图1所示,它们的结构差异仅在于C环3位有无羟基取代和B环上的羟基取代数目不同。
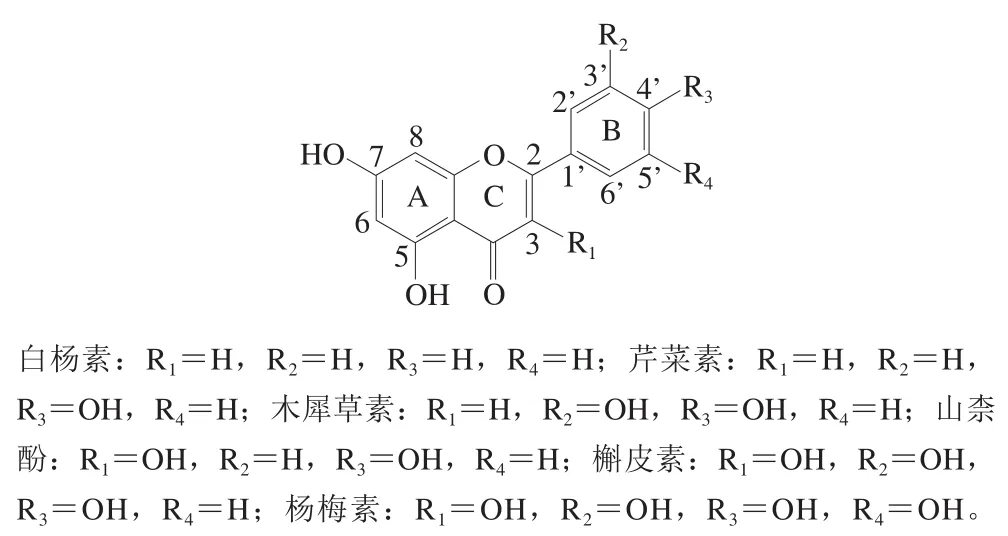
图 1 6 种黄酮的结构Fig. 1 Chemical structures of six flavonoids
本研究以LPS刺激RAW264.7细胞建立炎症模型,考察木犀草素、芹菜素、白杨素、槲皮素、杨梅素及山柰酚这6 种最为常见的食物源黄酮抑制巨噬细胞向M1极化的活性强弱,并探究其抗炎活性与结构特征的关系,为黄酮化合物抗炎的构效关系研究提供一定参考。
1 材料与方法
1.1 材料与试剂
小鼠单核巨噬细胞系RAW264.7 中国医学科学院基础医学研究所细胞中心。
木犀草素(纯度≥98%,生产批号Lot.RQ3018R205) 上海华壹生物科技有限公司;芹菜素(纯度≥98%) 南京春秋生物工程有限公司;槲皮素(纯度≥95%,生产批号Lot. SLBH4526V)、杨梅素(纯度≥99%,生产批号Lot. BCBS7165V)、山柰酚(纯度≥97%,生产批号Lot. BCBS9762V)、白杨素(纯度≥97%,生产批号Lot. STBF6934V)(均为色谱纯)及二甲基亚砜(dimethyl sulphoxide,DMSO)、LPS、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Sigma公司;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;APC标记鼠抗CD274、PE标记鼠抗CD38美国BioLegend公司;β-actin抗体、核因子κB抑制蛋白(inhibitor of nuclear factor kappa-B,IκB)α抗体、pIκBα抗体、二抗 美国Cell Signaling Technology公司;TRIzol、逆转录试剂盒、SYBR Green Mix 日本TaKaRa公司;异丙醇、氯化钠等其他试剂(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
ZHJH-C超净工作台 上海智诚分析仪器制造公司;Forma Series II Water Jacket细胞培养箱、Multiskan GO全波长酶标仪 美国Thermo Scientific公司;MoFlo XDP流式细胞仪 美国Beckman Coulter公司;Mini-PROTEAN Tetra Western blot电泳转膜仪、IQ2荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;ImageQuantLAS 400 mini荧光成像系统 瑞典GE Healthcare公司。
1.3 方法
1.3.1 细胞培养
采用含10% FBS的DMEM高糖培养基,将RAW264.7细胞于37 ℃、5% CO2培养箱中培养。
1.3.2 MTT法检测细胞活性
(3)良好的前期旅游基础优势。主题文化游、乡村休闲游、农耕体验游、现代工业游等旅游业态基本形成,丰富了旅游内涵,为大力发展全域旅游打下了坚实的基础。长沙市望城区将旅游景点与体育赛事结合,已举行千龙湖国际龙舟赛、黑麋峰世界自行车速降赛、环法自行车中国赛等具有国际影响力的体育赛事。宁乡市统筹规划美丽乡村建设,已打造关山古镇、湘都农业生态园、丰收湾、稻花香农趣园、石仑关等特色乡村旅游产品,而且宁乡的灰汤已于2016年获批全国首批“国家康养旅游示范基地”。长沙县的开慧镇则结合“杨开慧故居”和“瓜果采摘体验游”,形成了“红色旅游+绿色旅游”的特色旅游路线。
将RAW264.7细胞接入96 孔板中,细胞贴壁后,分别加入终浓度20 μmol/L的6 种黄酮溶液(DMSO配制),培养24 h后,每孔加入20 μL 5 mg/mL MTT溶液继续孵育4 h。吸去上清液,每孔加入150 μL DMSO,置于摇床上低速振荡10 min,使结晶充分溶解。用酶联免疫检测仪于490 nm波长处测定各孔的光密度值。以不接种细胞的等体积DMEM高糖培养基为空白组,以加入与黄酮溶液等体积的DMSO为对照组。细胞存活率按下式计算。

1.3.3 流式细胞分析
将RAW264.7细胞接入12 孔板中,待细胞长至约80%融合时,同时加入终浓度20 μmol/L的6 种黄酮溶液(DMSO配制)和终质量浓度为100 ng/mL的LPS处理24 h,以添加等体积DMSO为对照,处理结束后吸去上清液,用磷酸盐缓冲液(phosphate buffered solution,PBS)清洗1 遍,每孔加入1 mL含体积分数5% FBS的PBS,用移液枪吹打细胞使其脱落,并将细胞悬液转移至1.5 mL的离心管中,4 ℃、400×g离心4 min,弃去900 μL上清液,加入封闭液后重悬,于冰上摇床封闭20 min,再在避光条件下加入CD274和CD38荧光抗体,于冰上摇床避光标记40 min。标记结束后加入400 μL含5% FBS的PBS,吹匀细胞后用流式细胞仪检测。APC通道接收CD274荧光信号,PE通道接收CD38荧光信号,用流式细胞分析软件FlowJo处理得到不同信号通道的抗体平均荧光强度。
1.3.4 总蛋白质提取及Western blot检测
将RAW264.7细胞接入24 孔板中,待细胞长至约80%融合时,加入终浓度20 μmol/L的6 种黄酮溶液(DMSO配制)或等体积DMSO处理12 h,再加入终质量浓度为100 ng/mL的LPS处理30 min后,立即吸去上清液,用PBS清洗1 遍,每孔加入300 μL含蛋白酶和磷酸酶抑制剂的RTPA裂解液,用移液枪反复吹打细胞并转移至1.5 mL的离心管中。充分裂解后,4 ℃、12 000×g离心30 min,收集上清液并转移至新的离心管中,再加入上清液体积1/4的5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,于100 ℃煮沸10 min,等体积等蛋白质量上样,进行SDS-聚丙烯酰胺凝胶电泳,然后转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。转膜结束后,将PVDF膜放入含质量分数5%脱脂奶粉的TBST溶液中室温封闭2 h。封闭结束后,将膜转移至一抗(1∶2 000,用含质量分数5%牛血清白蛋白的TBST稀释)中,4 ℃孵育过夜。用TBST洗膜3 次,每次10 min,然后转移至二抗(1∶5 000,用含质量分数5%牛血清白蛋白的TBST稀释)中,室温孵育2 h。洗膜后进行化学发光显影,放入荧光成像系统曝光拍照。利用图像处理软件ImageJ进行灰度分析,pIκB/IκB表达量以pIκB条带与IκB条带灰度的比值表示。
1.3.5 总RNA提取及定量PCR分析
将RAW264.7细胞接入24 孔板中,待细胞长至约80%融合时,先加入终浓度20 μmol/L的6 种黄酮溶液(DMSO配制)或等体积的DMSO处理12 h,再加入终质量浓度为100 ng/mL的LPS处理4 h,处理结束后吸去上清液,用PBS清洗1 遍,利用TRIzol试剂提取总RNA。按照逆转录试剂盒说明书步骤合成cDNA。建立20 μL定量PCR反应体系:10 μL SYBR Green Mix、0.4 μL上游引物、0.4 μL下游引物、8.2 μL双蒸水和1 μL cDNA。混匀体系,5 000×g离心3 min后进行定量PCR分析。采用ΔΔCt阈值循环法,以β-actin为内参计算样本间基因表达水平的相对差异。定量PCR引物序列详见表1。
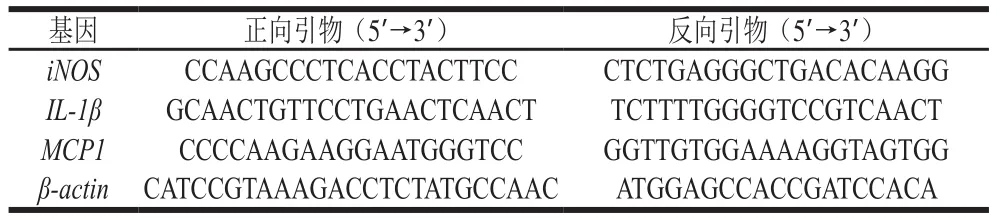
表 1 定量PCR引物序列Table 1 Primer sequences used for quantitative real-time PCR
1.4 数据处理及分析
实验结果用平均值±标准差表示。采用Origin软件进行数据统计学分析,组间比较采用t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 6 种黄酮对巨噬细胞活性的影响
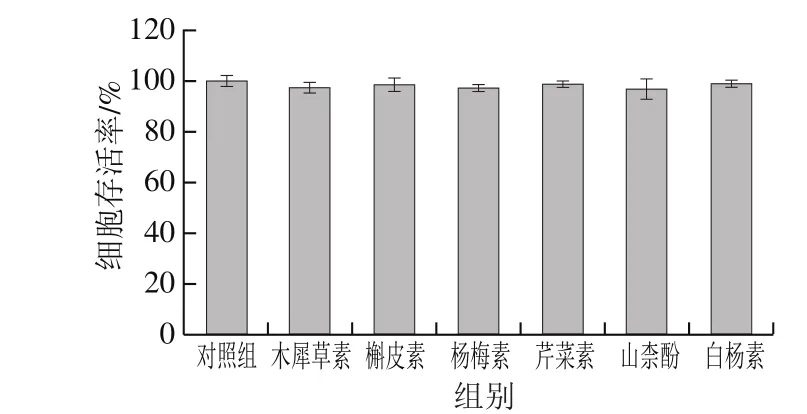
图 2 6 种黄酮对RAW264.7细胞活性的影响Fig. 2 Effect of six flavonoids on the viability of RAW264.7 cells
由图2可知,与对照组相比,20 μmol/L的6 种黄酮溶液处理对RAW264.7细胞活性均无显著影响,说明这6 种黄酮化合物在20 μmol/L条件下不影响巨噬细胞的正常生长。因此后续实验采用20 μmol/L的木犀草素、槲皮素、杨梅素、芹菜素、山柰酚及白杨素处理经100 ng/mL LPS诱导的RAW264.7细胞炎症模型,并比较它们的抗炎活性。
2.2 6 种黄酮对LPS诱导的巨噬细胞表面标记蛋白的影响
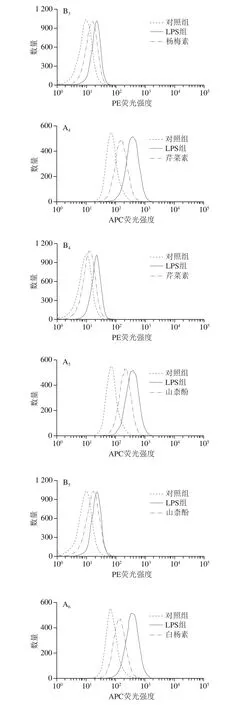
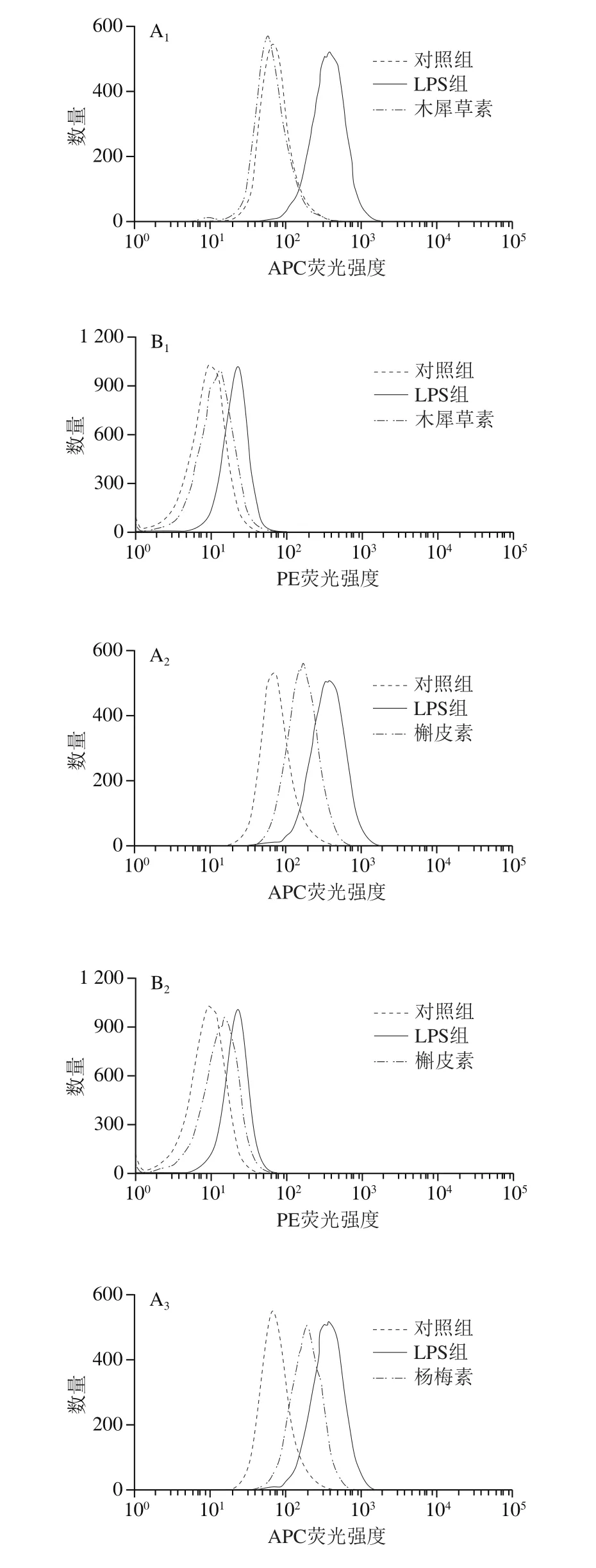
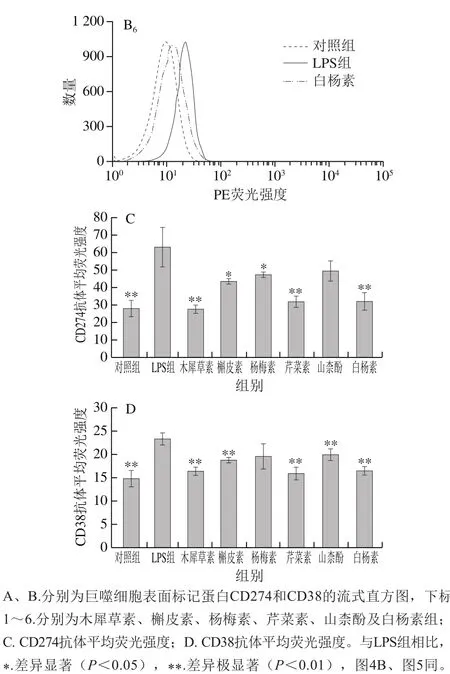
图 3 6 种黄酮对LPS诱导的巨噬细胞表面标记蛋白表达的影响Fig. 3 Effect of six flavonoids on the expression of LPS-induced macrophage markers CD274 and CD38
由于RAW264.7细胞从接受LPS刺激到表面抗原CD的转录翻译需要较长的时间,因此,选择在LPS处理24 h后检测RAW264.7细胞表面标记蛋白的表达情况。如图3所示,LPS处理极显著增强了CD274和CD38抗体的平均荧光强度,而在LPS刺激同时分别添加6 种黄酮化合物处理,对LPS引起的CD274和CD38抗体荧光强度的增加均具有不同程度的抑制效果。其中,添加木犀草素、芹菜素或白杨素对LPS诱导的M1巨噬细胞CD274和CD38表达的抑制作用较强(P<0.01);槲皮素对CD274和CD38表达也有一定程度的抑制效果(P<0.05,P<0.01)。以上结果表明,木犀草素、芹菜素和白杨素3 种黄酮类化合物抑制LPS诱导巨噬细胞表面标记蛋白表达的活性强于槲皮素、杨梅素和山柰酚这3 种黄酮醇类化合物,说明在其他位点的取代情况相同时,C环上3位的羟基取代可能不利于黄酮类化合物的活性。
2.3 6 种黄酮对LPS诱导的巨噬细胞中IκB磷酸化的影响
核因子-κB(nuclear factor kappa B,NF-κB)信号通路对调控巨噬细胞的极化及炎症反应的发生都发挥着重要作用[24-25]。在静息状态的巨噬细胞中,NF-κB与IκB结合而滞留在细胞质中。当LPS与巨噬细胞表面受体结合,触发胞内级联信号转导,能够激活IκB激酶(IκB kinase,IKK),活化的IKK促使IκB发生磷酸化而被降解,进而导致NF-κB解除抑制并转位入核,与相关基因启动子上NF-κB的结合序列结合,从而启动基因转录[26-27]。为探讨6 种膳食黄酮对NF-κB信号通路活化的影响,通过Western blot检测巨噬细胞中IκB总蛋白及其磷酸化蛋白pIκB的表达水平。如图4所示,LPS处理30 min时极显著上调了IκB的磷酸化水平,导致IκB水平降低;在LPS刺激前,用木犀草素、槲皮素或芹菜素预处理12 h能够显著降低LPS诱导的IκB磷酸化水平的上调,抑制IκB降解,即降低pIκB/IκB表达量,说明木犀草素、槲皮素和芹菜素可以抑制LPS诱导的巨噬细胞中NF-κB信号通路的激活,其中木犀草素的抑制效果最明显;而用杨梅素、山柰酚或白杨素预处理的巨噬细胞中pIκB/IκB表达量有所降低,但与LPS组差异不显著。综上说明木犀草素、槲皮素和芹菜素可以有效抑制巨噬细胞中NF-κB信号通路的激活。
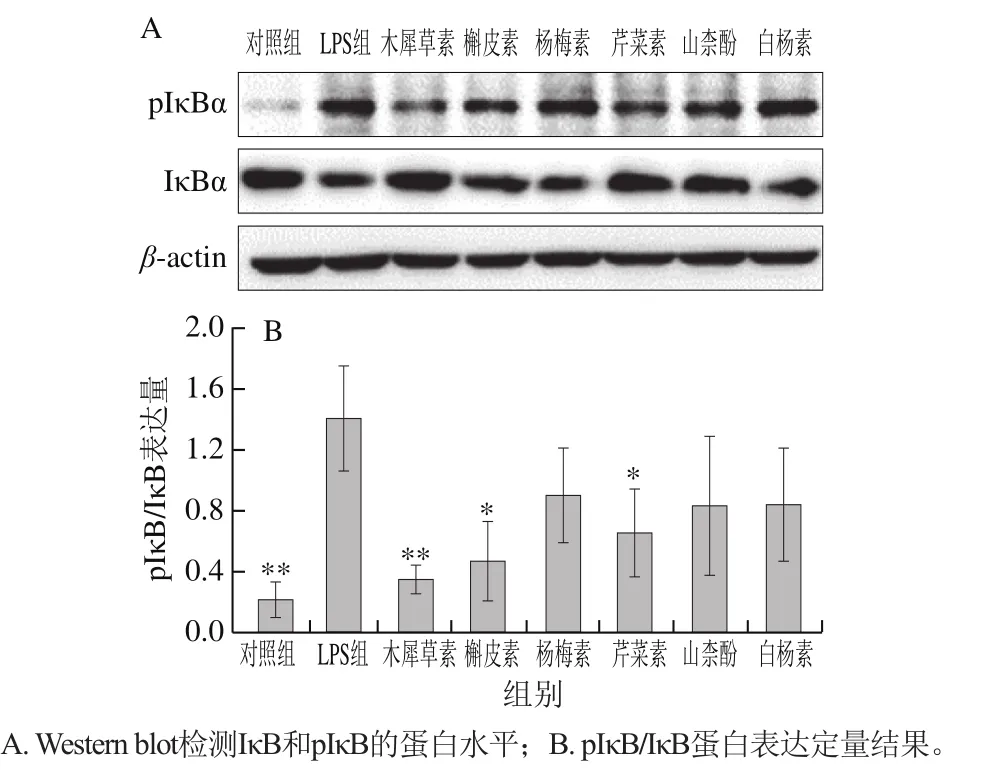
图 4 6 种黄酮对LPS诱导的巨噬细胞中IκB磷酸化的影响Fig. 4 Effect of six flavonoids on LPS-induced IκB phosphorylation
2.4 6 种黄酮对LPS诱导的M1型巨噬细胞标记基因表达水平的影响
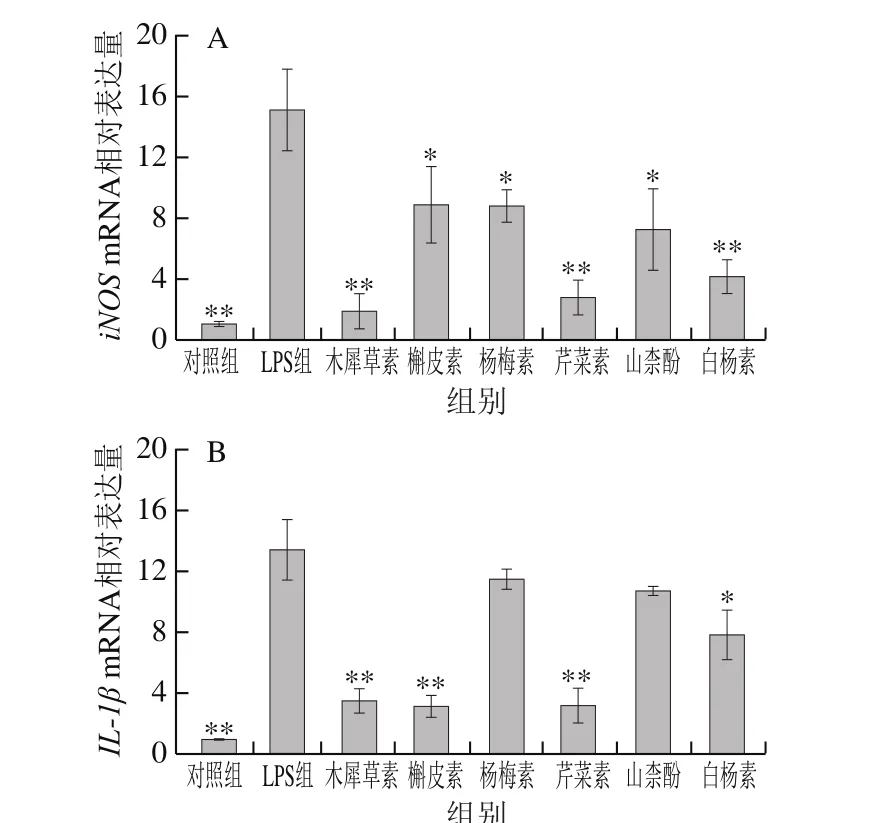
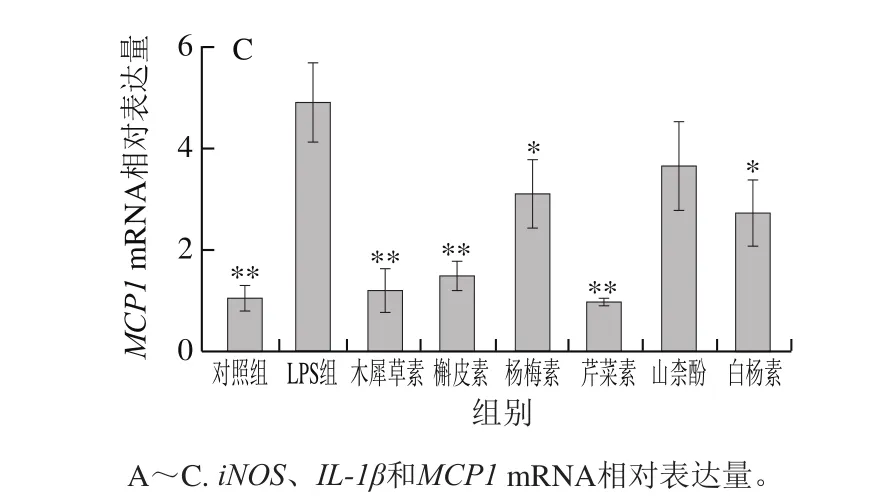
图 5 6 种黄酮对LPS诱导的M1型巨噬细胞标记基因表达的影响Fig. 5 Effect of six flavonoids on the expression of M1-type macrophage marker genes
经LPS刺激后,M1型巨噬细胞标记基因iNOS mRNA相对表达水平显著升高(P<0.05)。在LPS刺激前用木犀草素、芹菜素或白杨素预处理12 h,可以极显著降低LPS诱导的iNOS mRNA表达水平的升高(P<0.01),此外槲皮素、杨梅素和山柰酚预处理也有一定程度的改善作用(P<0.05)(图5A)。木犀草素、槲皮素或芹菜素预处理均极显著抑制了LPS诱导的M1型巨噬细胞促炎性因子IL-1β和MCP1 mRNA相对表达水平的升高(P<0.01),白杨素预处理使IL-1β和MCP1 mRNA相对表达水平显著降低(P<0.05),其抑制作用不如木犀草素、槲皮素和芹菜素明显;杨梅素也在一定程度上抑制了IL-1β和MCP1的mRNA相对表达水平(图5B、C)。结果表明,木犀草素、槲皮素和芹菜素对炎性基因IL-1β和MCP1 mRNA表达的抑制活性显著强于杨梅素、山柰酚和白杨素,这一结果与上述6 种黄酮抑制IκB磷酸化的活性强弱趋势基本一致,这可能是因为NF-κB信号通路参与调控炎性基因IL-1β和MCP1的转录[28]。另外,木犀草素、芹菜素和白杨素对M1型巨噬细胞标记物iNOS表达的抑制活性强于槲皮素、杨梅素和山柰酚,这与上述6 种黄酮抑制CD274和CD38表达的活性强弱趋势一致,进一步说明了木犀草素、芹菜素和白杨素这3 种黄酮类化合物对LPS诱导的巨噬细胞M1极化的抑制活性强于另外3 种黄酮醇类化合物(槲皮素、杨梅素和山柰酚),表明C环上3位的羟基取代可能不利于黄酮类化合物抑制巨噬细胞的M1极化。
3 讨 论
目前,对黄酮类化合物抗炎活性的研究大多通过检测炎性信号通路中相关蛋白的表达及炎性因子的水平。本实验考察了NF-κB信号途径中关键蛋白IκB的磷酸化水平及促炎性因子iNOS、IL-1β和MCP1 mRNA相对表达水平。结果表明,6 种黄酮在抑制IκB磷酸化和IL-1β及MCP1 mRNA相对表达水平这两方面的活性强弱趋势一致,木犀草素、槲皮素和芹菜素能够有效抑制巨噬细胞中NF-κB信号通路的活化,山柰酚和白杨素对IκB磷酸化没有显著抑制作用,这与之前研究结果[21,27,29]一致,而杨梅素对IκB磷酸化的影响目前鲜见报道。
NF-κB信号通路激活所调控的核内相关基因的转录以及PCR检测结果都只反映了其在巨噬细胞中的转录水平,不足以证明巨噬细胞的最终极化状态。表面抗原CD是细胞分化不同阶段及活化过程中出现或消失的细胞表面标记蛋白,为不同类型或分化阶段细胞所特有,其表达水平反映了细胞的分化程度和功能状态[30],因此,采用流式细胞术检测细胞表面抗原CD可以更精确地定义细胞类型。M1型巨噬细胞表面高表达CD274、CD38,而M2型巨噬细胞表面高表达CD206、CD301,所以根据表面标记蛋白的表达水平可区分M1和M2型巨噬细胞[31-32]。本实验通过流式细胞术分析了6 种黄酮对巨噬细胞表面标记蛋白CD274和CD38表达的影响,结果表明,木犀草素、芹菜素和白杨素抑制LPS诱导的M1型巨噬细胞CD274或CD38表达的活性均强于槲皮素、杨梅素和山柰酚,这与木犀草素、芹菜素和白杨素对M1型巨噬细胞另一标记物iNOS的mRNA相对表达抑制作用结果一致。综合上述结果可以发现,木犀草素抑制巨噬细胞向M1型极化的活性较槲皮素强,芹菜素的抑制活性也较山柰酚强。分析6 种5,7-二羟基黄酮的结构特征(图1)发现,木犀草素和槲皮素、芹菜素和山柰酚在B环上的羟基取代数目和位置相同,而槲皮素较木犀草素在C环3位多出一个羟取代基;芹菜素和山柰酚的结构差异与此相同,推测当B环的羟基取代情况相同时,C环上3位的羟基取代不利于黄酮类化合物抑制巨噬细胞的M1极化。
进一步分析,当C环的羟基取代情况相同时,B环上的羟基取代对黄酮化合物抑制巨噬细胞M1极化的影响,本实验通过测定发现,3 种黄酮类化合物对IκB磷酸化水平的抑制活性为木犀草素>芹菜素>白杨素,对炎性因子IL-1β、MCP1 mRNA表达水平的抑制活性为木犀草素/芹菜素>白杨素。根据三者的结构(图1)可知,与木犀草素相比,芹菜素缺少3’位的羟基取代,白杨素缺少3’、4’位的羟基取代,这说明3’、4’位的羟基有利于增强黄酮类化合物抑制巨噬细胞炎性的活性。在3 种黄酮醇类化合物中,与槲皮素相比,山柰酚缺少3’位的羟基取代,其活性远低于槲皮素,也同样说明3’、4’位羟取代基的重要作用。
天然黄酮化合物的活性作用取决于其结构类型、羟基化程度及其他官能团的取代情况[33]。因此,针对黄酮类化合物的生物活性进行构效关系的探讨尤为重要。本实验对6 种5,7-二羟基黄酮抑制巨噬细胞M1极化的活性与其结构特征的关系进行了总结,以期为食物源黄酮化合物的进一步开发与利用提供思路。
