微射流对野生黑豆蛋白结构及功能性的影响
2020-03-31吴海涛
吴海涛
(黑龙江八一农垦大学理学院,黑龙江 大庆 163319)
野生黑豆是植物大豆属的带有黑色种皮的植物油料,又称零乌豆、马料豆、野料豆、细黑豆,是世界上重要的农业商品之一,广泛分布于中国东北地区[1]。较黑豆相比野生黑豆蛋白(black bean protein isolate,BBPI)质量分数超过35%,营养价值远超其他色系大豆,被冠以“植物蛋白之王”的美誉。野生黑豆营养丰富,富含生物活性肽、大豆皂醇、皂苷、异黄酮、花青素、纤维和矿物质等,已发现野生黑豆中的一些生物活性肽具有抗癌、降高血压、降胆固醇、降血脂、抗氧化作用和免疫调节特性[2-3]。其作为一种植物蛋白资源,较大豆蛋白更具优越性,被广泛应用于食品加工。
近年来,部分科研人员利用物理、化学改性和酶诱导对蛋白进行处理,如超声波改性、高压均质处理、热处理、酸碱处理、美拉德交联反应等方法[4-7]。为更好地利用BBPI,本实验通过微射流均质对BBPI进行改性。动态高压微射流是一种集合了物料输送、混合、粉碎等操作的新兴食品加工技术[8]。加工过程中产生的高速剪切力和空化作用可以促使大分子聚合物降解,并有效改善蛋白乳化性、起泡性、溶解性等功能性质,与传统高压均质技术相比,微射流技术能源利用率低、易操作且空化效果更强。胡洋等[9]研究高压微射流对木薯淀粉结构及性质的影响,发现微射流破坏了木薯淀粉的结构,使其发生部分糊化,淀粉结晶度下降,溶解性提高。许艳华等[10]利用高压微射流技术处理大豆蛋白发现,在0.1~120 MPa的压力范围内会使大豆分离蛋白颗粒破碎,且破坏程度随着压力的增加而加剧,其溶解度、泡沫稳定性和持油性均得到了改善。涂宗财等[11]利用动态高压均质处理蛋清蛋白,研究发现乳清蛋白的结构及其流变性和黏度在微射流作用下发生改变,蛋白粒径减小,黏度增加。但微射流用于BBPI的改性还鲜有报道。
本研究的目的是探究微射流均质对BBPI乳化特性及蛋白二级结构的影响,并从蛋白质结构变化角度探讨其作用机理,系统研究均质条件对蛋白类物质的影响,以期为BBPI实际生产提供理论指导,为生产出令消费者满意的功能蛋白类食品提供理论参考。
1 材料与方法
1.1 材料与试剂
野生黑豆由吉林省六谷农业开发有限公司提供;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三硝基苯磺酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠、正己烷、盐酸等均为国产分析纯试剂。
1.2 仪器与设备
PHSJ-4A型实验室pH计 上海雷磁公司;锤片式粉碎机 天津泰斯特仪器有限公司;THZ-80型水浴恒温振荡器 江苏金坛亿通电子有限公司;CR22G型高速冷冻离心机、F-4500荧光分光光度计 日本HITACHI公司;M-110EH30型高压微射流均质机 上海鲤跃精密机械贸易有限公司;79-1型磁力加热搅抖器 武汉格莱莫检测设备有限公司;XW-80A型漩涡混合器 上海青浦沪西仪器厂;Raman Station 400型拉曼光谱仪 美国Perkin Elmer公司。
1.3 方法
1.3.1 BBPI的制备
工艺流程:野生黑豆→粉碎、过筛→正己烷萃取→黑豆粉→加碱液调pH值至8.0→离心分离→取上清液→加酸液调pH值至4.0→离心分离→取沉淀→反复水洗和离心→BBPI
具体操作参考O’Donnell等[12]的方法,稍加改动。原料野生黑豆经去皮、粉碎过100 目筛,在37 ℃条件下用正己烷萃取制备脱脂黑豆粕,脱脂黑豆粕按1∶10(m/V)与蒸馏水混合,然后用2 mol/L的NaOH溶液调节pH值至8.0,在50 ℃水浴锅中搅抖2 h后,将其悬浮液4 ℃、10 000×g离心30 min,取离心后所得上清液用2 mol/L HCl溶液调节pH值至4.0。静置后4 ℃、6 000×g离心30 min,将离心所得的BBPI沉淀水洗3 次,最后将沉淀分散于水中并用2 mol/L NaOH溶液调节pH值至7.0。将此时得到的BBPI溶液置于-40 ℃的冰箱中预冻48 h,然后进行冷冻干燥,蛋白溶液冷冻干燥后粉碎即得粉末状BBPI,于4 ℃冰箱保存。
1.3.2 微射流处理
将10 g样品溶解于500 mL蒸馏水中,置于高压微射流均质机中,在不同压力(0、42.5、89.0、123.5、152.0、175.5 MPa)下均质2 次。对微射流处理的样品温度和pH值进行调节,酶解温度60 ℃,酶解时间2 h,酶解pH 8.6,95 ℃温度灭酶5 min,真空浓缩至固形物质量分数为15%左右,冷冻干燥得到BBPI样品[13]。
1.3.3 溶解性测定
根据Samoto等[14]的方法测定BBPI溶解性。称取100 mg蛋白样品分散于10 mL的蒸馏水中,20 ℃下磁力搅抖30 min,10 000×g离心20 min。取上清液溶于0.01 mol/L磷酸盐缓冲溶液(pH 7.0)稀释10 倍,采用Lowry法测定蛋白质量浓度,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度采用公式(1)计算。

1.3.4 表面疏水性测定
根据Kato[15]和王中江[16]等的方法使用8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid hydrate ammonium salt,ANS)作为荧光探针测定BBPI的表面疏水性。将微射流均质处理的BBPI溶于0.01 mol/L磷酸盐缓冲溶液(pH 7.0),室温下搅抖1.0 h,10 000×g离心30 min,取上清液用Lowry法测定蛋白质量浓度,用磷酸盐缓冲溶液分别稀释至质量浓度0.150、0.075、0.038 mg/mL和0.019 mg/mL。分别取不同质量浓度的稀释样品4 mL,实验中激发波长λex=390 nm,发射波长λem=470 nm,夹缝宽度5 nm,扫描速率10 nm/s。取4 mL不同浓度梯度的样品溶液,分别加入20 μL浓度8 mmol/L的ANS溶液(用0.01 mol/L、pH 7.0的磷酸盐缓冲液配制),经振荡后静置3 min,再测定样品荧光强度。用F-4500荧光光谱仪测量荧光强度,以荧光强度比蛋白质量浓度作图,曲线最初斜率表示表面疏水性。
1.3.5 粒径分布测定
粒径分布测定参照文献[13]。将BBPI样品用激光粒度分布仪进行粒子分布测定,用50 mmol/L的磷酸盐缓冲液(pH 7.0)将样品稀释为1 mg/mL,测定参数为:样品折射率为1.5,当折光率稳定在8%~12%或散射的偏振强度差稳定在45%~55%时开始测定。
1.3.6 乳化性和乳化稳定性的测定
用0.05 mol/L pH 7.0磷酸盐缓冲液中配制1 mg/mL的BBPI溶液,加入大豆油均质(10 000 r/min、10 s)2 遍,形成均一的乳化液。均质后,分别在0、10 min取1 mL新制备的乳化液,用蒸馏水稀释100 倍,然后再取1 mL被稀释的乳化液,用质量分数0.1% SDS稀释10 倍。将最后溶液在500 nm波长处进行吸光度测定。乳化稳定性指数(emulsion stability index,ESI)和乳化活性指数(emulsifying activity index,EAI)分别采用公式(2)、(3)[17]进行计算。

式中:A0为均质后迅速被稀释的乳化液的吸光度;ΔA为乳化液在0 min和10 min的吸光度差值;t为时间/min。
1.3.7 拉曼光谱分析
参考张萍等[18]的方法,将BBPI溶解于磷酸盐缓冲溶液(pH 7.0、0.01 mol/L)中,制成质量浓度为100 mg/mL的溶液进行测定。激发光波长785 nm,发射功率为300 mW,扫描范围400~2 000 cm-1,扫描时间每次60 s,积分10 次,4 次扫描进行累加。以苯丙氨酸((1 003±1)cm-1)作为归一化因子,得到BBPI的拉曼光谱。谱图基线校正、谱峰归属查找采用Peakfit 4.12软件。以苯丙氨酸谱峰((1 003±1)cm-1)的强度作为归一化因子,得到微射流均质处理的BBPI的拉曼光谱,采用Origin 8.5软件绘制。
1.4 数据统计方法
采用SPSS 20.0软件对数据进行差异显著性分析及相关性分析,其他数据拟合处理采用Origin 8.5软件。
2 结果与分析
2.1 微射流均质对BBPI溶解性的影响
由图1可知,微射流均质能显著增强BBPI溶解性(P<0.05),随着均质压力的增加,BBPI溶解性逐渐上升,这主要是由于微射流均质诱导蛋白中不可溶性分子发生降解,进而溶解性增加,压力大于152.0 MPa时,BBPI溶解性下降,Cano-Medina等[19]研究发现超强的剪切作用力会破坏蛋白质分子的空间结构,促进蛋白质分子间相互作用形成聚集,这与本实验结果一致。
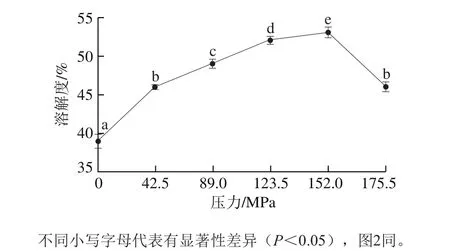
图 1 均质压力对BBPI溶解性的影响Fig. 1 Effect of homogenization pressure on solubility of BBPI
2.2 微射流均质对BBPI表面疏水性的影响
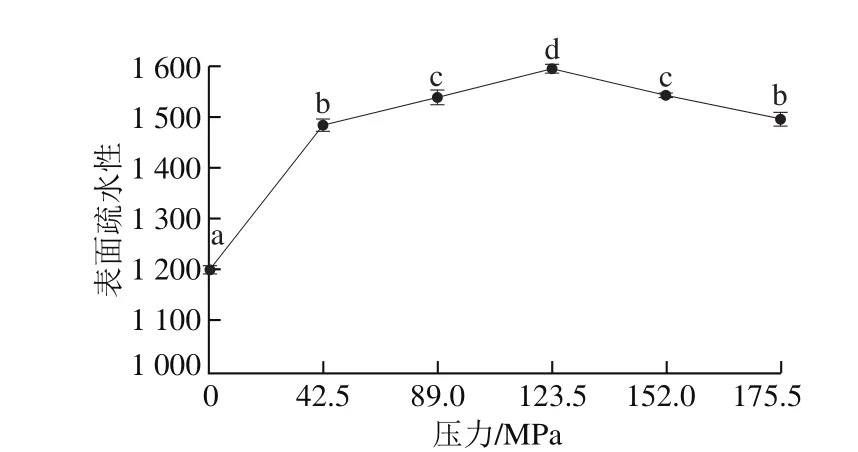
图 2 均质压力对BBPI表面疏水性的影响Fig. 2 Effect of homogenization pressure on surface hydrophobicity of BBPI
由图2可知,微射流均质后BBPI的表面疏水性有不同程度的增强,这进一步证实了在高速剪切力下BBPI结构解折叠现象会引起表面疏水性的增加。在均质压力42.5~123.5 MPa时,BBPI表面疏水性随着压力的增加而增大,而在均质压力超过123.5 MPa时,BBPI表面疏水性随着均质压力的增加而增加[20]。
2.3 微射流均质对BBPI粒径分布的影响
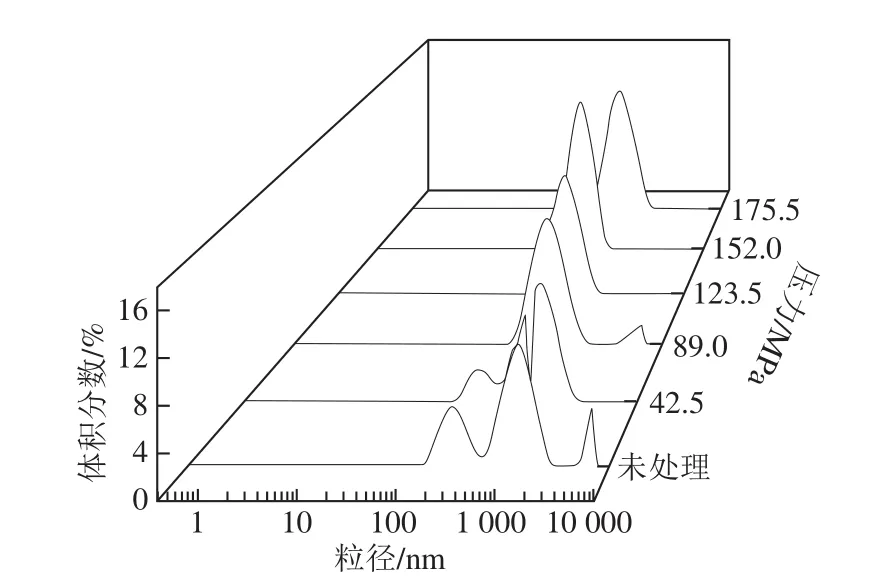
图 3 均质压力对BBPI粒径分布影响Fig. 3 Effect of homogenization pressure on particle size distribution of BBPI
由图3可知,随着微射流压力增加,BBPI溶液的粒径分布逐渐向小粒径方向移动,呈现“瘦高”状,且由多峰转变为单峰,当射流空化压力为123.5 MPa时,乳液粒径最小。这可能是乳液经微射流处理后在狭小的空间被多次碰撞,剪切形成较小的颗粒。但是随着压力增加,黑豆分离蛋白之间相互作用加强,蛋白质形成直径较大的颗粒,从而使粒径有所提高,粒度分布范围变宽。这与李良等[13]的研究结果一致。
2.4 微射流均质对BBPI乳化性的影响
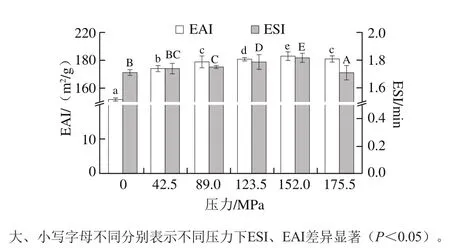
图 4 均质压力对BBPI乳化性影响Fig. 4 Effect of homogenization pressure on emulsifying activity of BBPI
如图4所示,与未处理BBPI相比,微射流均质处理能显著提高BBPI乳化性,是因为BBPI会随着溶解性的增加向油-水界扩散,形成稳定的乳化体系,蛋白乳化活性与溶解性呈正相关,随着均质压力增加而增大,蛋白乳化稳定性也依赖于蛋白质表面和侧链上氨基酸疏水性[17],这与2.1、2.2节结论一致。研究发现,BBPI在微射流处理下发生解折叠,表现为表面疏水性的增强,蛋白质疏水性增加也是乳化性提高的重要影响因素[21]。
2.5 微射流均质对BBPI拉曼光谱的影响分析结果

图 5 不同均质条件下BBPI拉曼光谱Fig. 5 Raman spectra of BBPI with different microfluidization treatments
不同微射流均质处理条件下BBPI在波数为400~2 000 cm-1的拉曼光谱如图5所示,相关特征峰根据已有研究[22],指认结果如表1所示。由于拉曼光谱的强度与散射中心的数目成正比,谱线强度的变化即意味着散射中心(包括基团和化学键)数目的变化,如果谱带位移,则可能是相应的基团或化学键受到处理而发生变化的缘故。根据表1中振动来源与波数的对应关系可在图5中标注出不同微射流均质处理条件下BBPI的拉曼谱带。
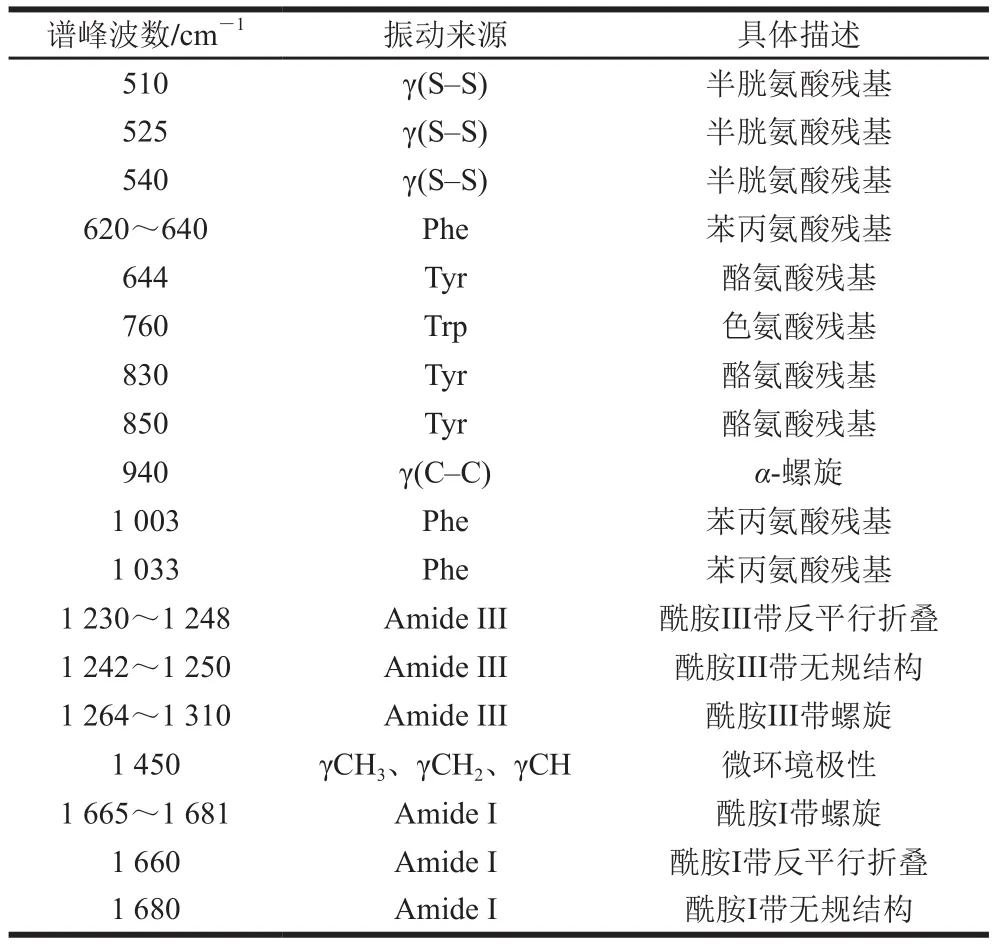
表 1 BBPI的拉曼光谱特征峰位及峰位归属Table 1 Tentative assignment of some bands in Raman spectra of BBPI
2.5.1 对主链结构的影响
BBPI的构象主要由酰胺I带和酰胺III带的拉曼特征峰确定,酰胺I带是C=O与C—N键的伸缩振动,而酰胺III带是C—N键的伸缩振动和N—H面外弯曲振动。BBPI酰胺I带和酰胺III带的二级结构拉曼光谱频率及归属如表2所示。本实验中BBPI的拉曼图谱二级结构的定量计算使用Peakfit 4.12软件完成,结果如表3所示。
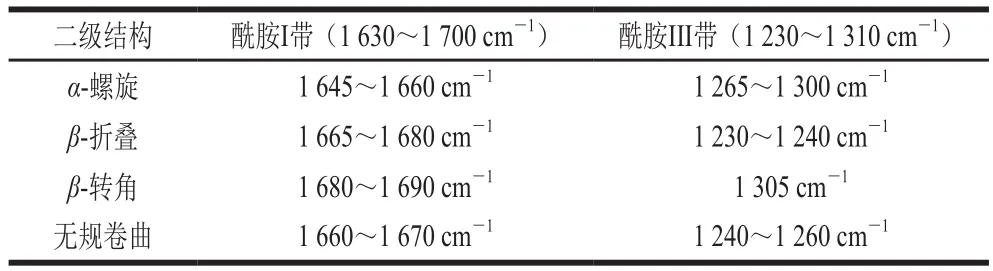
表 2 BBPI的二级结构拉曼光谱频率及归属Table 2 Raman frequency and amide band assignment to secondary structures of BBPI
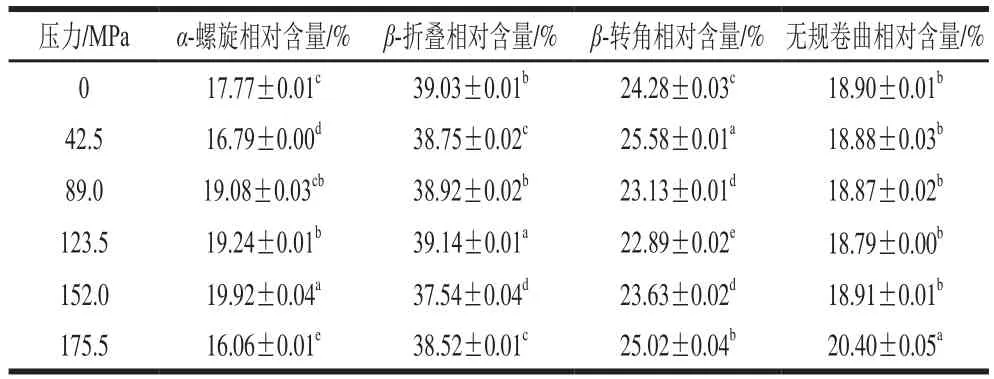
表 3 拉曼光谱测定不同均质处理黑豆蛋白二级结构的相对含量Table 3 Secondary structure contents of native and microfluidizationtreated BBPI estimated from Raman spectra
蛋白质的酰胺I带及酰胺III带常用于表征蛋白质的主链结构。拉曼谱图中1 665~1 675 cm-1处谱带强度大多表明BBPI酰胺I带中主要存在β-折叠结构及无规卷曲结构。其中主要是C=O伸缩振动和部分肽键间的N—H内部弯曲振动,蛋白质的酰胺I带主要用于研究蛋白质二级结构相对含量的定量分析[23]。由表3可知,与未处理的BBPI相比,经过不同微射流均质条件处理的BBPI表现出α-螺旋结构相对含量先降低后增多的趋势。这种现象是由于射流均质产生的高速剪切力和高频振荡等机械作用会诱导BBPI结构发生解折叠,β-折叠结构相对含量先降低后增加,这与毕爽等[24]研究成果一致。张萍等[18]研究发现均质破坏蛋白质分子中的氢键,分子内部氢键发生重排,表现为蛋白质分子中β-折叠结构相对含量增加,而微射流均质引起的蛋白质聚集是引起这一现象的重要原因,这与本实验结果一致。同时,Mauerer等[25]研究证明,射流均质诱导蛋白趋向于无序的二级结构,表现为蛋白质二级结构中β-转角和无规结构相对含量的增加,当均质压力超过175.5 MPa时,产生的作用力蛋白重新聚集,β-折叠结构相对含量增多。
2.5.2 对侧链结构的影响

表 4 不同均质条件下BBPI色氨酸、酪氨酸双峰比、CH振动谱带强度Table 4 Normalized intensity of tryptophan band (760 cm-1), tyrosyl doublet (850/830 cm-1), and δCH band (1 450 cm-1) in BBPI with different microfluidization treatments
Li-Chan[26]研究表明760 cm-1附近区域归属于色氨酸残基的伸缩振动,色氨酸残基会随着拉曼峰强度降低由原本“包埋”态转变为“暴露”态。如表4所示,经过42.5~123.5 MPa均质处理的BBPI的拉曼图谱,在760 cm-1附近区域的拉曼峰强度略有下降,表明色氨酸残基由“包埋”态转变为“暴露”态。而随着均质压力持续增强,色氨酸残基趋向于“包埋”态[27],这表明均质诱导蛋白部分疏水基团外露,进一步解释了前述蛋白表面疏水性增加的原因。
酪氨酸的费米共振会引起850 cm-1和830 cm-1左右处的特征峰随之改变。二者的相对强度(I850cm-1/I830cm-1)对氢键的性质或酚羟基离子化状态有极大影响,因此它被广泛用来鉴定酪氨酸组分包埋和暴露的程度。当I850cm-1/I830cm-1≥1时,酪氨酸残基趋向于“暴露”态;当I850cm-1/I830cm-1≤1时,酪氨酸残基趋向于“包埋”态[4]。在本研究中,I850cm-1/I830cm-1范围为1.016~1.039,表明不同均质条件处理后的BBPI的酪氨酸残基作为中性强度氢键的供体或受体,暴露于溶液的极性微环境中。由表4可知,与未处理的BBPI相比,经过不同均质条件处理后的蛋白的酪氨酸双峰比值有所增加,这说明微射流均质处理破坏了蛋白质的氢键,使蛋白质三级结构受到破坏,酪氨酸残基暴露到蛋白分子的表面[27-28]。
1 450 cm-1是脂肪族氨基酸的拉曼归属峰,表明CH2和CH3的弯曲振动,拉曼光谱的2 800~3 050 cm−1表征脂肪族氨基酸、多肽类和蛋白质的C—H伸缩振动,研究表明脂肪族氨基酸的拉曼归属峰强度增加,脂肪族氨基酸残基与“暴露”态转为“包埋”态。在本研究中,与未处理BBPI相比,经过42.5~152.0 MPa均质BBPI在1 450 cm-1处的拉曼归属峰均显著升高(P<0.05)、脂肪族氨基酸趋于“包埋”态,4号样品(152.0 MPa)谱带强度达到最大值,而随着均质压力的增加,谱带强度反而下降,脂肪酸残基趋于“暴露”态,蛋白质发生聚集,导致疏水基团向“包埋”转变,使谱带强度降低。
2.5.3 BBPI二硫键构型的拉曼光谱分析
研究发现500~560 cm-1范围是二硫键的特征谱带,是蛋白质三级结构的重要维持力,在不同振动模式下所反映出来的拉曼光谱位移有所不同,510 cm-1附近为gauche-gauche-gauche(g-g-g)模式,525 cm-1附近为gauche-gauche-trans(g-g-t)模式,540 cm-1附近为trans-gauche-trans(t-g-t)模式[29]。从图5可以推断出,g-g-t和t-g-t型构象是未经处理的BBPI的主要二硫键构象。而随着均质处理压力的增大,BBPI的t-g-t型构象转化为g-g-t型构象,这与杨勇等[22]的研究成果一致。二硫键构型的变化也解释了BBPI受到均质处理后会发生蛋白质解折叠发生聚集的现象。
3 结 论
微射均质处理能显著提高BBPI分子间的疏水交互作用,进而增强BBPI的乳化活性,这些功能特性的改变与微射流均质产生的快速剪切碰撞的作用力使BBPI二级结构主要组成单元发生改变有关,随着均质压力增加,α-螺旋结构相对含量增加,β结构和无规卷曲结构相对含量相对降低,蛋白质中色氨酸趋向于“暴露”态,酪氨酸参加更多的暴露于蛋白质分子表面,BBPI的t-g-t型构象逐渐转化为g-g-t型构象。当压力超过152 MPa,BBPI乳化性下降,表现为蛋白疏水基团暴露,有序结构发生改变。
