液相色谱法测定肉制品中万古霉素的残留量
2020-03-31李琳
李琳
(1.天津科技大学食品工程与生物技术学院,天津300457;2.中国商业联合会商品质量监督检验测试中心(天津),天津300070)
万古霉素(vancomycin)属于糖肽类抗生素,被视作抗生素的“最后一道防线”,主要用来治疗对所有抗生素都无效的严重感染[1]。万古霉素是一种广谱抗菌素,具有严重的耳毒性及肾毒性,所以只用于短期抢救。
由于畜牧养殖行业越发集中的发展,为了疾病预防的需要[2],不合理的使用抗生素现象比较普遍。人体长期摄入低剂量的抗生素,会造成抗生素在体内逐渐蓄积进而导致体内多器官发生病变。长期摄入低计量的抗生素也会引起人体内菌群的紊乱和耐药性,最终可能导致超级细菌的形成[3]。
同时,万古霉素被列入《食品中可能违法添加的非食用物质和易滥用的食品添加剂名单》[4]中,目前相关部门尚未颁布相应的检测方法,国外主要采用液相色谱仪-串联质谱法进行检测[5-6]。本文建立了高效液相色谱法测定肉制品中万古霉素残留量,为工作方法的建立提供了一种思路。
1 材料与方法
1.1 试验材料和仪器
1.1.1 主要试剂
盐酸万古霉素标准纯品(1404-93-9):德国Dr.Ehrenstorfer GmbH 公司;乙腈(色谱纯)、甲醇(色谱纯):美国 FisherChemical 公司;甲酸(分析纯)、乙酸(分析纯):天津市化学试剂五厂分厂;乙酸铵、磷酸二氢钾(均为分析纯):天津市风船化学试剂科技所有限公司;二氯甲烷、乙醚、石油醚、正己烷(均为分析纯):天津市化学试剂股份公司第二分公司;氨水(分析纯):天津市光复科技发展有限公司;磷酸(分析纯):天津市化学试剂研究所有限公司;PCX-SPE 柱、C18-SPE 柱:天津博纳艾杰尔科技有限公司。
1.1.2 主要仪器
Agilent 1260 液相色谱仪:美国Agilent 公司;AL204 电子分析天平(精确至 0.000 1 g)、FE20 实验室pH 计(精确至0.01):梅特勒-托利多仪器(上海)有限公司;KQ-300DE 数控超声波清洗器:昆山市超声仪器有限公司;XW-80A 微型旋涡混合仪:上海沪西分析仪器厂有限公司;GL-20G-Ⅱ高速冷冻离心机:上海安亭科学仪器厂;12 管防交叉污染固相萃取装置:美国SUPELCO 公司;GM-0.50 两用型隔膜真空泵:天津市腾达过滤器件厂;A10 纯水机:MILLIPORE 公司;0.22 μm微孔过滤膜[聚醚砜(poly ether sulphone,PES)]、0.22 μm过滤膜:天津市津腾实验设备有限公司;一次性无菌注射器:江西洪达医疗器械集团有限公司。
1.2 试验方法
1.2.1 样品的提取方法
称取5.00 肉制品,置于离心管中,加入10 mL 0.1%甲酸水-乙腈(体积比为 7 ∶3),漩涡振荡 1 min,超声辅助提取 20 min。4 ℃下 8 000 r/min 离心 5 min,将上清液转移到另一个干净的离心管中。残渣再加入5 mL 0.1%甲酸水-乙腈,漩涡振荡1 min,超声辅助提取20 min。4 ℃下 8 000 r/min 离心 5 min,合并上清液,加入3 mL 乙腈饱和的二氯甲烷,振荡混匀。4 ℃下8 000 r/min 离心5 min,弃去二氯甲烷层,再加入2 mL二氯甲烷,振荡混匀。4 ℃下8 000 r/min 离心5 min,弃去二氯甲烷层,水相层待净化。
1.2.2 固相萃取柱净化方法
固相萃取柱经过3 mL 甲醇,3 mL 水活化固相萃取柱,弃去流出液后,以小于1 mL/min 速度将待净化液通过固相萃取柱,加入1 mL 水,弃去淋洗液,负压抽干,用8 mL 5%氨化甲醇溶液洗脱,收集流出液,35 ℃氮吹至近干,用1.0 mL 0.1 %甲酸水溶解定容,过0.22 μm 水系膜,待测定使用[7]。
1.2.3 液相条件
色谱柱:Aglient ZORBAX SB-C18 柱,150 mm(柱长)×4.6 mm(内径),粒径 5 μm;流速:1.0 mL/min;流动相:20 mmol 乙酸铵(pH 3.2)-乙腈;梯度洗脱:0.00~3.00 min,乙腈体积保持 10%,3.00 min~15.00 min,乙腈体积由10 %增加到90 %,15.00 min~15.01 min,乙腈体积由90 %降低到10 %,15.01 min~20.00 min,乙腈体积保持10%;检测波长:236 nm;柱温:30 ℃;进样量:10 μL。
1.2.4 不同因素对万古霉素出峰情况的影响
1)液相色谱体系中流动相的选择。选择乙酸铵和磷酸二氢钾作为水相流动相分别进行色谱分离,分析不同盐溶液对万古霉素出峰情况的影响;
2)液相色谱体系中流动相的水相pH 值的选择。调节水相 pH 值分别为 3.2,5,7,分析盐溶液不同 pH 值对万古霉素出峰情况的影响;
3)提取剂的选择和使用体积,对万古霉素回收率的影响。称取5.000 g 的加标肉制品,每份用10 mL 的提取剂进行提取,计算万古霉素的回收率,测试提取剂对万古霉素结果的影响;称取5.000 g 的加标肉制品3 份,第一份添加10 mL 提取剂;第二份添加15 mL提取剂分两次超声辅助提取(第一次10 mL,第二次5 mL),第三份添加15 mL 提取剂,测试万古霉素的回收率,测试提取剂使用体积对万古霉素结果的影响;
4)对固相萃取过程中的洗脱剂进行选择和使用体积,对万古霉素回收率的影响。根据固相萃取柱和万古霉素的极性,选择洗脱液分别为5%氨化甲醇[8]、10 %醋酸甲醇[9]、0.1 %甲酸-乙腈(1+9)、乙腈[10]进行比较。
2 结果与分析
2.1 液相条件的优化
流动相中加缓冲盐是为保持流动相的酸碱度稳定,同时也能使被测物质保持稳定[8]。在已知的高效液相色谱法测定万古霉素应用中,大部分的研究报道在血药研究[11-12]和人体细胞组织[13-14]中药物残留上。根据文献报道[15-16],流动相使用的是0.05 mol/L 磷酸二氢钾(pH=3.2)-乙腈。由于磷酸盐容易结晶,导致液相色谱容易磨损或污染,因此本文讨论用乙酸铵是否能代替磷酸二氢钾进行色谱分离。图1 是流动相不同缓冲盐下万古霉素的色谱图。

图1 不同缓冲盐体系的色谱图Fig.1 Chromatographic charts of different buffer salt systems
由图1 可以看出,色谱峰对称性都很好,并且无拖尾现象,因此缓冲盐对峰形影响的差别很小,但乙酸铵的响应值明显优于磷酸二氢钾,因此乙酸铵可以作为流动相中的缓冲盐使用。
同时测试了50 mmol/L 乙酸铵、20 mmol/L 乙酸铵对万古霉素出峰情况的影响,结果表明,乙酸铵的浓度对峰形效果的影响不明显。考虑到分析纯试剂对仪器灵敏度可能略有影响,所以最终选择20 mmol/L 乙酸铵作为缓冲盐使用。
图2 是在不同pH 值的流动相下万古霉素的色谱图。
由图2 中可以看出,pH=7、pH=5 时,有拖尾现象并且色谱峰响应值也不高,而pH=3.2 时出峰效果最理想,峰形比较对称,无拖尾现象,响应值明显,因此本文流动相缓冲盐是pH=3.2 的20 mmol/L 乙酸铵。

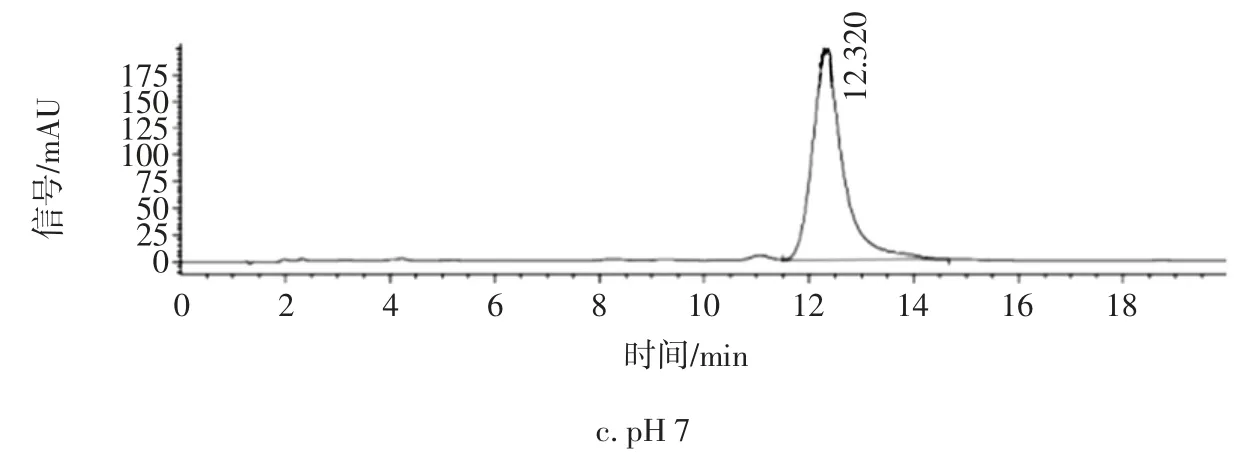
图2 不同pH 值缓冲液的色谱图Fig.2 Chromatographic charts of different pH value buffers
紫外吸收波长的选择,影响到试验的灵敏度和稳定性[17]。对万古霉素进行了全波长扫描,在280 nm 处有特征吸收波长[18],但根据文献报道大部分的测试万古霉素选择的吸收波长为236 nm[19]。因此本文中,以280 nm 和236 nm 做比较,查看两种波长下色谱图的差异,结果表明,吸收波长236 nm 处的吸收强度高于280 nm 处,考虑到乙腈的截止波长是210 nm,乙酸铵的截止波长是230 nm。因此,最终选择236 nm 作为检测波长进行试验。
2.2 液相方法曲线线性
将万古霉素用 0.1 %甲酸稀释成 8.5、17、51、85、119、170 μg/mL。用液相色谱仪二极管阵列检测器进行测定,以浓度为横坐标,峰面积为纵坐标,绘制校正曲线,图3 是万古霉素在液相色谱中的校准曲线图。

图3 万古霉素液相色谱仪校准曲线Fig.3 Calibration curve of vancomycin liquid chromatography
万古霉素在液相色谱中的线性方程式是:Y=9.014 62X+0.538 75,线性相关系数 R2=0.999 84,可以看出浓度与响应值线性良好。
2.3 样品前处理条件的优化
2.3.1 提取剂的选择和用量
提取方案的选定主要是根据分析物的特性来定。但也需要考虑样品的组分(如脂肪含量、蛋白质含量等)以及后面的吸附剂性质等因素。要求提取溶剂使分析物能进入溶液中而样品中其他物质不溶或少量溶于该溶液中。
测试了不同提取剂[甲醇∶水=5∶5[8]、乙腈∶水=5∶5[20]、乙腈∶0.1%甲酸=3∶7[21]、乙腈∶20 mmol/L 乙酸铵=3∶7(以上均为体积比)]对万古霉素回收率的影响,结果见图4。
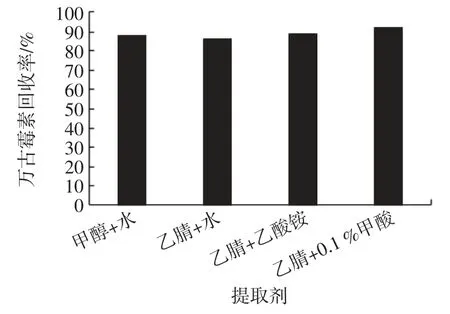
图4 不同提取剂下万古霉素回收率Fig.4 The recovery of vancomycin with different extractants
由图4 可以看出,用乙腈∶0.1%甲酸=3 ∶7 提取回收的效果略优于其他提取剂。因此,本试验选择使用乙腈∶0.1%甲酸=3 ∶7 作为提取剂。
对提取剂用量做优化,图5 为提取剂不同用量对万古霉素回收率的影响。

图5 提取剂不同用量和方式下万古霉素回收率图Fig.5 Recovery of vancomycin with different dosage and methods of extractant
由图5 可以看出,用15 mL 分2 次超声辅助提取回收的效果明显优于其他提取方式的效果,因此,本试验选择15 mL 提取剂分两次超声辅助提取(第一次10 mL,第二次5 mL)作为提取条件。
2.3.2 固相萃取柱的选择
文献中,固相萃取柱一般选择主要选择2 个品种,反向材料和阳离子交换材料。因此,本文选择了PCXSPE[22]、C18-SPE[23]进行比较,对万古霉素回收率结果见图6。
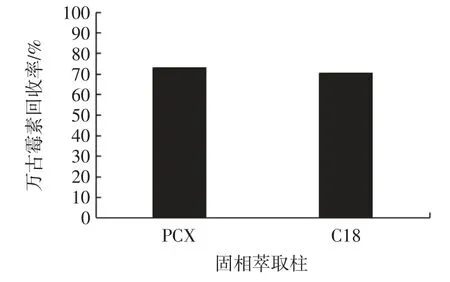
图6 不同固相萃取柱对样品中万古霉素回收率效果图Fig.6 Effect charts of vancomycin recovery in samples by different solid phase extraction columns
由图6 可以看出,两种固相萃取柱对万古霉素吸附的效果相近,PCX-SPE 为固相萃取柱时万古霉素的回收率略高。
2.3.3 洗脱剂的选择和用量
图7 是不同洗脱液回收率的试验结果比较。
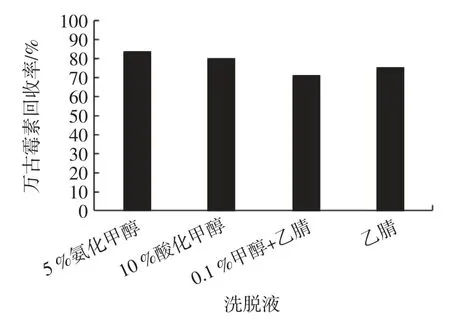
图7 不同洗脱液回收率Fig.7 Recovery of different eluents
结果表明,5%氨化甲醇洗脱液对回收率结果的影响明显优于其他洗脱液的效果,因此,本试验选择5%氨化甲醇作为洗脱液。
对于洗脱液用量的优化,以5 mL 为基础,增加洗脱液用量,试验结果表明8 mL 洗脱液可以比较完全的洗下目标物质,并且杂质干扰比较少。
2.4 方法验证
2.4.1 检出限和定量限的确定
按照方法配制标准溶液,并按照试验步骤进行操作净化空白样品,用空白样品不断稀释标准品,根据信噪比得到的浓度,计算出检出限和定量限。检出限是指由基质空白所产生的仪器背景信号的3 倍值的所对应的物质浓度,经过测量计算检出限(S/N=3)为0.5 mg/kg。定量限是指由基质空白所产生的仪器背景信号的10 倍值的所对应的物质浓度,经过测量计算定量限(S/N=10)为 8 mg/kg。
2.4.2 加标回收率测定、精密度验证
由于市面上没有销售已知浓度的标准样品,所以采用空白样品添加不同浓度待测物质制成有确定含量的样品,按照操作步骤进行测试。本文进行3 个水平的回收率试验,分别添加 30、80、150 μg/mL3 种不同浓度,加标回收率结果见表1。

表1 空白样品加标回收率Table 1 Recovery rate of blank sample
经过计算,3 个添加水平的相对标准偏差分别为:6.67%、3.63%、4.20%,相对标准偏差在10%以内,符合有机物检测的回收率水平要求。
2.5 试验方法的应用
利用本试验已经建立的方法对市场上销售的肉制品进行检测,随机选择5 个不同品牌的不同类型肉制品(包括老火腿、腊肠、粉肠、午餐肉、蒜肠)进行检测,均为未检出万古霉素残留。
3 结论
本文建立了液相色谱法测定肉产品中万古霉素含量。线性范围是 8.5 μg/mL 到 170 μg/mL,方法检出限为0.5 mg/kg,定量限为8 mg/kg。添加回收率在75%~95%,精密度为5%~8%。
应用本试验方法对市场上销售的5 种肉制品进行测试,结果表明5 个产品均未检出万古霉素残留。为肉制品中万古霉素含量的测定提供了一个研究思路。
