烟草疫霉菌LAMP检测方法的建立及验证
2020-03-30吴娜李淑君康业斌
吴娜 李淑君 康业斌

摘 要:为了建立烟草疫霉菌(Phytophthora parasitica)可视化快速检测方法,试验以羟基萘酚蓝(HNB)为指示剂,以烟草疫霉菌特异的核糖体转录间隔区(Internal transcribed spacer,ITS)为目的DNA片段,应用LAMP设计软件设计4条引物,通过优化LAMP反應体系和反应条件,建立一种准确快速的LAMP检测方法,并对该检测方法的特异性、灵敏度及实际应用效果进行验证。结果表明,本试验建立的烟草疫霉菌LAMP反应体系具有较好特异性且灵敏度较高。特异性检测只有烟草疫霉菌株LAMP产物为阳性(蓝色),且电泳结果能够产生梯形条带;灵敏度验证在DNA水平上可达到100 fg,是普通PCR检测方法的1000倍。对田间疑似黑胫病病株及其根际土样提取的DNA进行LAMP检测,各有3份样本为阳性,且病株检测结果与组织分离法对烟草疫霉的检测结果相一致;接种2 d后,病害症状还不明显的烟株中即可检测到烟草疫霉菌。本研究建立的烟草疫霉LAMP检测体系,可快速、简捷地检测到病株及其携带土壤中的烟草疫霉菌。
关键词:烟草疫霉菌;烟草黑胫病;环介导等温扩增(LAMP);羟基萘酚蓝(HNB)
Establishment of the Loop-mediated Isothermal Amplification Assay for Detection ofPhytophthora parasitica
WU Na1, LI Shujun2, KANG Yebin1*
(1. College of Forestry, Henan University of Science and Technology, Luoyang, Henan 471023, China; 2. Xuchang Tabocco Research Institute, Henan Academy of Agricultural Science, Xuchang, Henan 461000, China)
Abstract: In order to establish a rapid detection method forPhytophthora parasitica, hydroxynaphthol blue (HNB) was used as an indicator for thePhytophthora nicotianaspecific transcribed spacer (ITS) DNA sequence. The primers were designed with the LAMP design software. The LAMP reaction system and reaction conditions were optimized and the specificity, sensitivity and practical application of the detection method were verified. The results showed that the LAMP reaction system ofPhytophthora nicotianaeestablished in this experiment has good specificity and high sensitivity. Specific detection showed that only the LAMP product of thePhytophthora nicotianastrain is positive (blue), and the electrophoresis can produce trapezoidal bands. The sensitivity verification can reach 100 fg at the DNA level, which is 1000 times of the detection sensitivity of the common PCR method. The LAMP test was carried out on the DNA extracted from the suspected black smut disease strain and its rhizosphere soil samples, and each of the three samples were positive, and the test results of the diseased plants and the tissue separation method were consistent with the detection results ofPhytophthora nicotianae. After 2 days of inoculation,Phytophthora nicotianaecan be detected in tobacco plants with no obvious symptoms of tripping. ThePhytophthora nicotianaLAMP detection system established in this study can quickly and easily detect thePhytophthora nicotianaein the diseased plants and their carrying soil.
Keywords:Phytophthora parasitica; tobacco black shank; LAMP; HNB
烟草疫霉菌(Phytophthora parasiticavar.nicotianae)为鞭毛菌亚门(Mastigomycotina)卵菌綱(Oomycota)、疫霉属(Phytophthora)的一种土传植物病原菌[1],由该菌侵染烟株引起的黑胫病是烟草的毁灭性病害之一,且该菌常与其他土传病菌如根黑腐病菌(Thielaviois basicola)、立枯病菌(Rhizoctonia solani)、腐霉菌(Pythium phanidermatum)等混合侵染,田间发病症状相似,病害诊断困难[2]。传统的烟草病害诊断方法是对具有典型症状的病样进行分离、鉴定,其耗时长、灵敏度低,易受人为及环境等诸多因素干扰[3]。因此,建立快速、准确的烟草疫霉菌检测方法已成为生产中迫切需要解决的问题。目前烟草疫霉菌的分子检测方法主要以普通PCR和荧光定量PCR为主[4-5],这些方法操作复杂、费时费力,而且需要特殊的仪器设备,无法满足基层检测的需求。环介导等温扩增技术(Loop mediated isothermal amplification,LAMP)是NOTOMI等[6]于2000年开发的一种快速、简便、廉价、新型的恒温核酸扩增技术。该技术针对靶基因的6个区域设计4条特异引物(2条外引物和2条内引物),利用链置换DNA聚合酶(Bst DNA polymerase),在恒温条件下高效、快速、特异地扩增靶序列;LAMP反应产物可通过SYBR Green I、钙黄绿素和羟基萘酚蓝(HNB)等[7-8]显色剂染色后颜色变化来判断,可方便、直观地获取反应结果;目前该技术已成功应用于燕麦镰孢菌[9]、尖孢镰孢菌[10]、柑桔溃疡病菌[11]、烟草环斑病毒[12]、香蕉穿孔线虫[13]等植物病原物的检测。有关LAMP技术在烟草疫霉菌检测方面的报道较少,王勇等[14]、陈庆河等[15]利用SYBR Green I显色剂建立了烟草疫霉菌的LAMP技术检测体系,但SYBR Green I显色剂需要在反应结束后开管添加,此时反应产物容易产生气溶胶污染,导致检测结果不稳定[16]。因此,本研究选择羟基萘酚蓝(HNB)做显色剂,且在反应液中提前加入HNB,以烟草疫霉特异的核糖体转录间隔区(ITS)为目的DNA片段,设计4条引物,建立了LAMP检测方法,并对该方法的特异性、灵敏度、田间及接种病株的应用效果进行评估,以期为烟草疫霉菌的快速检测提供技术支撑。
1 材料与方法
1.1 供试菌株
烟草疫霉菌(Phytophthora parasitica)与对照菌株立枯丝核菌(Rhizoctonia solani)、根串珠霉(Thielaviopsis basicola)、茄病镰刀菌(Fusarium solani)、尖孢镰刀菌(Fusarium oxysporum)、瓜果腐霉(Pythium aphanidermatm)、固执腐霉(Pythium recalcitrans)、二孢白粉菌(Erysiphe cichoracearum)、链格孢菌(Alternaria alternata)、致病疫霉(Phytophthora infestans)、辣椒疫霉(Phytophthora capsici)、大豆疫霉(Phytophthora sojae)、禾谷镰刀菌(Fusarium graminearum)均来自于河南科技大学植物病害分子鉴定与绿色防控实验室。
1.2 菌株培养及基因组DNA的提取
将致病疫霉(Phytophthora infestans)转至黑麦培养基[17],辣椒疫霉(Phytophthora capsici)转至燕麦培养基(OA)[18],其他菌株转至马铃薯葡萄糖固体培养基(PDA)培养4 d后,从菌落边缘切取相应菌丝块,致病疫霉菌株转至黑麦液体培养基,辣椒疫霉转至燕麦液体培养基,其他菌株转至马铃薯葡萄糖液体培养基中,培养至菌丝体长满培养皿。病原菌总DNA的提取采用CTAB法[19]提取。采用植物基因组DNA快速抽提试剂盒(生工生物工程有限公司编号:B518231)进行烟草组织DNA的提取。没有发病的健康植株用作对照的烟株。提取的DNA保存在?20 ℃冰箱中备用。
1.3 病原菌ITS序列的扩增及LAMP引物的设计
从GeneBank中下载烟草疫霉菌的ITS基因序列和其他疫霉种的ITS基因序列,利用MEGA软件对所有下载的ITS基因序列进行比对分析,并使用在线应用软件Primer Explore V5 (http://primerexplorer.jp/lampv5e/index.html),根据LAMP引物筛选原则筛选出一套特异性检测引物。其中,F3/B3为外引物,FIP/BIP为内引物,其序列见表1。引物由生工生物工程(上海)股份有限公司合成,将合成好的引物放入D2012 Plus型台式高速离心机(北京大龙兴创实验仪器有限公司),4000 r/min离心1 min,使吸附于离心管壁的引物沉到离心管底部。根据引物管壁标签的说明,首先用ddH2O将引物配制成100 μmol/L的保存液,?20 ℃冰箱保存备用。使用前再将保存液稀释至试验时所使用的浓度。
1.4 LAMP反应体系的优化与建立
试验参考Bst DNA polymerase推荐体系(dNTP 1.6 mmol/L,MgSO46 mmol/L,FIP/BIP各1.6 μmol/L,F3/B3各0.2 μmol/L,Bst DNA polymerase 320 U/mL,加2.5 μL的10×ThermoPol Buffer,1 μL模板DNA,灭菌水补至25 μL。64 ℃恒温孵育1 h。)及相关文献[8-12],通过单因素变化对LAMP反应体系的各参数,包括HNB[源叶生物科技(上海)有限公司]与dNTP[生工生物工程(上海)股份有限公司]、Bst DNA聚合酶与硫酸镁[威展生物科技(郑州)有限公司]进行优化。本试验选用HNB作为指示剂,若目的序列发生扩增,则反应液呈蓝色(阳性反应),反之反应液呈紫色(阴性反应),最后用2.0%琼脂糖凝胶电泳再次验证扩增结果,阳性反应产生阶梯状条带,阴性反应则无此现象。设置3次重复。
1.5 LAMP引物特异性检测
根据已优化的反应体系对所有供试菌株进行特异性检测,通过肉眼观察检测结果,蓝色为阳性,紫色为阴性;并用2.0%琼脂糖凝胶电泳加以验证。设置3次重复。
1.6 LAMP检测灵敏度测定
用紫外分光光度计检测烟草疫霉DNA浓度后,按10倍梯度(10-1~10-7)稀释为100 ng/μL、10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL,分别取1 μL各梯度DNA稀释液以进行快速LAMP扩增和普通PCR,比较LAMP检测法和普通PCR检测法对烟草疫霉的检测灵敏度差别。普通PCR反应引物使用基于ITS基因靶标设计的烟草疫霉菌特异性引物F3/B3。普通PCR反应的混合液总体积为25 μL,包括:相应浓度的模板DNA,2×Taq Gold Master Mix Buffer 12.5 μL,F3/B3 0.5 μmol/L,ddH2O 9 μL,PCR仪上完成反应。反应程序:94 ℃预变性3 min;然后进入循环,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸7 min。反应结束后取5 μL扩增产物于1.0 %琼脂糖凝胶中电泳1 h(80 V),在凝胶成像系统上检测并拍照。LAMP检测结果直接用肉眼观察,蓝色为阳性,紫色为阴性;并用2.0%琼脂糖凝胶电泳检测。设置3次重复。
1.7 田间病株与病土中烟草疫霉检测
从洛阳市宜阳县烟田采集具有烟草黑胫病疑似症状的病茎样本5份,提取样本总DNA,各取1 μL DNA用于LAMP检测,同时对病株发病部位按照常规组织分离法进行病菌分离验证。设置3次重复。
取上述5株疑似病株根际土壤5份,提取土壤样本总DNA,取1 μL DNA用于LAMP检测,检测结果与病株检测结果相比较。设置3次重复。
1.8 接种植株发病组织中烟草疫霉检测
选长势良好的感黑胫病烟草品种长脖黄(6~7片叶),用无菌注射器刺伤茎部表皮,在针刺部位接种菌龄7 d烟草疫霉菌丝块(直径为5 mm),用脱脂棉蘸取无菌水包裹保湿,以接种空白琼脂块的为对照。在接种1、2、3 d后分别取接种部位茎部组织约100 mg,提取植物侵染部位的总DNA,利用LAMP方法进行检测。设置3次重复。
2 结 果
2.1 LAMP反应体系的优化与建立
2.1.1 HNB浓度的优化 图1A显示,HNB在0.1~0.2 mmol/L 6个不同的浓度下反应液均变为蓝色,颜色逐渐变亮,确定0.2 mmol/L为HNB反应浓度;由图1B显示,HNB浓度在0.1~0.2 mmol/L时电泳条带差异不显著。
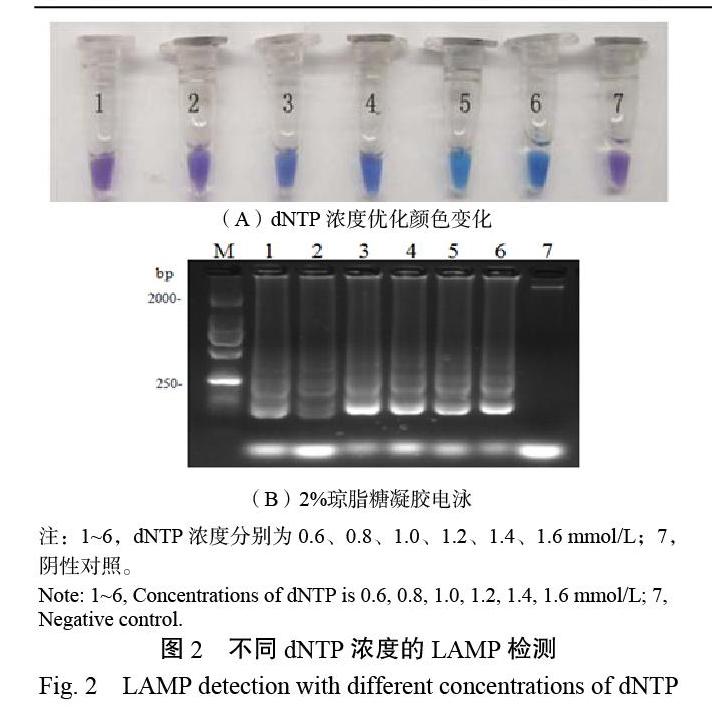
2.1.2 dNTP浓度的优化 如图2A所示,dNTP在1.0~1.6 mmol/L 4个不同的浓度下反应液均变为蓝色,且颜色逐渐变深,当dNTP浓度为1.4 mmol/L时,反应液颜色最亮,确定1.4 mmol/L为dNTP反应浓度;dNTP浓度在1.0~1.6 mmol/L时电泳条带差异不显著(图2B)。
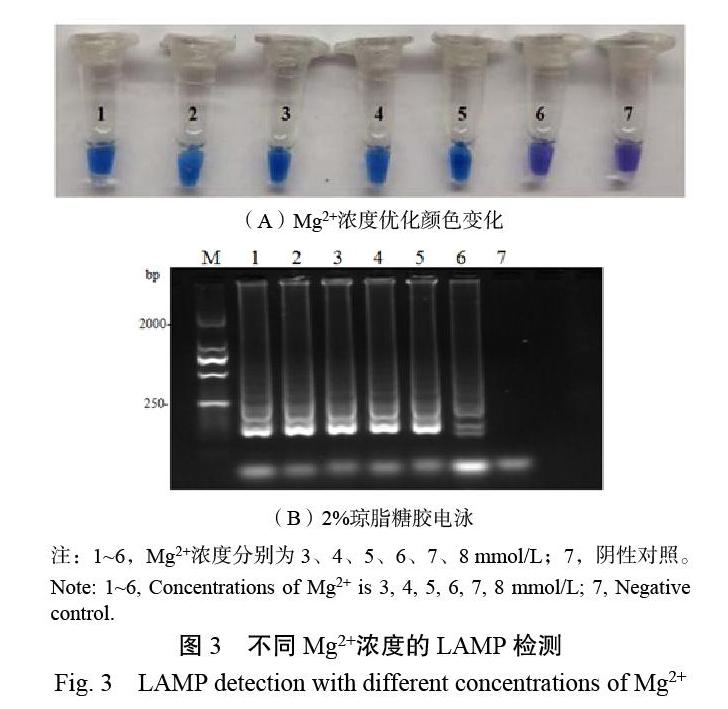
2.1.3 硫酸镁浓度的优化 硫酸镁在3~7 mmol/L 5个不同的浓度下反应液均变为蓝色(图3A),颜色差异不显著,通过参考Bst DNA polymerase推荐体系[威展生物科技(郑州)有限公司]及相关文献[8-12],确定6 mmol/L为硫酸镁反应浓度;硫酸镁浓度为3~7 mmol/L时电泳条带差异不显著(图3B)。
2.1.4 Bst DNA酶浓度的优化 Bst DNA酶在240~ 320 U/mL 2个不同的浓度下反应液均变为蓝色(图4A),颜色逐渐变深,确定320 U/mL为Bst DNA酶反应浓度;Bst DNA酶浓度在320 U/mL时电泳条带最亮(图4B)。
结合试验优化结果及参考Bst DNA polymerase推荐体系[威展生物科技(郑州)有限公司]及相关文献[8-12],优化后的最终反应体系各组分最佳浓度為:dNTP 1.4 mmol/L,MgSO46 mmol/L,HNB 0.2 mmol/L,FIP/BIP各1.6 μmol/L,F3/B3各0.2 μmol/L,Bst DNA polymerase 320 U/mL,加2.5 μL的10×ThermoPol Buffer,1 μL模板DNA,灭菌水补至25 μL。将上述25 μL反应体系置于0.2 mL的PCR反应管内,轻微涡旋后将反应管置于PCR仪上完成反应。反应程序:64 ℃扩增60 min,80 ℃退火10 min。
2.2 引物特异性检测
如图5A所示,在HNB指示剂的作用下,只有烟草疫霉LAMP检测显示蓝色;电泳结果显示(图5B)扩增产物出现特有的梯形条带,而其他供试菌株中均没有观察到这些现象。说明LAMP引物对检测烟草疫霉具有很好的特异性。
2.3 LAMP检测灵敏度
LAMP检测结果在以100 fg/μL DNA为模板时,反应产物可显示蓝色(图6A)。取5 μL LAMP产物用2.0 %琼脂糖凝胶电泳检测,结果显示,从100 ng/μL至100 fg/μL的模板DNA都可以出现LAMP产物特有的梯形条带(图6B),说明该LAMP反应体系可以检测到100 fg的烟草疫霉基因组DNA。普通PCR以F3/B3为引物,模板DNA浓度在100 ng/μL至100 pg/μL时均可得到有效的扩增(图6C),表明其检测的灵敏度为100 pg/μL。LAMP检测灵敏度比普通PCR提高1000倍。
2.4 田间病株与病土中烟草疫霉LAMP检测
通过对5份疑似烟草黑胫病病株的DNA检测发现,3份为阳性,2份为阴性(图7A)。病样经常规组织分离与分离物形态学观察鉴定,仅阳性病样的分离物鉴定为烟草疫霉。5份疑似病株根际土壤的DNA检测发现,3份为阳性,2份为阴性(图7B),根际土壤检测结果与烟株检测结果一致。证实了本研究建立的LAMP检测体系对烟草疫霉菌具有特异性。
2.5 接种植株发病组织中烟草疫霉LAMP检测
感黑胫病品种长脖黄接种1 d后,接种部位无明显症状;2 d后接种部位缢缩,有少量褐色或黑色坏死斑,病斑不扩展;3 d后接种部位明显缢缩,茎部有褐色或黑色坏死,并上、下扩展。接种2 d、3 d后的烟株,接种部位茎部组织均可检测到烟草疫霉(图8A、B)。证实本研究建立的LAMP检测体系对烟草疫霉菌具有很高的灵敏性,可用于黑胫病的早期诊断。
3 讨 论
试验基于真菌ITS序列设计出一套用于检测烟草疫霉的LAMP特异性引物,并对反应条件及反应试剂使用浓度进行了优化,建立了烟草疫霉LAMP检测体系。
本研究利用HNB建立的烟草疫霉LAMP技术体系可以检测到100 fg的烟草疫霉基因组DNA,检测灵敏度比普通PCR提高1000倍;比刘萍花等[20]建立的多重PCR检测黑胫病菌灵敏度提高了100倍;比王勇等[14]利用SYBR Green I建立的烟草疫霉快速检测体系灵敏度提高了10倍,是陈庆河等[15]利用SYBR Green I建立的烟草疫霉快速检测体系灵敏度的0.1倍。赵赛[21]报道在优化浓度范围内,随着dNTP浓度的加大,反应条带越来越清晰。本研究发现,对反应灵敏度影响最大的体系成分为dNTP,在优化浓度范围内,随着dNTP浓度增加,反应液变化的颜色加深。此外,不同体系灵敏度产生的差异还与引物设计、染色剂种类等因素有关。
在大田实际应用中,本研究建立的LAMP检测方法,所得的检测结果与组织分离结果一致。较传统组织分离鉴定植物病原物,LAMP技术更具有便捷、快速不受人为因素影响等优点,且不受植物组织浸出液干扰[22],这对生产上诊断和防治烟草疫霉菌引起的相关病害具有重要的应用价值。人工接种的结果证明,病菌侵入烟株2 d,在烟株猝倒症状还不明显时即可被检测到标靶菌,这对于田间烟株早期检测、病害早期预防有重要的实用价值。
4 结 论
本研究建立的烟草疫霉LAMP检测体系,能够快速、准确地从烟株发病组织及其根际土壤中检测出烟草疫霉,这对制定烟草黑胫病的田间监测和指导防治具有重要的意义。
参考文献
[1] JAARSVELD E V, WINGFIELD M J, DREMH A. Evaluation of tobacco cultivars for resistance to races ofPhytophthora parasiticain South Africa[J]. Journal of Phytopathology, 2002, 150(8): 456-462.
[2] 刘萍花,方敦煌,吴祖建,等. 应用多重PCR检测烟草黑胫病菌、根黑腐病菌、猝倒病菌及立枯病菌[J]. 福建农林大学学报(自然科学版),2015,44(4):345-349.
LIU P H, FANG D H, WU Z J, et al. Simultaneous detection ofPhytophthora nicotianae,Thielaviois basicola,Pythium aphanidermatumandRhizoctonia solaniinfected tobacco by multiplex PCR[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2015, 44(4): 345-349.
[3] 王楠,王劍,尹丹韩,等. 三重PCR检测草莓灰霉病菌、炭疽病菌和黄萎病菌[J]. 中国农业科学,2010,43(21):4392-4400.
WANG N, WANG J, YIN D H, et al. Triplex PCR detection ofBotrytis cinerea,Colletotrichum gloeosporioidesandVerticillium dahliaein infected strawberry plant tissues[J]. Scientia Agricultura Sinica, 2010, 43(21): 4392-4400.
[4] 高喬芬,秦西云,方敦煌,等. 烟草疫霉的快速分子检测术[J]. 云南农业大学学报,2012,27(2):156-159.
GAO Q F, QIN X Y, FANG D H, et al. A rapid method to detectPhytophthora nicotianaeby PCR[J]. Journal of Yunnan Agricultural Unversity, 2012, (22): 156-159.
[5] 潘明森,王震铄,方敦煌,等. 土壤中黑胫病菌荧光定量PCR快速检测体系的建立及初步应用[J]. 江西农业大学学报,2015,37(4):712-718.
PAN M S, WANG Z S, FANG D H, et al. Development and preliminary application of fluorescence quantitative PCR system for rapid detection ofPhytophthora nicotianaein soil[J]. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(4): 712-718.
[6] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): 63.
[7] TOMITA N, MORI Y, KANDA H, et a1. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877-882.
[8] GOTO M, HONDA E, OGURA A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxyl naphthoI blue[J]. Biotechniques, 2009, 46(3): 167-172.
[9] 漆永红,曹素芳,李雪萍,等. 燕麦镰孢菌环介导等温扩增(LAMP)检测方法的建立及应用[J]. 草地学报,2018,26(4):1005-1010.
QI Y H, CAO S F, LI X P, et a1. Development of a loop-mediated isothermal amplification assay for detection ofFusarium avenaceum[J]. Acat Agrestia Sinica, 2018, 26(4): 1005-1010.
[10] LU C C, DAI T T, ZHANG H F, et a1. Development of a Loop-mediated isothermal amplification assay to detectF usarium oxysporum[J]. Journal of Phytopathology, 2015, 163(1): 63-66.
- 张仑. 应用环介导等温扩增技术快速检测柑橘溃疡病菌[D]. 重庆:重庆大学,2009.
ZHANG L. Application of loop-mediated isothermal amplification (LAMP) in rapid detection ofXanthomonas axonopodis[D]. Chongqing: Chongqing University, 2009.
- GAWANDE S P, MONGA D, NAGRALE D T, et a1. Rapid detection of tobacco streak virus (TSV) in cotton (Gossypium hirsutum) based on reverse transcription loop mediated isothermal amplification(RT-LAMP)[J]. Journal of Virological Methods, 2019, 270: 21-25.
[13] 熊玉芬,王瑄,梁中伟,等. 松材线虫乙酰胆碱酯酶基因Bx-ace-2的克隆和序列分析[J]. 南京农业大学学报,2010,33(4):42-48.
XIONG Y F, WANG X, LING Z W, et a1. Molecular cloning and characterization of a new acetylcholinesterase gene Bx-ace-2 from pine wood nematodeBursaphelenchus xylophilus[J]. Journal of Nanjing Agricultural University, 2010, 33(4): 42-48.
[14] 王勇,张海珊,高正良,等. 一种烟草疫霉菌LAMP引物及其快速检测方法:中国,103773865A[P]. 2014-05-07.
WANG Y, ZHANG H S, GAO Z L, et a1. A Molecular detection primer forPhytophthorain tobacco and its detection method: China, 103773865A[P]. 2014-05-07.
[15] 陈庆河,李本金,等. 一种烟草疫霉菌LAMP引物及其快速检测方法:中国,104232755A[P]. 2014-12-24.
CHEN Q H, LI B J, et a1. A Molecular detection primer forPhytophthorain tobacco and its detection method: China, 104232755A[P]. 2014-12-24.
[16] 戴婷婷. 疫霉菌環介导等温扩增技术快速检测的研究[D]. 南京:南京农业大学,2013.
DAI T T. Application of loop-mediated isothermal amplification (LAMP) in rapid detection ofPhytophthora species[D]. Nanjing: Nanjing Agricultural University, 2013.
[17] 李惠霞,刘永刚,王蒂,等. 马铃薯晚疫病菌培养条件的研究[J]. 中国马铃薯,2007,21(4):203-205.
LI H X, LIU Y G, WANG D, et a1. Studies on suitable cultural condition ofPhytophthora infestans[J]. Chinese Potato Journal, 2007, 21(4): 203-205.
[18] 李立凤,李小梅,张景涛,等. 辣椒疫霉菌生长和产孢条件的研究[J]. 东北农业大学学报,2010,41(10):139-142.
LI L F, LI X M, ZHANG J T, et a1. Study on growth and sporulation conditions ofPhytophthora capsici[J]. Journal of Northeast Agricultural University, 2010, 41(10): 139-142.
[19] 李焕宇,付婷婷,张云,等. 5种方法提取真菌基因组DNA作为PCR模板效果的比较[J]. 中国农学通报,2017,33(16):28-35.
LI H Y,FU T T,ZHANG Y, et a1. Effect comparison of five methods to extract fungal genomic DNA as PCR templates[J]. Chinese Agricultural Science Bulletin, 2017, 33(16): 28-35.
- 刘萍花,方敦煌,吴祖建. 应用多重PCR检测烟草黑胫病菌、根黑腐病菌、猝倒病菌及立枯病菌[J]. 福建农林大学学报(自然科学版),2015,44(4):345-349.
LIU P H, FANG D H, WU Z J. Simultaneous detection ofPhytophthora nicotianae,Thielaviois basicola,Pythium aphanidermatumandRhizoctonia solaniinfected tobacco by multiplex PCR. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(4): 345-349.
- 赵赛. 番茄溃疡病菌LAMP检测系统的建立及Z-L-22对该病害的防治效果[D]. 保定:河北农业大学,2015.
ZHAO S. Development of a loop-mediated isothermal amplification assay for detection ofClavibacter michiganensissubsp.michigansisand the control effect of Z-L-22[D]. Baoding: Hebei Agricultural University, 2015.
[22] 黄雯,徐进,张昊,等. 植物青枯菌LAMP检测方法的建立[J]. 中国农业科学,2016,49(11):2093-2102.
HUANG W,XU J,ZHANG H,et a1. Development of a LAMP approach for detection ofRalstonia solanacearum[J]. Scientia Agricultura Sinica, 2016, 49(11): 2093-2102.
