SnCuOx催化剂电化学还原CO2制甲酸性能研究
2020-03-30郭祥贺李冰爽刘广波訾仲岳
郭祥贺,李冰爽,刘广波*,訾仲岳
(1.中国科学院青岛生物能源与过程研究所,山东 青岛 266101;2.青岛大学 化学与化工学院,山东 青岛 266071)
CO2是主要的温室气体,同时也是一种无毒廉价的C1资源,将其进行固定利用,对能源和环境领域的发展具有重要的理论和现实意义。将CO2通过电化学还原方式转化为甲酸等化学品,既是一种温和、绿色的CO2转化利用方式,同时也是一种有效的可再生电能储存方式[1-2]。
在众多的CO2电还原催化剂中,SnCu基催化剂由于其独特的结构及电化学性质,常电化学还原CO2制CO、甲酸等研究[3-8]。目前对SnCu复合催化剂的研究多集中于纳米颗粒制备,核壳催化剂制备等过程。Sun等[3]通过制备7.0nm的Cu纳米粒子和1.8nm的SnO2外层,将其用于CO2电化学还原制甲酸,发现催化剂法拉第效率可以成倍增加。Gunji等[4]通过纳米Cu6Sn5复合金属包裹SnO2催化剂,将其用于CO2电化学还原制甲酸,发现相较于单物质,金属复合结构有助于提高催化剂法拉第效率。在这些研究过程中,多数作者认为纳米粒子的高比表面积是催化剂表现出优异性能的重要原因[3-8]。然而,纳米粒子合成过程常用表面活性剂,而表面活性剂常对电化学过程有影响。
近期随着MOF材料的兴起,高性能金属有机骨架结构材料(MOF)用作光电催化剂的报道屡见不鲜。Cu-BTC作为一种常用的Cu基MOF材料,具有较好的CO2吸附能力[9],以其作为前驱体制备Cu基CO2电还原催化剂,有可能增强CO2吸附扩散能力,增加过程传质,提高反应效率。SnO2作为电极材料,其带隙为3.6 eV,许多研究者常通过掺杂金属离子减小带隙宽度、促进电荷传输等方式,增强其催化活性[10-15]。Goodenough等[10]研究了碳纳米管负载的不同氧化锡催化剂电化学还原CO2制备甲酸的反应性能,结果表明相较于SnO2,低价态SnOx更易获得较高的法拉第效率。采用高活性MOF材料与低价态Sn耦合制备催化剂,有望制备高性能催化剂,实现CO2高效电化学还原制备甲酸过程。目前关于Cu基MOF材料与低价锡耦合制备电化学还原CO2催化剂并将其用于电化学制备甲酸的过程还鲜有报道。
本文以1,3,5-均苯三甲酸铜配合物(Cu-BTC)与草酸亚锡为前驱体,以期制备不同低价Sn掺杂量的SnCuOx催化剂,将其用于电化学还原CO2制备甲酸过程,在考察Sn掺杂量对催化剂电化学还原性能影响的基础上,进一步对不同催化剂的表面织构性质、电子结构性质、形貌结构等进行表征,并深入解析催化剂结构与性能之间的关系。
1 仪器与材料
1.1 实验仪器
电化学工作站(上海辰华仪器有限公司CHI660);液相色谱型号(Agilent 1200);X射线衍射仪(XRD)(Bruker D8 Advance X);X射线光电子能谱(XPS)(Thermo ESCALAB 250Xi);N2吸脱附仪(BET)(麦克仪器公司ASAP2020);透射电子显微镜(美国FEI Tecnai G2 F20);扫描电子显微镜(德国Zeiss sigma 500)。
1.2 实验材料
实验过程中所用药品试剂及其他耗材如表1所示。
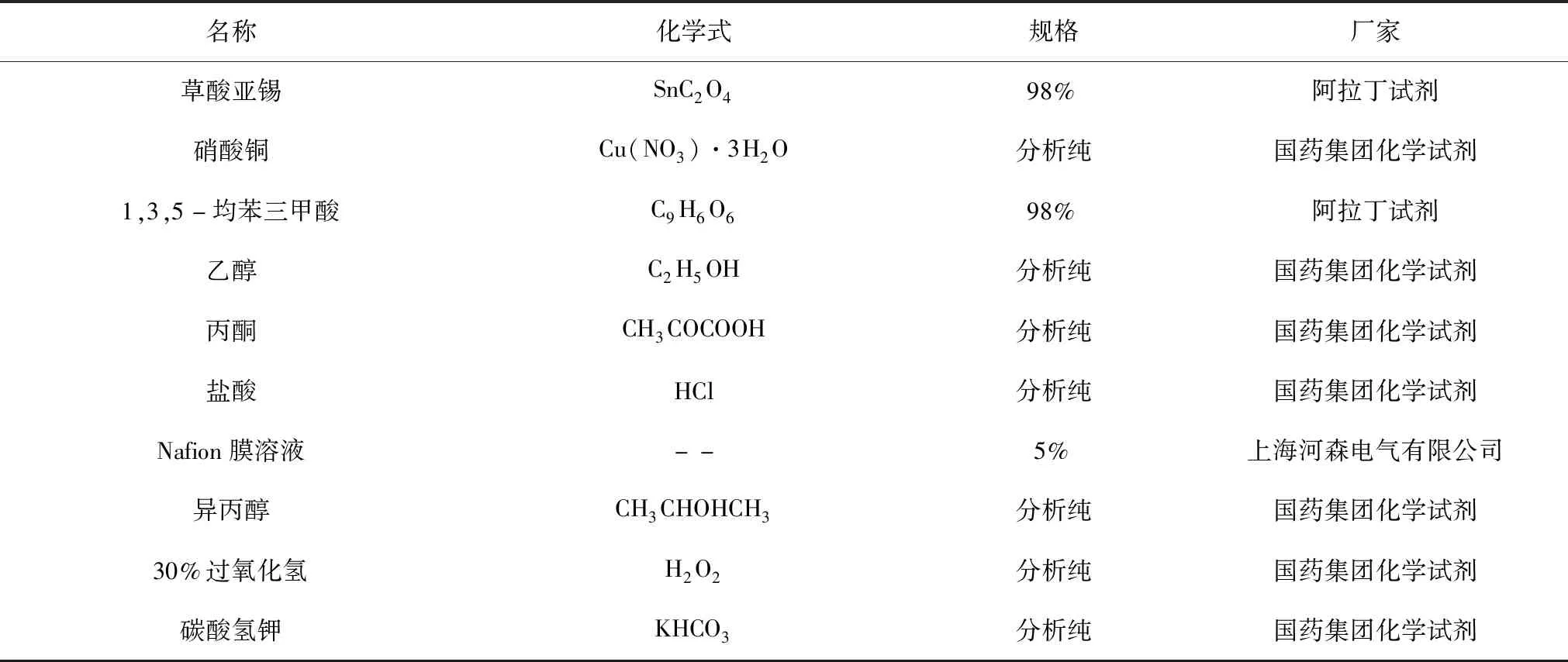
表1 实验所用试剂及耗材Table 1 Chemicals and Consumable Materials
2 方法与结果
2.1 催化剂及电极制备
分别制备Cu-BTC、SnCuOx催化剂后制备电极用于CO2电化学还原。
2.1.1 Cu-BTC制备
取一定量的Cu(NO3)2·3H2O溶于去离子水中配制溶液A;另取一定量1,3,5-均苯三甲酸(H3BTC)溶于一定量乙醇中得溶液B;将A溶液缓慢滴加至B溶液中,然后将所得混合溶液转移至100mL反应釜中,110℃晶化12h,冷却至常温后,将产物抽滤,采用50%乙醇水溶液洗涤3次,所得滤饼置于烘箱中60℃干燥12h,制备得到Cu-BTC,合成过程中Cu与BTC的物质的量比为n(Cu)∶n(BTC)=3∶2。
2.1.2 催化剂制备
取草酸亚锡与上述所制Cu-BTC按照一定质量比充分混合,然后置于马弗炉内由室温升450℃,升温速率为3.5℃/min,在450℃下焙烧3h,之后缓慢降至室温,即得催化剂。草酸亚锡所占总质量比分别为0%,20%,50%,80%,85%,所制备催化剂标记为CuO,20%SnCuOx,50%SnCuOx,80%SnCuOx,85%SnCuOx。
2.1.3 电极制备
取一定面积的碳布,先使用5M的盐酸润洗,然后用超纯水洗净;再用丙酮润洗碳布,最后用超纯水洗净后自然风干。
取上述催化剂10mg,加入至0.5mL的试管内,分别用5~50μL和100~1000μL的移液枪取20μL的膜溶液和250μL的异丙醇溶液并加入至催化剂所在试管内,然后放置在频率为80kHz的超声波清洗器内超声45min,得催化剂悬浊液。用移液枪取一定量催化剂悬浊液,将其均匀涂抹在上述碳布的两面,自然风干。将所附载催化剂置于铂电极夹,即得到所用工作电极。
2.2 电化学还原CO2制甲酸
电化学还原CO2制甲酸过程是在三电极体系两室型电解池中进行的,反应在常温常压下进行,以Pt电极为对电极,Ag /AgCl为参比电极,上述制备电极为工作电极,0.5mol /L KHCO3溶液为电解液,通电之前向电解池中通入至少30 min CO2排除空气,并使溶液中CO2饱和,然后保持CO2流速为10mL/min持续通入电解池。所得产物经气相色谱和液相色谱分析。
法拉第效率计算公式:
FE=nzF/C
其中FE 为法拉第效率;n为所得甲酸的物质的量;z为产生1mol甲酸转移电子量,此处为常数2;F为法拉第常数;C为电解过程通入的总电量。
图1为不同比例草酸亚锡掺杂的SnCuOx催化剂电化学还原CO2制甲酸反应结果。由图可知,在-1.83V恒电位电解情况下,Sn掺杂后催化剂法拉第效率明显增高,初始掺杂后,20%SnCuO催化剂法拉第效率升至40%以上,且随着Sn掺杂量的增加,SnCuOx催化剂的法拉第效率呈现出先增加后减小的趋势。在50%SnCuO催化剂上法拉第效率最大。
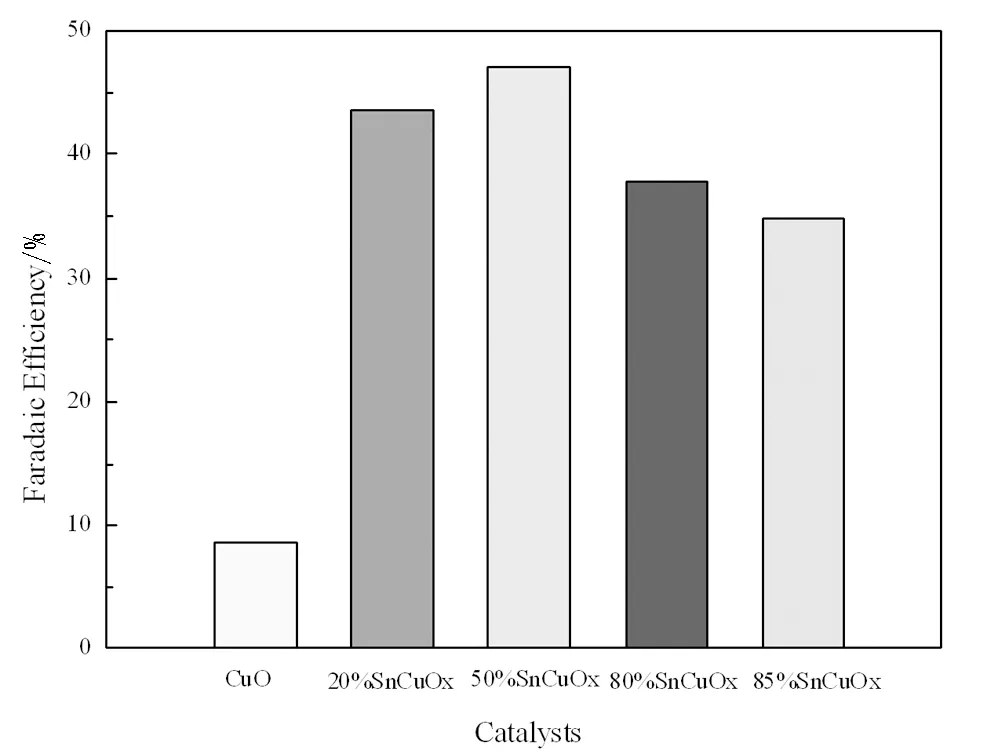
图1 不同催化剂电化学还原CO2生产甲酸的法拉第效率Fig.1 The Faradaic efficiency of the different catalysts for the CO2 electroredction
2.3 催化剂织构性质表征
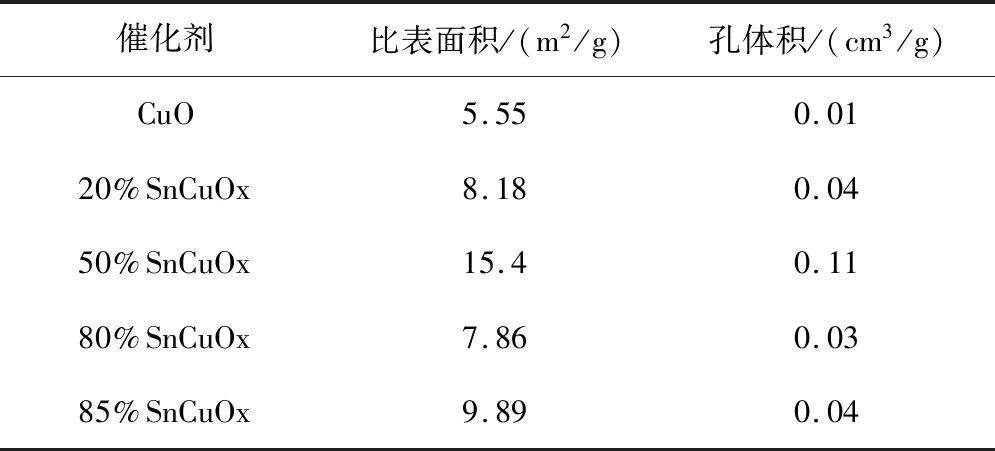
表2 不同催化剂的表面织构性质表征Table 2 the textural properties of the different catalysts
图2为不同催化剂的织构性质表征结果。由图可知,相较与CuO催化剂,Sn的引入,增加了催化剂的比表面积和孔体积。随着Sn掺杂量的增加,催化剂的比表面积及孔体积呈现出先增加后降低而后又增加的趋势,50%SnCuOx催化剂具有最大的比表面积和孔体积。
2.4 催化剂XRD表征
图2为不同Sn掺杂后催化剂的XRD表征结果。由图可知,Cu-BTC焙烧后所得催化剂晶相主要为CuO结构 (JCPDS No.44-0706),随着Sn掺杂量的增加,催化剂中CuO衍射峰逐渐减弱,SnO2衍射峰逐渐增强(JCPDS No.41-1445)。对于50%SnCuOx催化剂,SnO2的衍射峰开始显现,但催化剂仍以CuO晶相结构为主。50%SnCuO催化剂中可明显看出CuO和SnO2的衍射峰,表明催化剂中有两种晶相共存。80%SnCuOx和85%SnCuOx催化剂中CuO衍射峰已不明显,催化剂表现出明显的SnO2结构,且随着Sn掺杂量的升高,SnO2衍射峰强度逐渐增高,根据谢乐公式可知,随着Sn掺杂量的升高,SnCuOx催化剂晶粒尺寸逐渐变大。

(a.CuO,b.20%SnCuOx,c.50%SnCuOx,d.80%SnCuOx,e.85%SnCuOx)图2 不同催化剂XRD表征结果Fig.2 The XRD pattern of the different catalysts
2.5 催化剂XPS表征
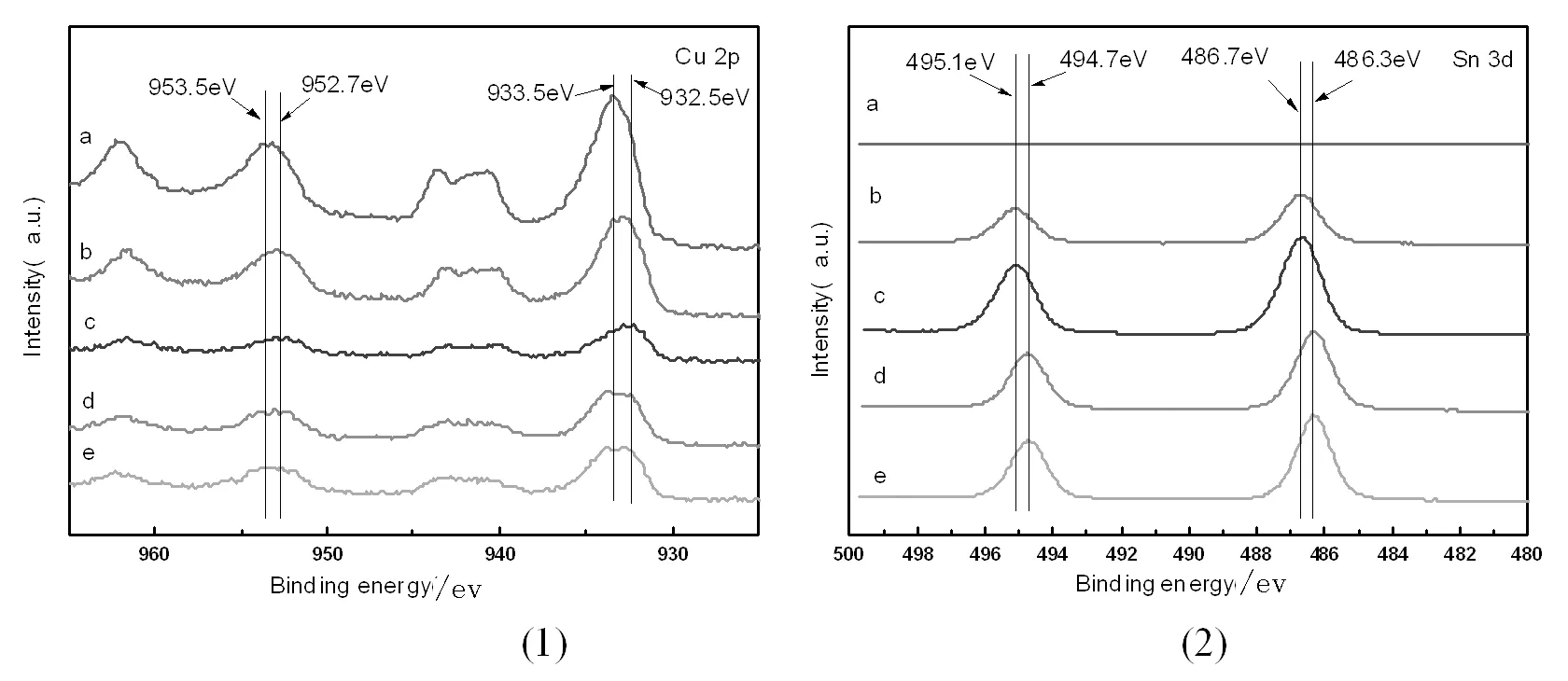
(a.CuO,b.20%SnCuOx,c.50%SnCuOx,d.80%SnCuOx,e.85%SnCuOx)图3 不同催化剂XPS表征结果Fig.3 The XPS results of the different catalysts ((1)Cu2p;(2)Sn3d)
图3为不同催化剂XPS表征结果。图(1)为不同催化剂的Cu2p能谱结果,由图可知,未用Sn掺杂的催化剂中Cu主要以CuO的形式存在;随着Sn掺杂量的增加,催化剂中Cu的峰向低结合能方向移动,这表明,催化剂中部分Cu被还原为低价态,部分以Cu2O的形式存在。图(2)为不同催化剂的Sn3d能谱结果,由图可知,随着Sn掺杂量的增加,催化剂中Sn的峰也向低结合能方向移动,表明在高Sn掺杂量的催化剂中Sn也是低价态的形式存在。当少量Sn进行掺杂时,催化剂中的Sn主要以高价态存在,随着掺杂量的增加,85%SnCuOx催化剂主要表现出SnO的形式存在。
上述结果表明,在较低Sn掺杂的催化剂中,Sn容易被氧化为较高的价态,而随着Sn掺杂量的增加,Cu逐渐被还原,在高Sn掺杂量的催化剂中Sn、Cu两种元素皆以低价态存在。50%SnCuOx催化剂中Cu、Sn两种元素皆存在丰富的价态,催化剂具有较为丰富的电子结构。
2.6 催化剂电镜表征(SEM,TEM)
图4为不同催化剂的扫描电镜照片。由图可知CuO主要表现出光滑的片层形貌,随着Sn的引入,催化剂小颗粒逐渐增多,50%SnCuOx催化剂呈现出片层表面满负载颗粒的形貌,80%SnCuOx催化剂则主要表现为小颗粒的聚集,85%SnCuOx催化剂小颗粒团聚效果更为明显,这也在一定程度上解释了随着Sn掺杂量的增加催化剂的比表面积逐渐下降的原因。

(a.CuO,b.20%SnCuOx,c.50%SnCuOx,d.80%SnCuOx,e.85%SnCuOx)图4 不同催化剂扫描电镜照片Fig.4 The SEM images of the different catalysts

(a.CuO,b.20%SnCuOx,c.50%SnCuOx,d.80%SnCuOx,e.85%SnCuOx)图5 不同催化剂透射电镜照片Fig.5 The TEM images of the different catalysts
图5为不同催化剂的透射电镜照片,由图可知,CuO催化剂呈现较大的晶粒结构,随着Sn的引入,SnO2主要以细小晶粒存在,且随着Sn掺杂量的增加,SnO2的晶粒尺寸逐渐增大,这与XRD表征结果是一致的。
3 讨论与结论
催化剂电化学反应性能和催化剂织构性质结果表明,在低Sn掺杂量下,催化剂的电化学反应性能与催化剂比表面积呈正相关的关系;比表面积的增大有助于增强催化剂与反应物之间的传质,有助于促进反应性能增强。XRD和TEM的结果表明,随着Sn掺杂量的增加,催化剂晶粒尺寸在逐渐增大。同时SEM结果表明,随着Sn掺杂量的增加,催化剂颗粒团聚程度逐渐加剧,这应该是造成催化剂比表面积呈现先增加后下降的主要原因。
XPS结果表明,随着Sn掺杂量的增高,催化剂中Cu、Sn两种元素皆以低价态形式存在为主,50%SnCuOx催化剂中Cu、Sn两种元素高价态和低价态皆存在,且含量较为丰富,催化剂具有较为丰富的电子结构。丰富的电子结构有助于促进催化剂反应活性。而对于85%SnCuOx催化剂,比表面积增大,反应性能反而下降。这也进一步证明,催化剂反应性能不仅与比表面积有关,同时受催化剂表面的电子结构影响。
综上所述,本文以Cu-BTC和草酸亚锡为前驱体制备不同Sn/Cu比的催化剂,研究了由Cu基MOF材料制备催化剂进行电化学还原二氧化碳制甲酸的反应性能,并深入研究了Sn掺杂量的不同导致催化剂反应性能产生差异的主要原因。相较与CuO催化剂,Sn的引入增强了催化剂的反应性能,且50%SnCuOx催化剂表现出最高的法拉第效率,可达47%,催化剂比表面积、表面电子机构、化学价态等物理化学性质的变化是催化剂法拉第效率呈现先升高后降低的主要原因。不同Sn掺杂量引起的催化剂中金属还原程度、晶形结构的变化,则是引起催化剂表面性质发生变化的主要原因。本论文的研究可为探索MOF材料在制备高效CO2电化学还原催化剂的广泛应用提供理论和实验依据。
