伊伐布雷定对大鼠心脏正性肌力的作用机制
2020-03-30张文慧朱晓佳王羽维高倩雯肖钰洁
张文慧,高 丽,朱晓佳,王羽维,高倩雯,肖钰洁,李 伟,陈 龙
0 引 言
伊伐布雷定是全球第一个If电流抑制剂,If电流是超级化缓慢激活的内向钠、外向钾混合内向的离子流,在-110到-100 mV被激活,翻转电位在-10到-20 mV,受cAMP (Cyclic Adenosine monophosphate)调控[1]。主要用于治疗射血分数降低的慢性心力衰竭患者,特别是对于β肾上腺素受体阻断剂或者钙通道受体阻断剂不能耐受或存在禁忌的心绞痛患者[2]。2005年欧洲药监局批准了伊伐布雷定的上市,2015年美国FDA批准了伊伐布雷定用于慢性心衰的治疗[3]。我国国家食品药品监督管理局于2015年4月批准伊伐布雷定用于心衰的治疗,以减少心力衰竭恶化而住院的风险[4]。
有报道指出伊伐布雷定治疗稳定性心绞痛及心肌缺血完全依赖于对If电流的抑制作用[5]。也有报道称伊伐布雷定的作用机制涉及多方面,包括对血管及心脏结构及功能的影响[6]。长期使用伊伐布雷定可增加心力衰竭大鼠的心脏收缩力,改善db/db心衰小鼠左心室收缩力及增加受磷蛋白磷酸化[7-8]。临床试验表明伊伐布雷定对动脉血压的作用呈现出不一致的结果,增加、降低或无作用[9];也有文献报道伊伐布雷定具有明确增加动脉血压作用[10]。
基于文献报道的伊伐布雷定正性肌力作用,本研究首次采用双压力导管分析伊伐布雷定心脏收缩力及血压的作用,并分析其心输出量。为了证明伊伐布雷定对体内大鼠的正性肌力作用是独立于神经体液,体外大鼠心脏灌流实验被用于分析伊伐布雷定对心脏的直接作用,且体外心脏固定频率刺激模式(4 Hz)被用于排除频率对左心室收缩力的影响。利用体外心脏灌流化合物浓度可控的优点,采用与心脏收缩力直接相关3种酶的抑制剂PKA抑制剂H89, CaMKII抑制剂KN-93, PP1、PP2A抑制剂Calyculin A,分析伊伐布雷定正性肌力作用的可能靶点。体外心脏实验及钙释放实验不仅进一步证实其正性肌力作用,并进行了其作用机制探讨。
1 材料与方法
1.1 药品与试剂伊伐布雷定购于美国Sigma公司;PKA抑制剂H89及CaMKII抑制剂KN-93购于Selleck公司;PP1、PP2A抑制剂Calyculin A购于Genne Operation公司;荧光染色剂Fluo-4 AM购于东仁化学科技(上海)有限公司;其他试剂均购于Sigma公司。
1.2仪器PowerLab 8/35多导生理记录仪(AD Instruments,澳大利亚);35-2083 Rev. F Millar放大器、SPR-901 型双压力Millar心室内压和压力容积导管(MILLAR公司,美国);Olympus IX53倒置显微镜(Olympus公司,日本);ZYLA-5.5-CL3科研级高灵敏致冷CCD(ANDOR公司,英国);Lambda DG-4超高速波长切换装置(Sutter,美国);VC3-8灌流给药系统(ALA公司,美国)。
1.3实验动物雄性SD大鼠,体重250~300 g,购于南京中医药大学实验动物中心,实验动物生产许可证:SCXK(苏)2012-0008,实验动物使用许可证:SYXK(苏)2011-0053。在温度23℃、相对湿度60%~70%,12~12 h明暗周期的饲养室自由进食和饮水。
1.4浓度计算按照伊伐布雷定的说明书,最终选择浓度为1mg/kg 伊伐布雷定进行体内实验。根据文献[11],伊伐布雷定对单个新生大鼠的心肌细胞上测量动作电位,所使用的浓度是10 μmol/L,所以我们选择此浓度。体外实验H89,KN-93及CA分别选择为200、500、10 nmol/L,以确保其PKA,CaMKII,PP1及PP2A超过半数活性被抑制[12-15]。
1.5体内大鼠血流动力学分析健康清洁级雄性SD大鼠,腹腔注射20%乌拉坦(5 mL/kg)麻醉。大鼠全麻后,将其四肢固定于保温台上,分离其体右侧位的颈总动脉,动脉开口后插入已定标的双压力Millar导管至大鼠的左心室内,手术线固定。打开Labchart 8软件,观察其波形,不断微调导管在心室内的位置,直到大鼠状态稳定,环的位置不变化且呈现规则的矩形状[15-16]。大鼠的收缩压、舒张压、容积3个波形都稳定时即停止调导管位置。待稳定后,记录给药前各指标作为空白对照。空白对照记录结束后,将伊伐布雷定溶于0.3 mL等渗盐水经大鼠颈静脉给药,待药效稳定后记录大鼠加药后左心室压力及容积、心输出量、心率、动脉收缩压及动脉舒张压。实验结束后,自颈静脉推注30%高渗盐水20~50 μL及取自身血液进行容积定标。采用7只大鼠重复上述实验 (n=7),以给药前记录数据为空白A组,给药后记录数据为给药A组,比较给药前后各指标变化。
1.6体外大鼠心脏左心室收缩力分析选取雄性SD大鼠进行麻醉(方法同体内实验),迅速剪开胸腔,剪取心脏,放置于0 ℃至4 ℃无钙台氏灌流液中使其停搏。将体外大鼠心脏挂于已充满灌流液的Langendorff装置上行插管后,在充氧 (95%O2+5%CO2),温度为 (37.5±0.5)℃条件下,经主动脉逆行灌流体外心脏含钙台氏液,灌流压为90 cm H2O (1 cm H2O=0.098 kPa)。将压力换能器插管内充满灌流液并排空气泡,经由左心房插入左心室,连接RM6240型多道生理信号采集处理系统,记录左心室收缩曲线。曲线稳定后,由刺激器通过一对刺激电极以5 V的强度加于体外心脏两侧,刺激心脏以4 Hz固定频率(即心率240)进行跳动。记录加药前收缩曲线作为空白对照,随后更换含一定浓度药物灌流液,待药效稳定后,记录收缩曲线,记录参数为左心室发展压 (left ventricular-developed pressure, LVDP)。灌流液的组成(mmol/L): NaCl 135, Glucose 10, KCl 5.4, HEPES 5, MgCl21, NaH2PO40.33, CaCl21.8, NaOH调pH至7.3。灌流顺序如下:正常灌流液→含1 μmol/L伊伐布雷定灌流液→含10 μmol/L伊伐布雷定灌流液;正常灌流液→含200 nmol/L H89灌流液→含200 nmol/L H89和10 μmol/L伊伐布雷定灌流液;或正常灌流液→含500 nmol/L KN-93灌流液→含500 nmol/L KN-93+10 μmol/L 伊伐布雷定灌流液;或正常灌流液→含10 nmol/L CA灌流液→含10 nmol/L CA+10 μmol/L伊伐布雷定灌流液。实验中4个灌流顺序均重复6例。正常灌流液作为空白B组(n=6),含伊伐布雷定(1, 10 μmol/L)灌流液为给药B组(n=6);将正常灌流液设置为H89、 KN-93及CA对照组,将H89 (200 nmol/L)、KN-93 (500 nmol/L)、CA (10 nmol/L)分别设置为H89、KN-93、KN-93处理组,另将伊伐布雷定(10 μmol/L)+H89 (200 nmol/L)、KN-93 (500 nmol/L)、 CA (10 nmol/L处理)分别设置为伊伐布雷定+ H89 处理组、KN-93处理组、CA 处理组(n=6)。
1.7心肌细胞钙释放测定雄性SD大鼠麻醉(方法同体内实验)后,将体外心脏Langendorff装置上灌流(方法同体外心脏灌流实验),用含2 mg/mL CollagenaseⅡ及0.1 mg/mL胰蛋白酶消化大约30 min。剪取心脏于无钙台氏灌流液中充分剪碎,过滤,得到细胞悬液,静置后用无钙台氏灌流液反复冲洗2次。随后去除细胞外的无钙台氏液分别加入0.25、0.5、1 mmol/L钙离子的台式液进行梯度复钙,每个梯度浓度复钙时间为10 min。待复钙完成后,取出1 mL含适量心肌细胞悬液加入钙荧光指示剂Fluo-4 AM,使细胞悬液中Fluo-4 AM (5 μmol/L),于37 ℃避光孵育30 min。孵育荧光剂完成的心肌细胞再复钙,用含钙(1 mmol/L)台氏液清洗2~3次后备用。在倒置显微镜的灌流槽中滴加染有荧光剂的细胞悬液,待细胞贴壁后,替换细胞外液体为含钙 (1.8 mmol/L)台氏液。由刺激器通过一对刺激电极以1 Hz,15 V的强度加于心肌细胞两侧,刺激细胞收缩。选取长杆状,横纹清晰,折光度好,荧光度强的细胞。单色激发光源发出激发光,通过耦合系统引入荧光显微镜,并聚焦到细胞表面,激发细胞中的荧光探针Fluo-4 AM发出荧光,采用空气冷却CCD相机采集并记录荧光信号[17]。激发波长为488 nm,吸收波长510 nm。以正常稳定状态作为空白对照,随后替换含一定浓度药物外液作为待测药物的药效。实验中4个灌流顺序均重复6例,细胞外液体更换顺序及数据分组同上体外心脏实验,比较伊伐布雷定分别在H89、KN-93及CA干预下对钙释放幅值的影响。

2 结 果
2.1伊伐布雷定对体内大鼠血流动力学参数的作用结果表明给药组LVDP、心输出量(CO)及动脉收缩压(SBP)较空白组显著增加(P<0.05),心率降低(P<0.05),而舒张压(DBP)差异无统计学意义(P>0.05),见表1。大鼠左心室发展压、动脉压变化的代表性曲线见图1。



动力学参数LVDP(mmHg)HR (次/min)CO (mL/min)SBP (mmHg)DBP (mmHg)空白A组(n=7)102.43±11.06348.56±10.0233.72±1.9699.74±8.6754.71±3.30给药A组(n=7)109.86±11.65∗324.17±11.33∗36.27±2.22∗108.57±9.24∗55.85±3.67
与空白A组比较,*P<0.01
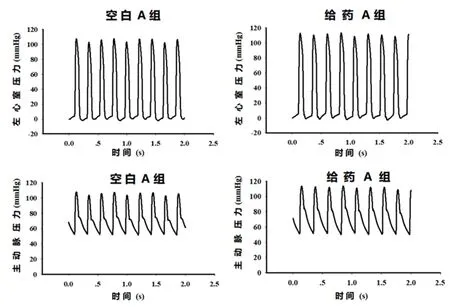
图1 伊伐布雷定对大鼠左心室和主动脉压力作用的代表性曲线
Figure 1 Representative curves of rat left ventricular and aortic pressure changes by ivabradine
2.2伊伐布雷定及其在H89和KN-93及CA干预对体外大鼠收缩力的作用给药B组LVDP(144.05±5.75)较空白B组(100.00±7.68)明显增加(P<0.01)。H89处理组及KN-93处理组左心室发展压显著低于其对照组(P<0.01),CA处理组较CA对照组显著增加(P<0.01);伊伐布雷定+KN-93处理组大鼠体外心脏发展压较KN-93处理组差异无统计学意义(P>0.05)。见表2。伊伐布雷定对大鼠左心室发展压变化的代表性曲线见图2。


组别nLVDP(mmHg)钙释放幅值H89对照组6100.00±25.91100.00±35.46H89处理组687.15±19.80∗89.33±37.56∗∗伊伐布雷定+H89处理组6100.12±23.75#95.75±38.83∗#KN-93对照组6100.00±32.91100.00±24.10KN-93处理组692.99±30.85△△87.89±16.37△伊伐布雷定+KN-93处理组694.39±29.91△86.60±16.62△CA对照组6100.00±25.30100.00±37.29CA处理组6131.51±18.67○○116.06±48.07○伊伐布雷定+CA处理组6142.97±19.91○○●●122.86±44.51○○●
与H89对照组比较,*P<0.05,**P<0.01;与H89+伊伐布雷定处理组比较,#P<0.05;与KN-93对照组比较,△P<0.05、△△P<0.01;与CA对照组比较,○P<0.05,○○P<0.01;与CA+伊伐布雷定处理组比较,●P<0.05,●●P<0.01
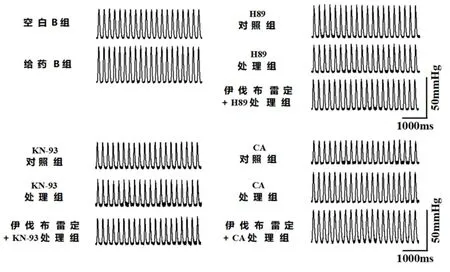
图 2 伊伐布雷定及在H89和 KN-93及CA干预下对大鼠体外心脏LVDP作用的代表性曲线
Figure 2 Representative curves of ratLVDPchanges by ivabradine in the absence and presence of H89 or KN-93 or CA
2.3伊伐布雷定及其在H89和KN-93及CA干预对大鼠左心室心肌细胞钙释放的作用实验表明给药B组左心室肌细胞钙释放的幅值(118.06±16.81)较空白B组(100.00±8.42)增加 (P<0.01)。H89处理组及KN-93处理组左心室肌细胞钙释放的幅值均低于其对照组(P<0.05),CA处理组较CA对照组显著增加(P<0.01)。其中,伊伐布雷定+KN-93处理组大鼠体外心脏发展压相较KN-93处理组差异无统计学意义(P>0.05)。见表2。大鼠左心室肌细胞钙释放幅值变化的代表性曲线见图3。

图 3 伊伐布雷定及在H89和 KN-93及CA干预下对大鼠左心室肌细胞Ca2+瞬变作用的代表性曲线
Figure 3 Representative curves of ratleft ventricular myocyte Ca2+transient changes by ivabradine in the absence and presence of H89 or KN-93 or CA
3 讨 论
传统的β受体阻滞剂在降低心率的同时,也产生负性肌力作用,使得部分患者不能耐受,尤其对哮喘患者[18]。伊伐布雷定对血压偏低的慢性充血性心力衰竭、快速房性心律失常及窦性心动过速患者,其临床疗效及安全性明显好于β受体阻滞剂[19]。对伊伐布雷定的基础及临床研究较多关注心率的变化(变时作用)对心衰及心肌缺血的作用,而对心肌收缩力(变力作用)的研究较少,伊伐布雷定正性肌力作用的研究呈现不一致报道[9-10]。但越来越多的研究表明伊伐布雷定的临床治疗作用不仅仅是通过抑制If电流减慢心率,其作用机制是多方面的[6],其中多样性机制之一是伊伐布雷定增加心衰大鼠的心肌收缩力[7,20]。
大鼠体内双压力导管实验表明伊伐布雷定在显著降低心率的条件下,仍能增加心输出量,且能增加室内压、主动脉收缩压及心输出量。这种体内大鼠的正性肌力作用,同样在4 Hz频率(即心率为240)触发下大鼠体外心脏灌流实验中进一步得到确认。采用电生理的方法,用固定频率触发体外心脏收缩,排除伊伐布雷定引起心率下降对收缩力的影响。至此,通过体内及体外心脏实验,明确了伊伐布雷定的正性肌力作用是独立于神经体液及心率变化。
本研究另外一个研究重点是探索其正性肌力作用的靶点,虽然有研究表明伊伐布雷定临床治疗作用机制是多方面的。但文献报道表明,给予糖尿病小鼠灌胃伊伐布雷定四周,能够明显改善其心脏收缩或舒张功能,增加糖尿病小鼠心肌细胞受磷蛋白(Phospholamban, PLB)-17位磷酸化[8]。在正常生理情况下,心肌细胞发生去极化后,钙离子通过L型钙通道流入到胞内,产生钙诱导的钙释放,激活肌浆网囊泡上的兰尼碱受体,导致其释放大量的钙离子到细胞质中,产生心肌收缩。胞内高钙浓度激活了肌浆网囊泡上的钙泵(SERCA2a),超过70%的钙离子被钙泵摄入肌浆网内[21]。PLB(受磷蛋白)发挥调节SERCA2a活性的重要作用,PLB去磷酸化时与SERCA2a相结合,抑制SERCA2a对钙离子的亲和力。而PLB磷酸化后与SERCA2a解离,SERCA2a对钙离子的亲和力增加,对钙离子的回摄能力提高[22]。PLB有3个磷酸化位点,即丝氨酸-16、苏氨酸-17、丝氨酸-10位点;丝氨酸-16位点由蛋白激酶A磷酸化,苏氨酸-17位点由CaMKⅡ磷酸化,蛋白磷酸酶去磷酸化[23-24]。本研究的体外心脏灌流实验表明CaMKⅡ的抑制剂KN-93能够阻断伊伐布雷定的增加体外大鼠心脏收缩力的作用,表明其作用靶点与CaMKⅡ有关。而进一步的钙释放实验表明CaMKⅡ的抑制剂KN-93能够阻断伊伐布雷定的增加钙释放的作用。但伊伐布雷定通过CaMKⅡ发挥正性肌力作用机制仍然有待进一步研究。
本研究表明伊伐布雷定对正常大鼠具有正性肌力作用,其作用机制是通过CaMKⅡ发挥作用,与抑制If电流无关。临床上慢性充血性心力衰竭的治疗,β受体阻滞剂由于在降低心率的同时存在负性肌力的作用而限制了其临床上的应用;而伊伐布雷定在降低心率的同时,仍然能增强心肌收缩力。因此,伊伐布雷定优于β受体阻滞剂,不仅仅是β受体阻滞剂具有负性肌力作用,还在于伊伐布雷定的正性肌力作用。
