龙山豆豉细菌多样性分析及其与当阳豆豉差异性比较
2020-03-28王玉荣陈江红张振东
王 强,王玉荣,陈江红,张振东,蔡 伟,郭 壮
(湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053)
豆豉是黑豆或黄豆等在细菌、真菌以及酶的作用下发酵而成的一类特色食品[1]。据记载,豆豉在我国的制作历史可追溯至秦汉时期,目前在我国湖南、湖北、四川、重庆、云南和贵州等地依然保留着制作和食用豆豉的习惯[2]。传统发酵豆豉制作方法较为粗放,产品品质除受原料和工艺的影响外,环境中的微生物对豆豉滋味、气味、色泽和营养成分的形成也发挥着独特的作用[3-5]。
杜霞等[6-7]采用传统方法从江西发酵型豆豉和贵州三穗细菌型豆豉中均分离出芽孢杆菌属(Bacillus)菌株;任璐等[8]从永川和三台毛霉型豆豉中分离出产β-葡萄糖苷酶、纤维素酶和蛋白酶能力不同的2株总状毛霉(Mucor racemosus);LIU C J等[9]采用分离纯化的方法从云南省六个不同地区采集的30份传统发酵咸豆豉中分离出隶属于乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、肠球菌属(Enterococcus)和芽孢杆菌属等不同细菌属的226株菌株。这些研究均采用的是基于纯培养的微生物学分离鉴定方法,易受微生物种类、操作方法及培养条件的限制而不能全面反映豆豉中微生物多样性。近年来,聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gel gradient electrophoresis,PCR-DGGE)和高通量测序等非培养技术因具有操作简单、结果准确、直观的特点逐渐被应用到豆豉微生物多样性的研究中。CHEN T等[10-11]分别使用DGGE和高通量测序技术对江西地区豆豉中微生物进行研究,发现其内细菌主要为乳酸球菌属(Lactococcus)、葡萄球菌属(Staphylococcus)和乳杆菌属,真菌主要为横梗霉属(Lichtheimia);CHEN C等[12]采用PCR-DGGE技术研究发现,吉林地区豆豉中的优势菌属为芽孢杆菌属。
为了进一步探讨不同地区产豆豉细菌多样性的差异,本研究从湖南省湘西土家族苗族自治州龙山县采集了5份细菌型豆豉,在前期研究[13]基础上,使用Illumina MiSeq高通量测序技术对其中的细菌多样性及群落结构组成进行解析,并采用多元统计学手段对其与当阳豆豉细菌多样性间的差异进行分析,以期为后续细菌型豆豉微生物研究提供一定理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
龙山豆豉:采集自湖南省湘西土家苗族自治州龙山县(109°10′~110°53′E,28°45′~29°30′N),共5份,编号为LSDC1、LSDC2、LSDC3、LSDC4和LSDC5。所有的豆豉均为细菌型豆豉,制作时间为25~30 d。采样时取30 g左右样本分装于无菌离心管中运回实验室,并置于-80 ℃冰箱中备用。
1.1.2 化学试剂
QIAGEN脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphates,dNTPs)Mix、5×Trans StartTM、高保真DNA聚合酶(5 U/μL)、Fast Pfu Buffer:北京全式金生物技术有限公司;DNA 1000分析试剂盒:美国Agilent公司;111860琼脂糖:香港基因有限公司;DL 15 000 DNA Marker、6×Lodding Buffer:武汉天一辉远生物科技有限公司;DP214通用型DNA纯化回收试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
DW-86L626医用低温保存箱:青岛海尔特种电器有限公司;5810R台式高速冷冻离心机:德国Eppendorf公司;ABI Veriti 96孔梯度PCR仪:美国Applied Biosystems公司;DCodeTMSystem梯度凝胶电泳仪、PowerPacTMBasic稳压稳流仪、UVP CDS-8000凝胶成像分析系统:美国Bio Rad公司;ND-2000C微量紫外分光光度计:美国Thermo公司;DYY-12电泳仪:北京六一仪器厂;MiSeq PE300高通量测序平台:美国Illumina公司;HBM-400B拍击式无菌均质器:天津市恒奥科技发展有限公司。
1.3 方法
1.3.1 龙山豆豉样本前处理及总DNA提取
取豆豉样品10 g加入40 mL无菌蒸馏水,使用拍击器拍击5 min后在4 ℃、300 r/min条件下离心10 min,去除杂质,取上清液。采用DNA基因组提取试剂盒提取样本的总DNA,使用琼脂糖凝胶电泳检测DNA完整度。
1.3.2 16S rDNA基因的PCR扩增及测序
以检测合格的DNA为模板,338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')为引物进行PCR扩增,PCR扩增体系和程序参照YANG F等[14]的方法并略作改动。PCR扩增体系:模板10 ng,2.5 mmol/L dNTPs mix 2 μL,5×PCR Buffer 4 μL,5 μmol/L正向和反向引物各0.8 μL,5 U/μL DNA 聚合酶0.4 μL以及无菌双蒸水(ddH2O)11 μL。PCR扩增程序:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共循环30次;72 ℃再延伸10 min。采用1%的琼脂糖凝胶电泳对PCR扩增产物进行测定,将合格的产物进行清洁后使用Illumina Miseq系统进行测序。
1.3.3 生物信息学分析
参照文献[15]的方法将从Illumina MiSeq平台中获得的成对序列合成一条完整序列,根据相应标记将各序列分配至不同样本中,然后切除正反引物并进行序列质量控制。将质控合格的有效序列上传至QIIME(V1.9.1)分析平台[16],使用两步UCLUST算法[17]分别根据100%和97%相似度为标准将序列归类至不同的操作分类单元(operational taxonomic unit,OTU)中,然后挑选代表性序列与Greengenes数据库[18]进行比对,明确其微生物学分类地位。
将平均相对含量>1.0%的细菌门或属定义为优势细菌门或优势细菌属,将在各样品中均存在的细菌属或OTU定义为核心细菌属或核心OTU,未鉴定出的序列定义为unclassifiled。
1.3.4 数据处理
使用主坐标分析(principal co-ordinates analysis,PCoA)和非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)等Beta多样性指数分析龙山豆豉与当阳豆豉细菌差异性;利用R3.5.0中的ggplot和reshape包对龙山豆豉优势细菌门和属进行分析并绘制优势细菌门属相对含量图;使用Origin 2017绘制核心OTU相对含量堆积柱状图及龙山和当阳两组豆豉差异箱型图,并使用曼惠尼(Mann-Whitney)分析中的蒙特卡罗置换检验(Monte Carlo permutation test)判断两组样本差异显著性。
2 结果与分析
2.1 龙山豆豉细菌多样性分析
通过质控,从5个龙山豆豉样本中共检测出326 820条高质量序列,平均每个样品65 364条序列。在100%序列相似性下,采用UCLUST算法将所有序列划分为162 887个OTU,在97%序列相似性下又进一步将所有序列归入15 641个OTU,经比对这些OTU可划分为18个门、49个纲、75个目、148个科以及249个属。
2.2 龙山豆豉细菌群落结构分析
2.2.1 基于门水平龙山豆豉细菌群落结构分析
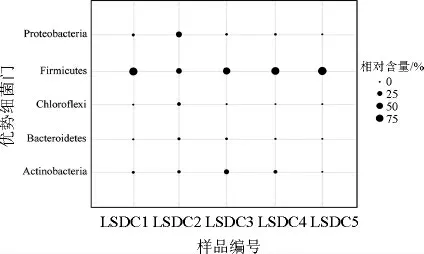
图1 龙山豆豉样品中优势细菌门及其相对含量Fig.1 Dominant bacteria phyla and its relative content in Longshan douchi samples
由图1可知,龙山豆豉中的优势细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),其中,Firmicutes的平均相对含量(77.43%)最高,占绝对优势。除含有较多的Firmicutes外,样品LSDC2中含有41.48%的细菌隶属于Proteobacteria,样品LSDC3中有26.91%的细菌隶属于Actinobacteria,且在样品LSDC2中,Proteobacteria的相对含量高于Firmicutes(35.98%)。值得一提的是,在样品LSDC5中仅检测出两个细菌门,即Firmicutes和Proteobacteria,相对含量分别为99.99%和0.01%,说明在龙山豆豉发酵过程中起主导作用的细菌隶属于厚壁菌门。
2.2.2 基于属水平龙山豆豉细菌群落结构分析

图2 龙山豆豉样品中优势细菌属及其相对含量Fig.2 Dominant bacteria genera and its relative content in Longshan douchi samples
由图2可知,龙山豆豉样品中的优势细菌属为芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、葡萄球菌属(Staphylococcus)、棒状杆菌属(Corynebac-terium)、肠球菌属(Enterococcus)、假单胞菌属(Pseudomonas)、明串珠菌属(Leuconostoc)、解硫胺素芽孢杆菌属(Aneurinibacillus)和Bavariicoccus,其平均相对含量分别为21.46%、15.83%、8.69%、8.38%、7.62%、7.14%、6.69%、4.65%、1.19%、1.10%。其中Bacillus、Pediococcus和Staphylococcus为核心优势细菌属。不同样品中各优势细菌属的相对含量不同,样品LSDC1中以Staphylococcus和Bacillus为主,样品LSDC2中以Pseudomonas为主,样品LSDC3中以Weissella和Corynebacterium为主,样品LSDC4中以Weissella和Pediococcus为主,特别地,样品LSDC5中Bacillus的相对含量高达83.47%,占绝对优势。各样品中不可鉴定到属水平的序列的相对含量较为相近,平均相对含量为9.55%,说明龙山豆豉中仍有大量细菌未被发掘。李世瑞等[19]采用454焦磷酸测序技术分析采集自湖南的曲霉型豆豉不同发酵阶段细菌多样性,发现Weissella、Bacillus、Staphylococcus、Lactococcus、Enterococcus和Pseudomonas都有检测出,与本研究结果较为相似。
豆豉样品中的核心OTU有12个,仅占OTU总数的0.08%,而其包含的序列有43 069条,占总序列数的13.18%,说明龙山豆豉中含有较多核心菌群。因此,进一步对核心OTU分类及其在各样品中的分布情况进行分析,结果见图3。

图3 豆豉样品中核心OTU及其相对含量Fig.3 Core OTU and its relative content in Longshan douchi samples
由图3可知,12个核心OUT为OTU13900、OTU9433、OTU14842、OTU1238、OTU6072、OTU8697、OTU12939、OTU7293、OTU436、OTU8673、OTU2592和OTU15057,其主要为隶属于Firmicutes 的Bacillus、Enterococcus、Lactobacillus、Staphylococcus和Weissella,隶属于Proteobacteria的肠杆菌属(Enterobacter)和Pseudomonas,以及隶属于Actinobacteria的假杆菌属(Pseudoclavibacter)。核心OTU在各样品中的分布差异较大,样品LSDC1中的OTU8673(Staphylococcus)、样 品LSDC2 中 的OTU436(Pseudomonas)、样 品LSDC4中的OTU1238(Enterobacter)和样品LSDC5 中的OTU13900(Bacillus)的相对含量明显高于其他样本,这与图1和图2分析结果基本一致。样品LSDC1~LSDC5中,核心OTU占各样品中OTU总数的比例分别为0.27%、0.23%、0.27%、0.29%和0.59%,其所包含的序列在各样本中的累积相对含量分别为23.19%、9.90%、4.92%、10.77%和17.48%,说明不同样品中除含有大量核心细菌外还含有多种特有细菌菌群。
2.3 龙山豆豉与当阳豆豉间细菌差异性分析
有研究表明,地理因素对豆豉中微生物丰度可能存在一定影响[20]。采用基于UniFrac距离矩阵的主坐标分析对采集自湖南龙山和湖北当阳的豆豉进行分析,结果见图4。
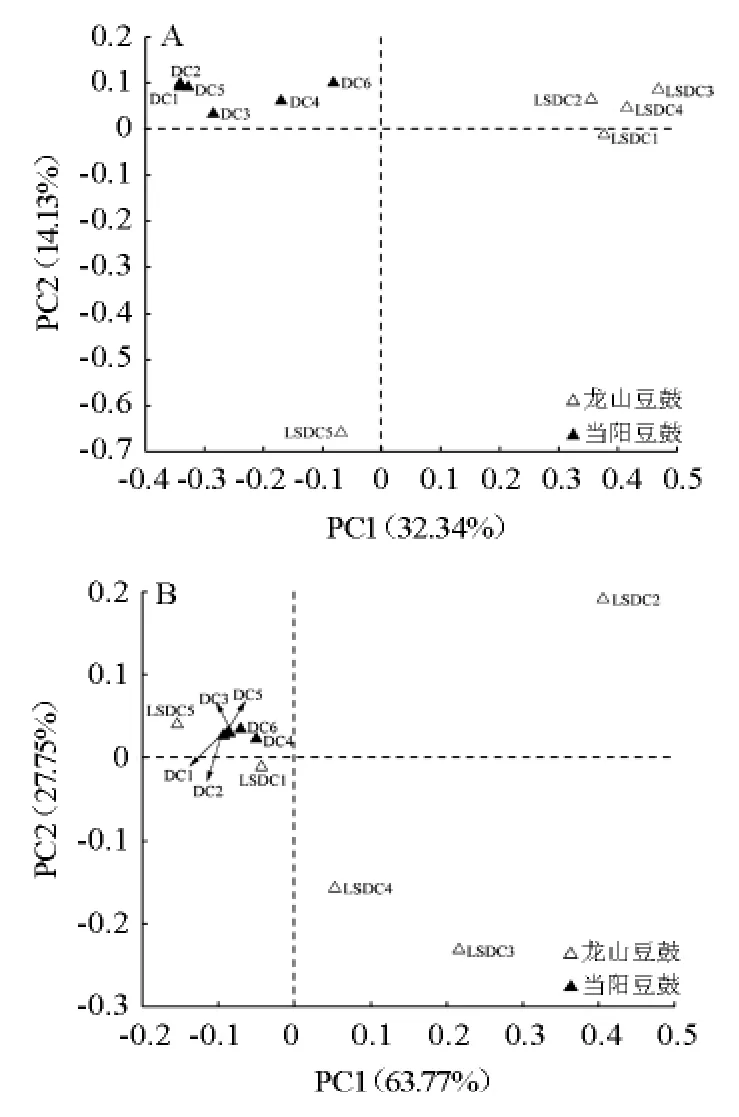
图4 基于非加权(A)和加权(B)UniFrac距离两个地区豆豉样品细菌菌群主坐标分析结果Fig.4 Principal coordinates analysis results of bacterial community in douchi samples from two regions based on unweighted (A)and weighted (B) UniFrac distance
由图4可知,当不考虑各样本中的菌群丰度时(图4A),第一和第二主成分的贡献率分别为32.34%和14.13%,龙山豆豉样本(LSDC1~LSDC5)分布在第一、三和四象限,且除样品LSDC5外,其他样本较集中,而当阳豆豉样本(DC1~DC6)全部分布在第二象限,在PC1维度上能将当阳豆豉与除LSDC5以外的龙山豆豉样本很好的区分开,两个地区样本间无交叠现象。将细菌在各样本中的相对含量纳入考虑范围对样本差异进行分析时(图4B),第一主成分的贡献率为63.77%,第二主成分的贡献率为27.75%,二者累积贡献率高达91.52%,龙山豆豉样本较非加权的算法更为分散,在四个象限中均有分布,而当阳豆豉样本更为集中,仍只分布在第二象限,两类样本间有交叠部分。说明两类豆豉样本细菌群落结构存在差异,且龙山豆豉样本间距离比当阳豆豉样本间距离更大。进一步使用基于UniFrac的UPGMA对样本间距离远近进行分析,结果见图5。

图5 两地区豆豉样本UPGMA分析结果Fig.5 UPGMA analysis results of douchi samples from two regions
由图5可知,龙山豆豉样品中除样品LSDC3和LSDC4外,其余样本各据一个分支,且样品LSDC2的分支长度最长,样品LSDC1和LSDC5较近,说明样品LSDC2与其他样本间距离最远,这与图4(B)分析结果一致。由图5可知,当阳豆豉全部集中在聚类树末端且各样本分支长度远小于龙山豆豉,这说明龙山豆豉样本间距离要大于当阳豆豉,为了对这一结论进行验证,对两个地区豆豉样品间的差异性进行分析,结果见图6。

图6 两个地区豆豉样品间差异性分析结果Fig.6 Difference analysis results of douchi samples from two regions
由图6可知,龙山豆豉各样本间的距离为0.39±0.09,当阳豆豉各样本间的距离为0.03±0.01,表明龙山豆豉组内各样本细菌群落结构差异性要比当阳豆豉组内差异性大。采用Mann-Whitney分析中的Monte Carlo permutation test发现,两组样本差异极显著(P<0.01)。本研究进一步对不同地区豆豉中优势细菌属相对含量的差异性进行了分析,结果见图7。
由图7可知,两个地区豆豉中优势细菌属共有10个,分别为Bacillus、Weissella、Staphylococcus、Pediococcus、Corynebacterium、Enterococcus、Pseudomonas、Leuconostoc、Aneuri-nibacillus和Bavariicoccus,其在龙山豆豉样品中的平均相对含量分别为(21.46±35.80)%、(15.83±11.49)%、(8.38±15.38)%、(8.69±10.72)%、(7.62±9.86)%、(7.14±6.72)%、(6.69±14.37)%、(4.65±5.09)%、(1.19±2.66)%和(1.10±1.17)%,其在当阳豆豉中的平均相对含量分别为(95.26±5.33)%、(0.23±0.51)%、(1.12±2.07)%、(0.30±0.73)%、(0.43±0.79)%、(0.06±0.12)%、(0.02±0.03)%、(0.01±0.02)%、(0.02±0.04)%和0。除Bacillus外,其余9个细菌属在龙山豆豉中的平均相对含量都远高于当阳豆豉,其中Bacillus、Pediococcus和Bavariicoccus在两组样本中的分布情况差异极显著(P<0.01)。代表龙山豆豉各细菌属分布的箱体总体较为狭长,最小值与最大值之间相隔较远,与之相比,代表当阳豆豉细菌属分布的箱体更为集中。表明龙山豆豉细菌多样性较高且个体间差异性较大,而当阳豆豉样本间细菌多样性差异性更小。造成两地区豆豉细菌群落结构差异的主要细菌属为Bacillus、Pediococcus和Bavariicoccus。
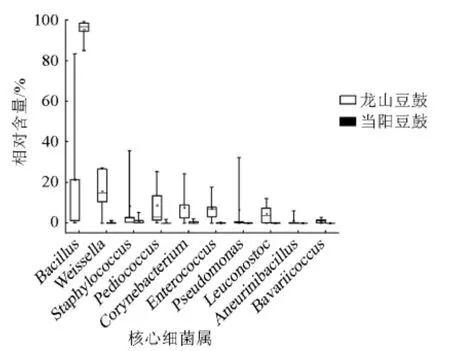
图7 两地区豆豉样品间差异分析箱型图Fig.7 Box diagram of difference analysis of douchi samples from two regions
3 结论
通过本研究发现龙山豆豉的优势细菌门有5个,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),且Firmicutes为核心菌门;优势细菌属有10个,分别为芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、葡萄球菌属(Staphylococcus)、棒状杆菌属(Corynebacterium)、肠球菌属(Enterococcus)、假单胞菌属(Pseudomonas)、明串珠菌属(Leuconostoc)、解硫胺素芽孢杆菌属(Aneurinibacillus)和Bavariicoccus,平均相对含量分别为21.46%、15.83%、8.69%、8.38%、7.62%、7.14%、6.69%、4.65%、1.19%和1.1%。样本中的核心细菌属为Bacillus、Pediococcus和Staphylococcus构成。龙山豆豉样本间细菌差异性要大于当阳豆豉样本间差异,且两地区样本间细菌多样性差异极显著(P<0.01),在两类样本的优势细菌属中Bacillus、Pediococcus和Bavariicoccus是造成其细菌群落结构差异的主要细菌属。
