2种不同溶出介质测定氯雷他定片溶出度方法比较
2020-03-28罗远纯
罗远纯 张 磊
(遵义市产品质量检验检测院 贵州遵义 563000)
1 前言
氯雷他定在生物药剂学(BCS)分类中属于Ⅱ类弱碱性药物,其溶解度低、渗透性高,它在体内溶出是吸收的限速步骤。如果建立体内外相关性,可以通过测定体外溶出度来反映药物在体内生物利用度的大致情况,体外溶出度实验是评价口服固体制剂内在质量的一种重要方法。在溶出度的考察中,现行《中国药典》2015版以盐酸溶液(9→1 000)500 mL 为溶出介质[1],但由于氯雷他定是水不溶性物质,且在25℃下氯雷他定的电离常数为4.85~6.00,同时也是弱碱性药物,其溶解特性为:在强酸溶液中溶解,而在弱酸溶液或水中几乎不溶,在较低的pH环境下,如0.1 mol/L的盐酸中易溶,但形成质子化的含氮碱,透膜能力反而下降,影响体内吸收[2]。盐酸的酸性较强,能使弱碱性的氯雷他定较好地溶出,但这种以盐酸为介质的测定方法不能真实体现出与体内溶出相似的条件,同时也无法区别仿制药与原研药的溶出度差异。因此,对于药物的溶出度检查,除了《中国药典》2015版的方法之外,有必要进一步研究。在以往对氯雷他定片剂溶出度的研究中,崔飙等[3]、李蓉等[4]均采用紫外分光光度法测定氯雷他定片的含量,该方法简便快捷,精密度和稳定性良好,准确度高,应用较为广泛。刘屹等[5,6]则用不同pH的溶剂作为溶出介质,进行溶出度的考查。因此,本文试图寻找一种更为合理的溶出介质用于紫外分光光度计法测定氯雷他定片剂的体外溶出度,并进行方法学验证。再利用所建立的方法用于不同厂家氯雷他定制剂的溶出度测定,并与现行《中国药典》方法进行比较。
2 仪器、试剂及样品
2.1 仪器
赛多利斯电子天平(BSA224S);梅特勒—托利多电子分析天平(AB265—S);智能药物溶出仪(D—800 LS)(天津天大天发科技有限公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司);紫外分光光度计(岛津UV-2700)。
2.2 试剂及样品
盐酸;一水合柠檬酸;磷酸氢二钠;氯雷他定片(10 mg)。
3 方法与结果
3.1 溶出介质的配制
(1)pH 1.0 的盐酸溶液:根据《中国药典》(ChP)2015版,以盐酸(9→1 000)配制成pH 1.0的浓度为0.1 mol/L的盐酸溶液,经0.45 nm滤膜过滤备用。
(2)pH 3.0磷酸盐缓冲溶液:精密称取0.485 9 g磷酸氢二钠、3.861 1 g一水合柠檬酸,加水稀释至5 000 mL,充分搅拌使之混合均匀,用磷酸或氢氧化钠试液调节至溶液pH为3.0±0.05,经0.45 nm滤膜过滤备用。
3.2 专属性实验
精密称取氯雷他定对照品10.12 mg于10 mL容量瓶中,用盐酸(9→1 000)溶液溶解并稀释至刻度,摇匀,得氯雷他定储备液。精密量取储备液1 mL到50 mL量瓶中,用盐酸(9→1 000)溶液稀释至刻度,摇匀,得氯雷他定对照品溶液1。另精密称取处方比例的辅料,用同一稀释剂制成空白辅料溶液,经0.45 nm滤膜过滤,取续滤液,待测。以0.1 mol/L的盐酸溶液为空白对照,照《中国药典》(ChP)2015版四部通则0401紫外分光光度法,在200~400 nm波长范围内扫描,记录紫外吸收光谱曲线(图1)。根据扫描的结果可知,氯雷他定在273.4 nm处有最大吸收,辅料在276 nm附近基本无吸收,说明不干扰本品的溶出度测定。另精密称取氯雷他定对照品10.33 mg,以pH 3.0磷酸盐缓冲液为溶剂,同法扫描,结果表明氯雷他定在277.6 nm波长处有最大吸收(图2),因此,测定波长仍设定为(276±3)nm。
3.3 线性关系考察(标准曲线的制备)
精密量取储备液1 mL到50 mL容量瓶中,用pH 3.0磷酸盐缓冲溶液稀释至刻度,摇匀,得氯雷他定对照品溶液2。分别精密量取对照品溶液1、2各1.0mL、2.0mL、3.0mL、4.0mL、5.0mL 分置 10 个 10mL EP管中,并分别用0.1 mol/L盐酸溶液和pH 3.0磷酸盐缓冲溶液稀释至5 mL,摇匀,即得2个系列标准溶液。按照《中国药典》(ChP)2015版四部通则0401紫外-可见分光光度法于276 nm波长测定各溶液吸光度。以对照溶液的浓度(X)为横坐标,吸光度(Y)为纵坐标作标准回归曲线,分别得以pH 1.0盐酸为溶剂的标准曲线(图3),回归方程为y=0.0233x+0.028,R2=0.999 8(n=5);以pH 3.0磷酸盐缓冲液为溶剂的标准曲线(图 4),回归方程为 y=0.021 5x-0.011,R2=0.999 1(n=5)。结果表明,氯雷他定在质量浓度为4.05~20.24(4.13~20.66) μg/mL 时,与吸光度线性关系良好。
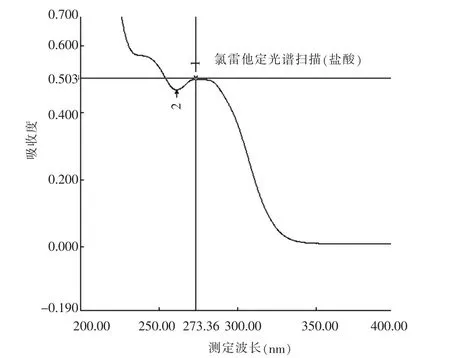
图1 光谱扫描图(介质盐酸)
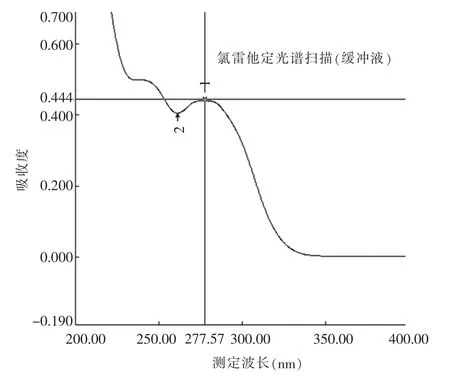
图2 光谱扫描图(介质缓冲液)
3.4 溶出度测定
选取3个不同厂家生产的氯雷他定片,照《中国药典》(ChP)2015版四部通则 0931:溶出度与释放度测定法第二法,即转速为50 r/min,分别用2种溶出介质测定溶出度(盐酸为吸光度1和溶出度1,缓冲液为吸光度 2和溶出度 2)。 分别于 5、15、30、45、60 min时取溶液5 mL经0.45 nm滤膜过滤,用续滤液作为供试品溶液,同时向溶出杯中补充5 mL介质。依法在上述测定的最大吸收波长处测定吸光度,带入回归方程计算其不同时间点下的浓度及溶出度(表 1)。
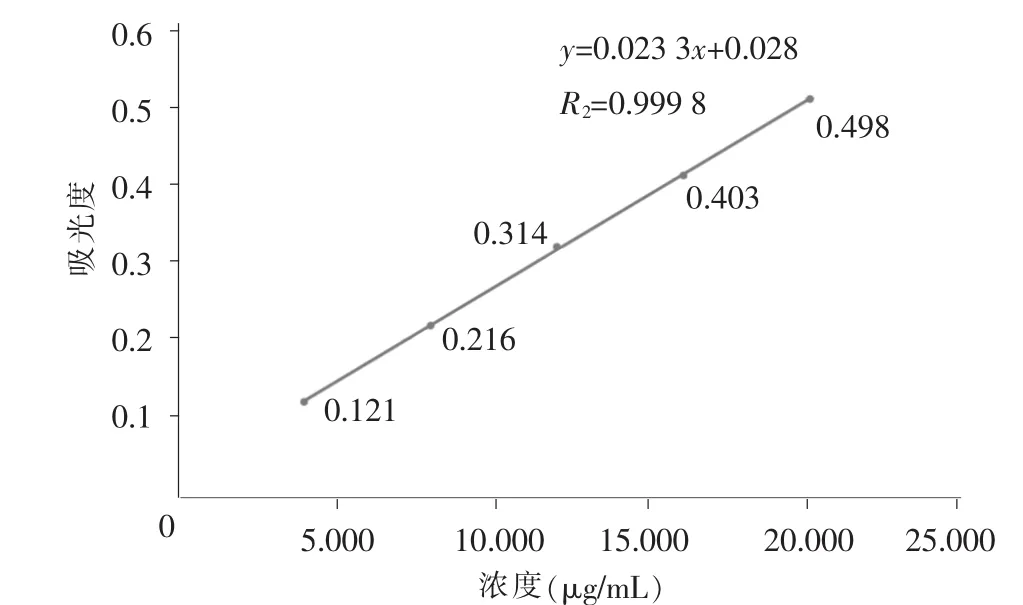
图3 标准曲线1
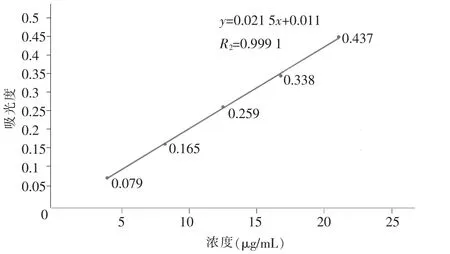
图4 标准曲线2
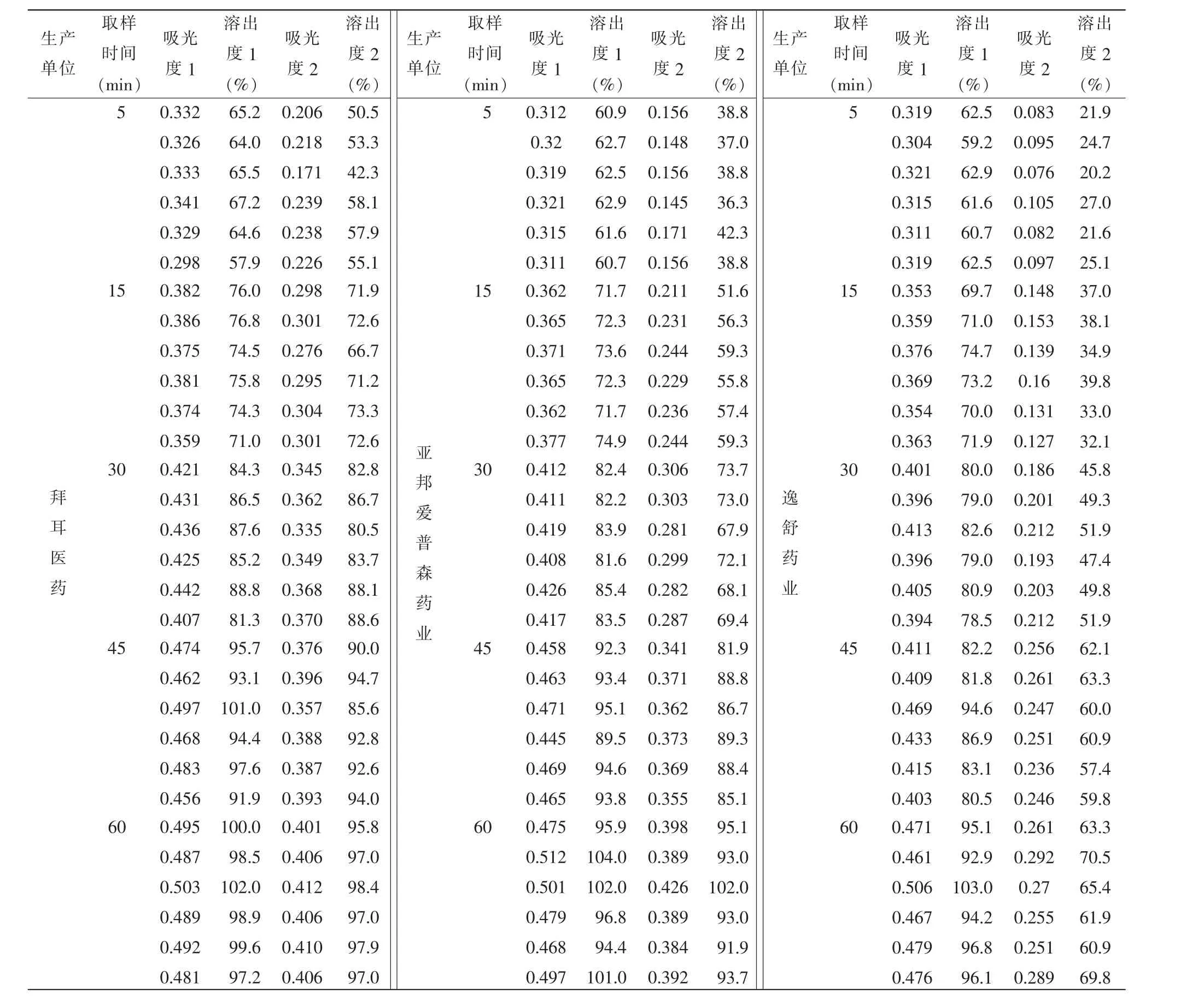
表1 不同时间浓度与溶出度
4 讨论
本文根据建立的紫外-可见分光光度法测定氯雷他定片体外溶出度的方法,进行方法学考察验证,实验结果充分证明了本法用于测定氯雷他定片体外溶出度的可行性和准确性。且用于不同厂家氯雷他定片溶出度测定结果表明,以盐酸(9→1 000)溶液为溶出介质时,各厂家氯雷他定片剂的溶出过程略有差异,但溶出曲线基本相同,3个厂家的制剂均符合要求,但这种介质的区分力不大,无法更加突出地表明各厂家制剂的溶出差异;以pH 3.0磷酸盐缓冲液为溶出介质时,各溶出曲线相似性较差,体外溶出行为有较大的差异,可能会导致生物利用度的差异。氯雷他定是弱碱性药物,在pH 1.0盐酸溶液中溶解度大于在pH3.0磷酸盐缓冲液中的溶解度,但是pH3.0磷酸盐缓冲液作为溶出介质其区分力优于pH 1.0盐酸溶液。为了更好地根据体外溶出实验反映体内溶出行为,建议采用能够建立起体内外相关性较强的具有区分力的溶出介质进行溶出度实验。
