积雪覆盖变化对大兴安岭多年冻土区土壤微生物群落结构的影响
2020-03-27马大龙刘梦洋陈泓硕姜雪薇臧淑英
马大龙,刘梦洋,陈泓硕,姜雪薇,臧淑英
哈尔滨师范大学地理科学学院,哈尔滨 150025
积雪对气候变化具有重要反馈作用和高度敏感性,是气候系统中最活跃的环境影响要素,目前已经成为全球气候变化研究中的热点内容和关键问题之一[1- 2]。气候变暖已经导致近几十年来一些地区降雨/降雪比率增加,Kapnick等[3]也预测在22世纪温带地区积雪覆盖将持续减少。由于积雪本身具有较低的导热率和较高的反射率,能够在土壤表面形成良好的隔热层,对大气和土壤热交换过程具有十分重要的作用[4- 6]。东北-内蒙古东部地区是中国三大主要积雪区之一,在每年11月至翌年4月都有稳定的积雪覆盖,由于高纬度地区对全球变化的敏感性和特殊性,有关积雪对土壤生态过程和区域环境影响方面的研究正逐渐被人们所关注。
微生物是生态系统的重要组成部分,参与土壤物质循环和能量流动,对所生存的微环境变化十分敏感,可以作为寒区生态系统变化的预警和敏感生物指标[7]。高纬度地区冬季雪被的保温绝热作用能够为土壤微生物的生存和繁殖提供相对稳定的水热条件。已有大量研究表明,在低温季节土壤微生物群落动态、温室气体排放通量以及土壤碳氮矿化速率并不低于夏季[8- 10]。气候变化可能改变雪被的形成、覆盖、消融以及土壤冻融循环过程,进而显著影响寒区森林生态系统土壤微生物群落结构和多样性[11]。近年来有关雪下土壤生态过程的研究,主要集中在高山苔原带和环北极地区,而对于高纬度多年冻土区不同积雪覆盖条件下土壤微生物动态变化特征的研究还十分匮乏。
大兴安岭地区是我国唯一的寒温带林区,也是高纬度多年冻土的主要发育地区,负温期长达5个月之久,平均积雪日数可达161 d[12]。积雪对下伏多年冻土有着十分重要作用,未来气候变暖引起的积雪覆盖变化,必将增加土壤冻结强度和冻融频率,改变土壤表面水热动态、理化性质、温室气体排放以及微生物多样性和群落结构,从而对土壤生物地球化学循环过程产生重要影响[13]。因此,为了更加清晰认识气候变化对多年冻土区森林生态系统的影响,需要进一步理清雪被覆盖减少情境下土壤微生物群落的演变特征和关键驱动机制。本研究选取大兴安岭多年冻土区白桦次生林为研究对象,运用磷脂脂肪酸(PLFA)的方法,探讨不同雪被覆盖条件下土壤微生物群落结构的动态变化规律,以期全面深入了解多年冻土区土壤微生物生态过程,为准确评估和预测高纬度寒区森林生态系统对全球变化的响应及其相互作用机制提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古大兴安岭高纬度多年冻土区的乌尔旗汉林业局西日特气林场(49°32′41.32″ N—121°31′42.44″ E)。该区属寒温带大陆性季风性气候,年均气温2.6 ℃,最低气温-47.6 ℃,最高气温34.5 ℃,昼夜温差较大,无霜期短,夏季短促温和,冬季漫长寒冷;年降水量350—450 mm,多集中于7—8月份,降雪量占年降水量的10%—20%,多集中在11月至次年2月,积雪期可达155 d[14]。土壤以暗棕色森林土为主,森林覆盖率可达79.15%,植物群落的主要建群树种为兴安落叶松(Larixgmelinii),乔木层还包括白桦(Betulaplatyphylla)、山杨(Populusdavidiana)、黑桦(Betuladahurica)、蒙古栎(Quercusmongolica)、樟子松(Pinussylvestris)等;灌木层主要有笃斯越桔(Vacciniumuliginosum)、山莓(Rubuscorchorifolius)、兴安杜鹃(Rhododendrondauricum)、山刺玫(Rosadavurica)、绣球绣线菊(Spiraeablumei)等;草本层主要有红花鹿蹄草(Pyrolaincarnata)、地榆(Sanguisorbaofficinalis)、大叶野豌豆(Viciapseudorobus)等[15]。由于遭受火烧或采伐等人为干扰,大量兴安落叶松林遭到破坏,衍生出大面积的白桦次生林,对该区域的水源涵养、水土保持、调节气候及维护生态平衡等方面具有举足轻重的地位。
根据大量的背景资料和野外调查基础上,在具有代表性和立地类型一致的白桦次生林中设置2块50 m×50 m相距100 m的试验样地,分别为自然积雪和遮雪,积雪厚度用雪尺测量。在降雪前(10月初)采用对角线法设置5个用木质骨架搭建,面积为5 m×5 m,高为1.5 m的通风遮雪棚(表面用聚乙烯塑料薄膜覆盖透光率约90%),降雪期后移除。在2块样地的表层土壤5 cm处分别埋设1台土壤温度自动监测站(Watchdog 2400,USA),每1 h记录1次温度数据。2015年降雪期从10月11日至次年3月27日,整个过程历时约140 d,土壤活动层从10月初开始冻结到次年9月末全部融通,活动层最大融深为110 cm。
1.2 土壤理化性质测定
土壤样品采集于积雪形成期(2015.11.1,地表形成有效积雪)、积雪稳定期(2016.1.13,积雪深度达到最大为33.15 cm)、积雪融化期(2016.2.25,气温达到0 ℃以上积雪开始融化)、植被生长季初期(2016.4.5,土壤表层温度达到0 ℃以上植被开始生长)、植被生长季中期(2016.6.30,植被生长旺盛)、植被生长季末期(2016.9.25,气温达到0 ℃以下植被停止生长),为减小边缘效应在每个遮雪棚中央采用土钻法采集0—10 cm土壤样品1个,用灭菌自封袋密封置于冰盒中带回实验室,在去除植物根系、碎石等杂质过2 mm筛后平均分为两份,一份自然风干用于土壤理化性质测定,另一份置于4 ℃冰箱储存,一周内用于土壤微生物磷脂脂肪酸测定。
土壤含水量采用烘干法,pH值采用电位法,土壤总有机碳采用TOC分析仪(Multi N/C 3100,Germany)测定,全氮、铵态氮和硝态氮釆用连续流动分析仪(Skalar San++,Netherlands)测定。
1.3 土壤微生物群落结构测定
土壤微生物采用修正的磷脂脂肪酸(phospholipid fatty acid,PLFA)法测定[16]。微生物细胞脂肪酸成分鉴定采用美国MIDI公司开发的Sherlock MIS 4.5系统。磷脂脂肪酸含量(nmol/g干重)可代表不同类型土壤微生物的生物量,磷脂脂肪酸的类别数量可代表土壤微生物群落多样性。革兰氏阳性菌(G+)用i14:0、a15:0、i15:0、i16:0、a17:0和i17:0来表征;革兰氏阴性菌(G-)用16:1ω5c、16:1ω11c、cy17:0、17:1ω8c、18:1ω5c、18:1ω7c、18:1ω9c和19:1ω6c来表征;14:0、15:0、16:0、18:0代表一般性细菌;真菌用18:2ω6,9c来表征;AM真菌用16:1ω5c来表征;放线菌用10Me 16:0、10Me 17:0和10Me 18:0来表征;原生动物用20:4ω6c来表征[17- 21]。
1.4 数据分析
不同土壤理化性质;微生物磷脂脂肪酸总量;真菌、细菌磷脂脂肪酸含量运用软件SPSS 20.0进行单因素(one-way ANOVA)方差分析(LSD多重比较法,显著性水平设为0.05)。微生物群落多样性采用Shannon Wiener指数、Simpson指数和McIntosh指数表征,运用BIO-DAP程序进行计算。土壤微生物PLFA主成分分析(Principal component analysis,PCA)和冗余分析(Redundancy analysis,RDA)在多元统计分析软件Canoco 5.0中进行。
2 结果与分析
2.1 不同处理土壤温度和含水量变化特征
2015年冬季首次降雪始于10月11日(图1),但很快融化没有形成有效积雪,10月20日降雪后样地内部出现稳定积雪,2016年4月初积雪全部融化。2015年10月至2016年4月期间共观测到17场降雪,样地最大积雪深度为33.15 cm。自11月至次年2月气温迅速下降,雪被覆盖对冬季土壤具有明显的保温隔热作用,随着积雪厚度的增加,土壤5 cm处地温差异明显,遮雪比自然积雪的平均地温低1.33 ℃;2月至4月气温波动上升积雪融化,自然积雪比遮雪处理的平均地温低0.36 ℃;5月以后两个处理的地温差异不显著(图1)。从图1土壤含水率变幅可以看出,在积雪融化期和植被生长季初期,自然积雪的土壤含水率显著高于遮雪(P<0.05),而在积雪形成期、积雪稳定期、植被生长季中期和末期的土壤含水量无显著性差异。
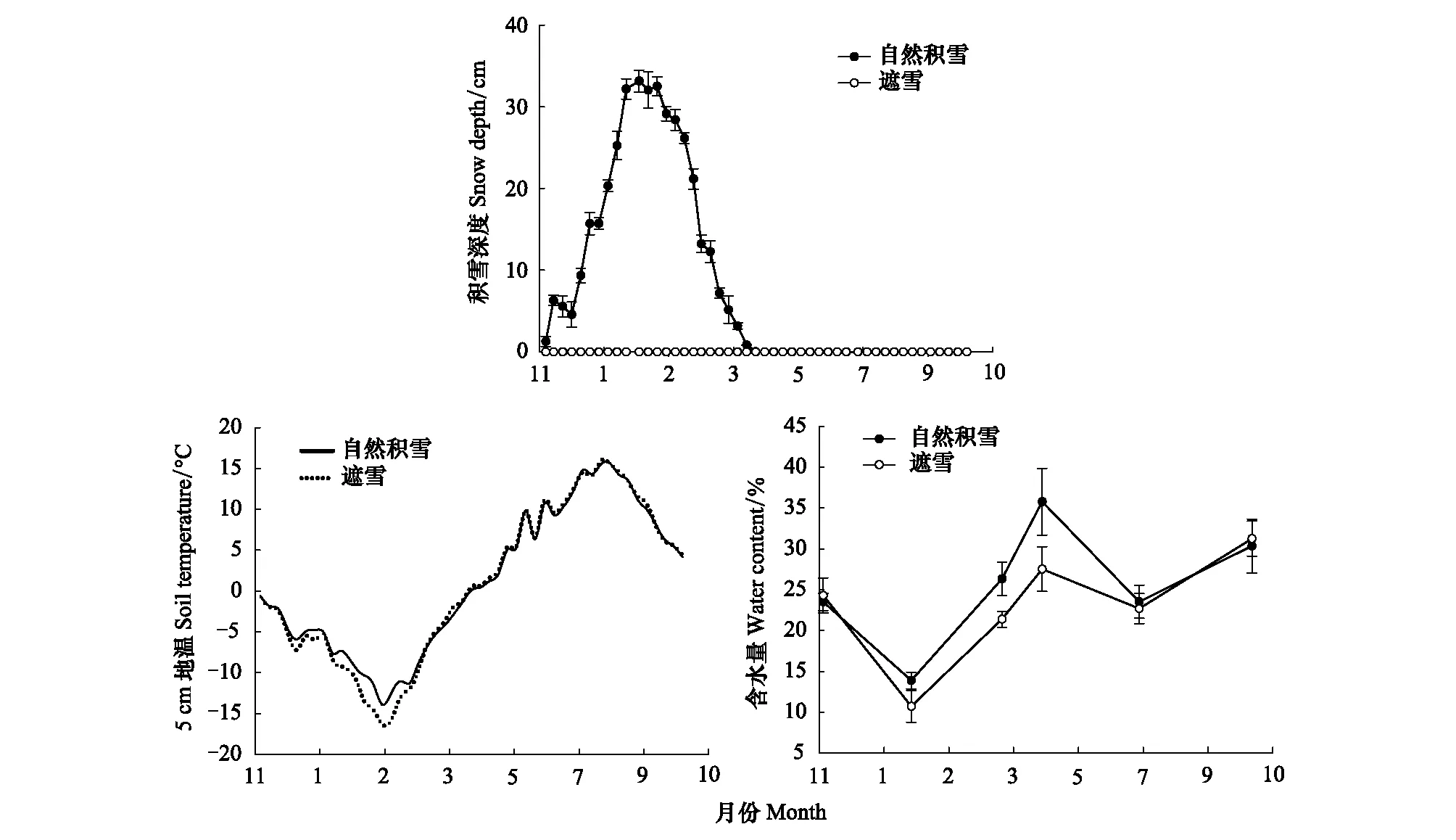
图1 不同雪被覆盖条件下积雪深度、土壤温度和含水量Fig.1 Snow depth, soil temperature and water content under different snow cover conditions
2.2 不同处理土壤理化性质变化特征
不同雪被覆盖条件下土壤理化性质随时间的变化趋势相似,但在积雪融化期存在一定差异(图2)。遮雪对土壤pH值和总氮(TN)无显著影响(P>0.05),总体趋势为先增加后降低,在植被生长季初期最高,积雪形成期最低。土壤总磷(TP)含量在植被生长季中期最高,在积雪融化期遮雪(0.82 mg/kg)高于自然积雪(0.74 mg/kg)但差异不显著(P>0.05)。土壤总有机碳(TOC)含量在积雪形成期最高、植被生长季初期最低,积雪稳定期和积雪融化期,遮雪(30.95、27.38 g/kg)显著高于自然积雪(28.54、25.46 g/kg,P<0.05)。土壤铵态氮(NH4-N)含量在积雪融化期遮雪显著高于自然积雪(P<0.05);硝态氮(NO3-N)含量在积雪稳定期最高,植被生长季初期最低,在积雪融化期遮雪显著高于自然积雪(P<0.05),其他时期间无显著性差异(P>0.05)。
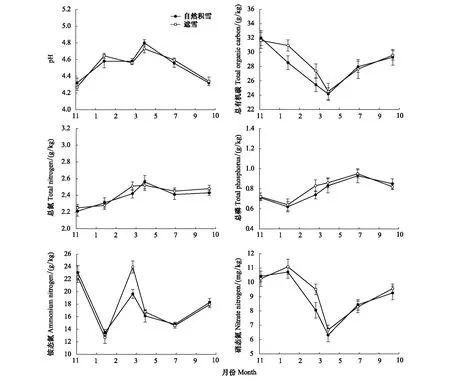
图2 不同雪被覆盖条件下土壤理化性质特征Fig.2 Soil physical and chemical properties under different snow cover conditions
2.3 不同处理土壤微生物群落结构特征
在自然积雪和遮雪处理的土壤中共检测出21种和20种PLFA,选取含量大于0.1 nmol/g的13种PLFA进行分析,其中革兰氏阳性菌(G+)3种、革兰氏阳性菌(G-)4种、一般性细菌2种、真菌1种、内生真菌(AM)1种、放线菌1种和原生动物1种。由图3可知,18:2ω6,9c的含量最高,占总磷脂脂肪酸的15.17%—42.44%;a15:0、i16:0、17:1ω8c、18:1ω9c和16:1ω5c的总和占脂肪酸总量的37.16%—57.57%,说明这6种PLFA是土壤微生物的主要类群,但不同时期各优势PLFA含量存在一定差异。其中,自然积雪处理的土壤a15:0含量在植被生长季末期最高,积雪稳定期最低,而在遮雪处理中则为植被生长季中期最高,积雪稳定期最低;17:1ω8c含量在自然积雪处理中为积雪融化期最高,积雪形成期最低,而在遮雪处理中则为植被生长季中期最高,积雪稳定期最低。遮雪处理仅在积雪稳定期显著降低18:1ω9c含量、增加18:2ω6,9c含量(P<0.05),对其他时期微生物群落结构影响不显著。
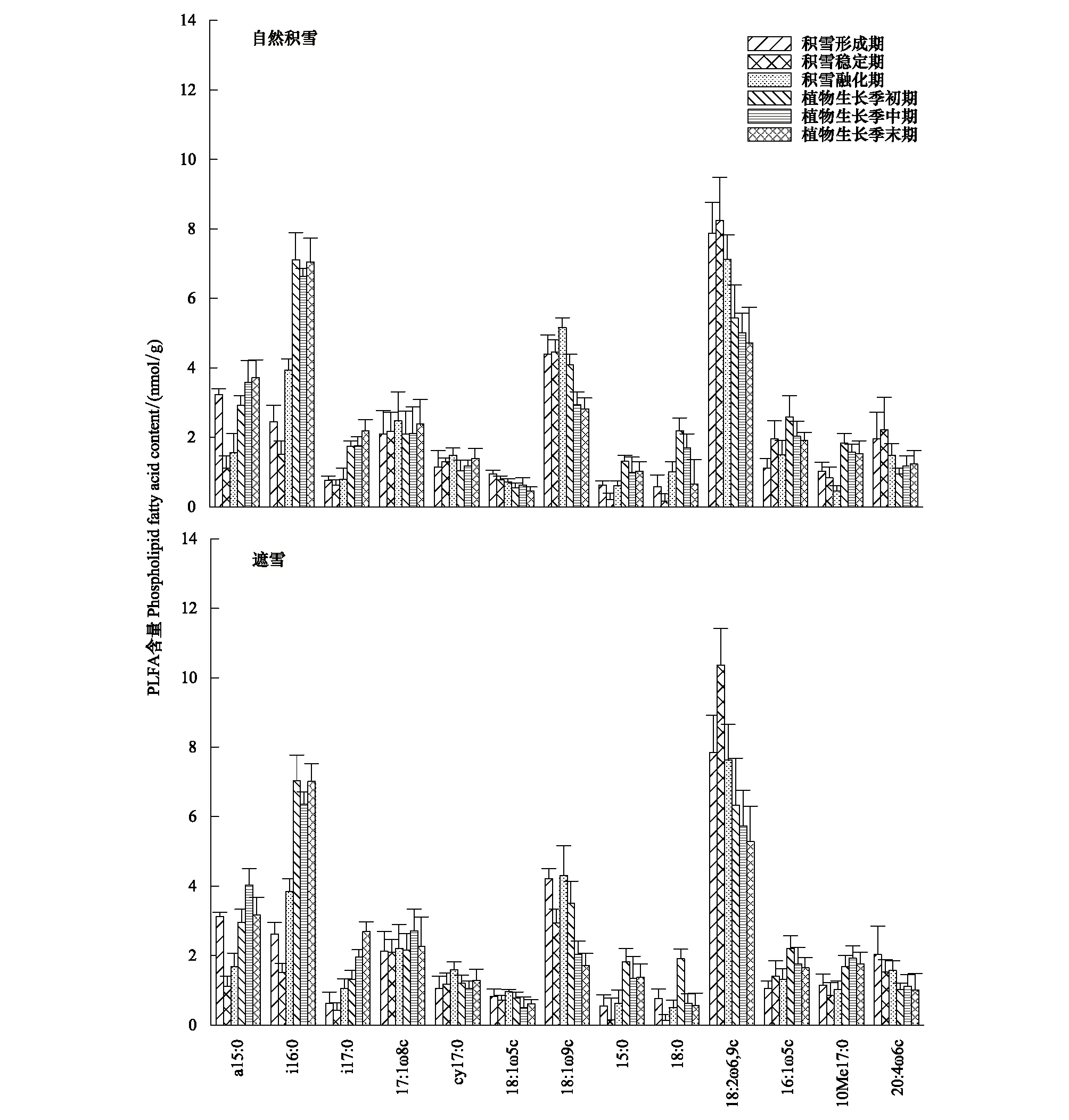
图3 不同积雪覆盖条件下土壤微生物磷脂脂肪酸类型及含量Fig.3 The type and content of soil microbial phospholipid fatty acid under different snow cover conditions
遮雪对不同时期土壤微生物PLFA的影响各有不同(表1)。总磷脂脂肪酸(PLFA)含量变化范围24.41—33.95 nmol/g,在植被生长季初期最高,积雪稳定期最低,且生长期显著高于积雪期(P<0.05)。土壤微生物以细菌为优势类群,占微生物总PLFA含量的42.03%—69.79%,生长期显著高于积雪期,遮雪显著降低积雪稳定期细菌PLFA含量(P<0.05)。真菌在积雪稳定期最高,分别为10.19 nmol/g和11.77 nmol/g;在植被生长季末期最低,分别为6.62 nmol/g和6.93 nmol/g,遮雪显著增加积雪稳定期真菌PLFA含量(P<0.05)。遮雪处理下的土壤革兰氏阳性菌和革兰氏阴性菌PLFA含量比值(G+∶G-)略高于自然积雪,但均未达到显著水平(P>0.05),在积雪期革兰氏阴性菌含量较高,而在植被生长期则为革兰氏阳性菌占优势。细菌/真菌(F∶B)比值在积雪期高于生长期,遮雪显著增加积雪稳定期的真菌/细菌比值(P<0.05)。
2.4 不同处理微生物多样性特征
土壤微生物群落多样性分析结果表明,遮雪对各时期土壤微生物群落多样性指数均未产生显著影响(表 2)。Shannon Wiener多样性指数和McIntosh均匀度指数的最高值均出现在植被生长季初期,分别为2.792、2.727和17.259、17.982;而最低值出现在积雪稳定期,分别为2.136、2.047和9.411、9.127(P<0.05)。Simpson优势度指数则与之相反最高值出现在积雪稳定期,分别为0.103和0.098;而最低值出现在植被生长季初期,分别为0.071和0.075。
2.5 土壤微生物PLFA主成分分析
为进一步分析遮雪和季节对土壤微生物群落结构的影响,提取不同时期遮雪和自然积雪处理土壤中的13种特征PLFA进行主成分分析(图4)。结果表明,前2个主成分(PC1和PC2)共同解释微生物总变异的83.4%,基本可以全面反映研究区域土壤微生物群落结构的分异特征。不同时期土壤微生物群落结构均存在显著差异,积雪形成期、积雪稳定期与积雪融化期、植被生长季(初期、中期和末期)的土壤微生物群落结构沿第2主成分序轴能够明显分开,而自然积雪和遮雪处理的土壤微生物群落结构较为相似。PLFA初始载荷因子分析表明,对第1主成分起主要作用的PLFA为i16:0和18:2ω6,9c,而a15:0、18:1ω9c和16:1ω5c对第2主成分的贡献较大。
2.6 微生物群落组成与土壤理化性质间的关系
冗余分析(RDA)结果显示,第1轴和第2轴分别解释微生物群落结构变异的43.2%和35.9%,两者累计解释变异量达79.1%,模拟效果较好(图5)。土壤总磷脂脂肪酸含量(Total PLFA)、真菌(F)、真菌/细菌(F∶B)和革兰氏阴性菌(G-)与土壤含水量(SWC)、pH和铵态氮(NH4-N)均呈显著正相关。细菌(B)和革兰氏阳性菌(G+)与土壤总磷(TP)、总氮(TN)和硝态氮(NO3-N)呈显著正相关。放线菌(A)、原生动物(P)和革兰氏阳性菌/革兰氏阴性菌(G+∶G-)受环境因子的影响较小。

表1 不同积雪覆盖条件下土壤微生物各菌群磷脂脂肪酸含量及比率
表中数值为平均值±标准差;不同大写字母代表自然积雪处理组间差异显著 (P<0.05);不同小写字母代表遮雪处理组间差异显著 (P<0.05)
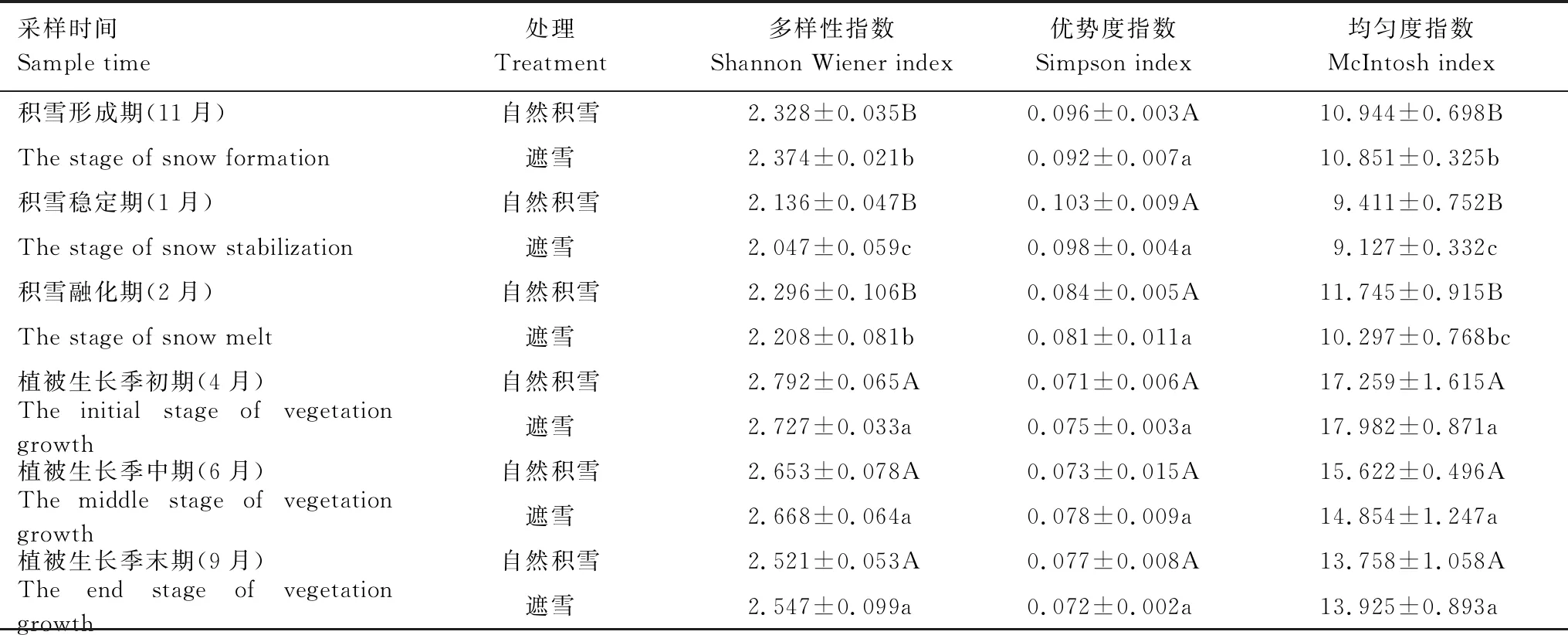
表2 不同积雪覆盖条件下土壤微生物多样性特征
表中数值为平均值±标准差;不同大写字母代表自然积雪处理组间差异显著 (P<0.05);不同小写字母代表遮雪处理组间差异显著 (P<0.05)
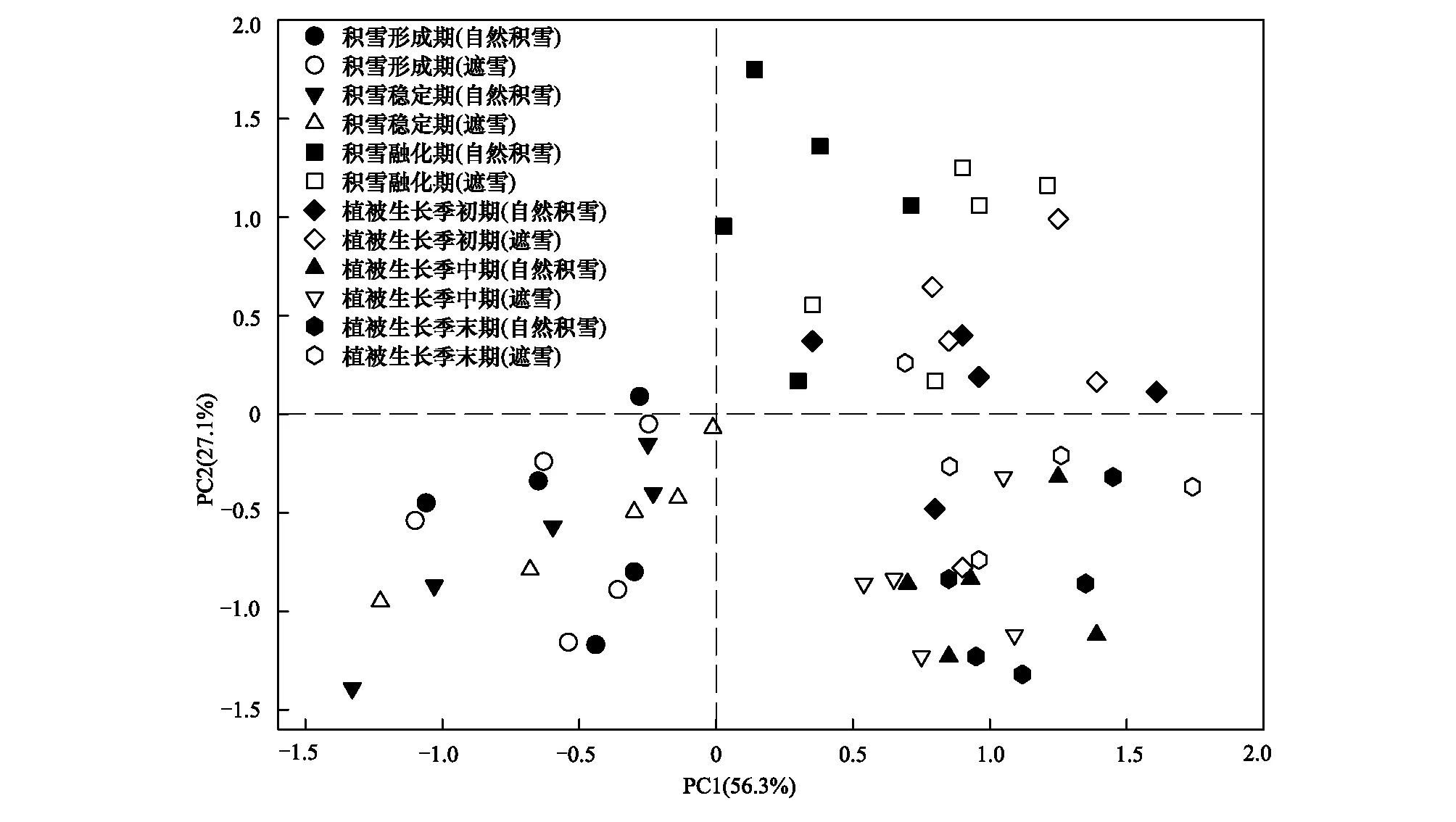
图4 土壤微生物群落PLFA主成分分析Fig.4 Principal component analysis (PCA) of soil micr obial community PLFA
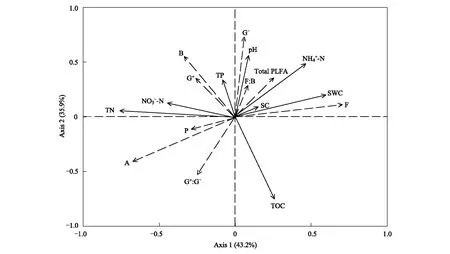
图5 土壤微生物群落结构与土壤环境因子的冗余分析Fig.5 Redundancy analysis of relationships among soil microbial community structure and soil environmental factorsSC:积雪;SWC:土壤含水量;Total PLFAs:总磷脂脂肪酸含量;B:细菌;F:真菌;A:放线菌;P:原生动物;G+:革兰氏阳性菌;G-:革兰氏阴性菌;F∶B:真菌/细菌;G+∶G-:革兰氏阳性菌/革兰氏阴性菌
3 讨论
由于积雪对热量的传导效率小于空气,致使太阳辐射在积雪覆盖下不能直接到达土壤表面,积雪在抑制土壤自身热量散失的同时也阻碍土壤对于太阳辐射能量的吸收;而遮雪处理的土壤失去具有保温隔热效应的雪被,土壤温度受气温影响较大,在11月至次年2月土壤5 cm地温低于自然积雪处理。积雪覆盖时间、积雪密度和深度均会强烈地影响冬季土壤的冻结速率、冻融频率和春季融期土壤升温速率。Williams等[22]在高山和北极地区的研究结果也表明,缺少雪被覆盖,土壤温度会更低,冻融交替加剧,土壤冻结范围进一步增大。除土壤温度外,遮雪还对土壤含水量有一定的影响,在积雪融化期和植被生长季初期,自然积雪的土壤含水量显著高于遮雪,这主要受春季积雪融水和地表径流下渗的影响。许多研究都证实土壤含水量是影响土壤微生物群落的重要因素,但是在不同研究区域影响效果不尽相同[23- 24]。本研究发现,遮雪和自然积雪处理的土壤在积雪融化期和植被生长季初期土壤微生物多样性和群落结构无显著差异,其原因可能是由于积雪融化引起的瞬时土壤含水量升高对土壤微生物的影响有限。
目前,关于季节性雪被覆盖对森林生态系统土壤微生物的影响尚无明确结论,已有研究表明冬季积雪覆盖的变化会显著改变土壤微生物代谢水平,不同的覆盖时间和积雪深度很可能通过改变微生物群落结构而对土壤营养元素循环和生态功能产生重要影响[25]。Broder等[26]对挪威云杉林的研究结果显示,季节性雪被发育和融化动态深刻影响着土壤微生物的群落结构、多样性和代谢活性,进而对高山生态系统的物质能量循环和植被分布产生重要影响。Rinnan等[27]认为积雪周期变化并没有引起土壤微生物量的显著差异,说明冬季不同积雪周期下微生物的固定和矿化处于相对平衡状态。本研究发现,土壤中含量较高的PLFA为18:2ω6,9c、a15:0、i16:0、17:1ω8c、18:1ω9c和16:1ω5c,这6种PLFA是大兴安岭多年冻土区白桦次生林土壤微生物的主要类群,但不同时期各优势PLFA含量存在一定差异。总PLFA含量在植被生长季初期最高,积雪稳定期最低,这是由于春季植被开始萌发,树木根系分泌物增多、代谢加快,适宜的土壤温度和湿度为微生物的生存和繁殖提供了较好的环境;而冬季较低的土壤温、湿度和较高的冻融频率导致耐受性较差的微生物迅速死亡,嗜冷微生物的生长代谢也受到抑制,这与前人研究结果相吻合[28- 30]。遮雪处理下的土壤细菌PLFA含量略低于自然积雪,仅在积雪稳定期有显著降低而真菌PLFA含量变化则与之相反(P<0.05),这也说明真菌对寒冷干燥的环境适应性更加灵活。细菌和真菌在土壤环境中占据各自不同的生态位,个体形态、生长和繁殖策略的不同可能导致细菌和真菌对积雪覆盖变化的响应存在差异。在寒冷的冬季,真菌较细菌对环境变化的耐受能力更高,水分相对缺乏的土壤环境限制了细菌生长,土壤冻融交替对细菌细胞的破坏程度加大,导致细菌数量下降,而真菌菌丝体能够利用土壤颗粒周围吸附的未冻水,甚至能够穿越冻土间液态水薄膜以获取生存所需的水分[31]。越来越多的证据显示,在雪被覆盖下的高纬度寒区生态系统中嗜冷微生物的生理适应性使其能在寒冷条件下生存和繁殖[32]。Lipson等[33]对高寒草甸的研究证实,在冬季融雪期间土壤微生物群落组成由细菌转变为真菌。一般认为真菌/细菌比值常被用来衡量两种微生物类群的相对丰富度和土壤生态系统稳定性,遮雪显著增加积雪稳定期的真菌/细菌比值(P<0.05)。Schadt等[34]对科罗拉多地区雪下微生物群落组成的研究发现,冻土带土壤微生物量在雪下达到年度峰值且真菌占主要部分。Glanville等[35]对北极苔原生态系统的研究表明,在融雪72 h后,地上植被和地下微生物群落均会对环境变化做出迅速的响应。全球变化可能导致一些地区降雪减少而降水增加,雪被较少或者消失会影响土壤温度变化速率、通气性、水分以及营养物质的迁移和转化。尹鹏等[36]则认为气候变暖引起的冬季积雪覆盖时间的缩短并不会通过影响土壤微生物活性而对土壤营养水平和物质循环产生实质性的影响。本研究中,遮雪处理仅在积雪稳定期增加真菌PLFA含量、降低细菌PLFA含量,对其他时期微生物群落结构和多样性的影响并不显著,Vankoughnett等[37]的研究也证实,土壤微生物量并没有对积雪覆盖变化表现出明显的响应。这可能说明短期积雪覆盖变化对表层土壤微生物的影响是短暂而非可持续性,而对深层土壤微生物群落结构的影响还有待进一步研究。
相关分析发现,大兴安岭多年冻土区土壤微生物群落结构和土壤理化性质间具有明显的相关性(图5)。土壤总磷脂脂肪酸含量、真菌和革兰氏阴性菌与土壤含水量、pH和铵态氮均呈显著正相关。韩世忠等[38]的研究结果表明,在米槠(Castanopsiscarlesii)天然林真菌对有机底物的利用率更高,在养分有效性较低、偏酸性的土壤中,真菌代谢更加旺盛。Lauber等[39]也证实在偏酸性的土壤环境中真菌能够提高对水分的利用效率,从而促进自身生长和繁殖。土壤pH在4.27—4.81之间,季节性变幅不大,虽然有研究认为土壤微生物可在一个较宽pH范围内生长,但不同类群的微生物对土壤pH的耐受范围不同,过高或过低的pH值都不利于土壤微生物的生长和繁殖[40]。季节变化会对植被生长和土壤微生物群落产生直接影响,而土壤水热条件的变化又会影响有机质的分解和周转,进而改变土壤中碳、氮元素含量。土壤有机碳表现为在积雪形成期最高,植被生长季初期最低,这主要是由于在植被生长季节末期大量新鲜凋落物归还到土壤表面,使有机碳在土壤冻结初期保持着较高含量,冬季较低的土壤温、湿度对碳、氮等元素转化具有一定限制作用,而微生物仍能够持续不断地分解和利用有机物质,进而降低了土壤有机碳含量。春季气温回暖,适宜的土壤条件为植物和微生物的生长和代谢提供了良好的环境,增加对营养物质的需求量,致使土壤有机碳含量维持在较低水平。Merilä等[41]在对中高纬度森林土壤微生物群落结构月际变化进行研究时也发现每年生长季开始时,土壤存在养分的再次积累现象。不同季节所引起植被凋落物及其分解速率的变化,造成回归土壤中养分的质量和数量产生差异,从而影响了微生物群落的组成和多样性。本研究中细菌和革兰氏阳性菌与土壤总磷、总氮和硝态氮呈显著正相关,遮雪仅在积雪融化期显著增加了土壤总有机碳、铵态氮和硝态氮含量(P<0.05),而不同积雪覆盖条件并没有引起其他时期土壤理化性质的显著差异,其原因是相对于微生物,土壤理化性质对遮雪的响应可能存在一定滞后性[42]。积雪融化促进了土壤养分释放和有机物质分解,为细菌创造了有利的生存环境,同时地温回升也可能提高细菌的生理活性。当土壤可利用基质下降到一定程度时又可能成为土壤微生物繁殖和生存的限制性因子,土壤微生物群落组成和代谢活性很大程度上是由土壤的肥力和质量、土壤有机物的代谢过程以及生物地球化学循环等因素所决定[43]。
4 结论
大兴安岭多年冻土区土壤中18:2ω6,9c(真菌)、a15:0(革兰氏阳性菌)、i16:0(革兰氏阳性菌)、17:1ω8c(革兰氏阴性菌)、18:1ω9c(革兰氏阴性菌)、和16:1ω5c(内生真菌)含量较高,且在不同时期各优势PLFA含量存在差异。微生物总磷脂脂肪酸表现为植被生长初期最高,积雪稳定期最低,遮雪对土壤微生物群落结构具有一定影响,其中在积雪稳定期显著降低细菌PLFA含量、增加真菌PLFA含量,真菌相比细菌对干冷环境变化有更高的耐受能力。RDA分析表明,土壤含水量、pH和氮素是影响土壤微生物群落组成的关键环境因子。微生物本身对积雪减少的响应存在较大差异,短期实验可能掩盖了土壤微生物对小面积积雪去除的滞后效应和敏感性,要揭示大兴安岭多年冻土区微生物群落组成和空间分布格局对积雪覆盖变化的响应机理,还需要开展更广泛、更深入的连续性野外定位观测和多因子综合控制试验。
