转化生长因子β1信号通路对胚胎肝前体细胞分化的诱导作用
2020-03-26玉苏甫卡迪尔麦麦提尼加提艾麦提牙森李文定吐尔干艾力阿吉邵英梅
玉苏甫卡迪尔·麦麦提尼加提, 艾麦提·牙森, 李文定, 冉 博,吐尔干艾力·阿吉, 邵英梅, 温 浩
1 新疆医科大学 “省部共建中亚高发病成因与防治”国家重点实验室, 乌鲁木齐 830011;2 新疆医科大学第一附属医院 消化血管外科中心肝胆包虫外科, 乌鲁木齐 830054
胚胎肝前体细胞(hepatic progenitor cell,HPC)是胚胎早期从肝脏或性腺中分离出的具有增殖、自我更新和高度多向分化潜能的“万能”细胞,它除了具备良好的增殖能力和可塑性以外,还能够向肝细胞和胆管细胞分化[1-3]。在胚胎发育过程中,位于肝实质的HPC能够分化成为肝细胞,而位于肝内血管周围的HPC最终分化为胆管细胞。“巧合”的是从门静脉周围区域到肝实质区域TGFβ1的表达呈现出明显梯度下降的变化,即门静脉周围区域TGFβ1表达显著升高,而肝实质区域TGFβ1的表达明显降低[4],可知,TGFβ1信号通路在调控HPC的分化发育中起关键作用[5-6]。研究[7]显示,TGFβ1可能通过Notch/Jaggedl信号通路激活肝星状细胞,后者通过分泌细胞因子和生长因子来促进肝前体细胞的增殖分化。还有研究[8-9]表明,门静脉周围间质细胞中的Notch/Jaggedl信号通路通过与其相邻的肝祖细胞的Notch2受体结合后,激活肝祖细胞内的Notch通路,最终导致肝祖细胞向胆管细胞分化起重要作用。目前为止,HPC分化发育的具体机制尚未清楚,而且HPC分化趋势是否与TGFβ1信号通路的调节作用相关还没被证实。因此,本实验中加入外源性的TGFβ1及TGFβ1受体抑制剂SB431542来研究TGFβ1信号对HPC分化的影响,试图证实TGFβ1信号通路在HPC分化趋势中的诱导作用及其可能机制,为HPC在临床实践中的应用提供可靠的理论依据。
1 材料与方法
1.1 细胞系 小鼠胚胎肝前体细胞株(HPC-E14.5)购自北京北纳公司BNCC细胞库。
1.2 主要试剂 胎牛血清和DMEM培养基购自于Gibco生物技术公司,TGFβ1抑制剂SB431542购自于Tcr公司。小鼠的基因重组TGFβ1蛋白、单克隆AFP、Alb、细胞角蛋白19(cytokeratin19,CK19)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购自于美国santacruz公司。山羊抗小鼠和抗兔IgG二抗由Abcam公司提供。qRT-PCR引物由鑫泽宝信公司合成。预染蛋白Marker、PMSF、蛋白裂解液以及PAS试剂盒均购自于北京中山金桥公司。
1.3 实验方法
1.3.1 细胞培养及分组 细胞分为空白对照组(HPC)、HPC+TGFβ1组和HPC+SB431542组。HPC在DMEM培养基中培养2~3 d后进行传代。首先,在无血清的培养基里将HPC饥饿培养,24 h后置换为含1%青霉素-链霉素和15% KSR的DMEM培养基。随后,分别滴加TGFβ1(8 ng/ml)或TGFβ1受体抑制剂SB431542(1 μmol/L)处理72 h。
1.3.2 细胞免疫荧光染色法鉴定HPC细胞系 将各组HPC以4×105的密度接种于96孔板培养24 h后,加4%多聚甲醛固定0.5 h,然后滴加0.1% Trition试剂进行穿透,随后,外加山羊血清,封闭1.5 h后滴加一抗(稀释比例分别是Alb 1∶200,AFP和CK19均为1∶100),放入湿盒4 ℃孵育过夜。次日,复温1 h后滴注适量二抗并25 ℃恒温进行孵育1 h。最后,DAPI染核5 min后在显微镜下观察。
1.3.3 HPC的分化情况检测
HPC中CK19为胆管细胞标志物,Alb和AFP为成熟肝细胞标志物。用qRT-PCR和蛋白质印迹法检测加入外源性TGFβ1和TGFβ1受体抑制剂SB431542处理72 h后CK19、Alb、AFP的mRNA和蛋白水平,进而判断HPC的分化情况。
1.3.3.1 qRT-PCR检测 使用新鲜Trizole溶液提取总mRNA并将其反转录为cDNA(表1),随后进行扩增,最后,使用2-△△CT法来计算各组目的基因中的mRNA的含量(实验重复3次并取其平均值)。
1.3.3.2 蛋白质印迹检测 首先,提取总蛋白并测定其浓度且将其浓度设定为40 mg/ml。然后,将样品与上样缓冲液均匀混合,加热升温到100 ℃促使细胞内蛋白变性后进行电泳分离并进行转膜,恒速摇床上匀摇2~3 h。随后,滴加一抗(稀释的浓度分别是AFP 1∶1000、Alb 1∶500、CK19 1∶1000、GAPDH 1∶1000),4 ℃恒温冰箱里孵育过夜。次日,滴注二抗并恒温孵育1 h,经ECL发光显影,通过机器计算目的蛋白条带的灰度值(实验重复3次并取其平均值)。
1.3.4 PAS法检测HPC分化后的功能 Dadaci等[10]证实肝脏细胞具有糖原合成和储存功能,因此本实验中通过PAS染色检测HPC分化后的胆管细胞或肝细胞的糖原合成功能。按照糖原染色试剂盒说明书操作步骤,将各组标本接种于6个孔板培养24 h后吸取培养基,用双蒸水冲洗3次,用4%多聚甲醛固定15 min,加入5%过碘酸席夫试剂室温染色5 min。加入适量的席夫溶液孵育15 min后,滴加苏木精2 min对细胞质和细胞外基质进行染色,洗去多余的苏木精,倒置显微镜下观察并采集图像,计算糖原染色表达阳性面积比例。

表1 qRT-PCR引物序列
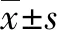
2 结果
2.1 细胞免疫荧光染色法结果 显微镜下可见肝细胞标志物AFP在细胞质中的表达量很高,Alb和CK19只是少量表达(图1),提示该HPC细胞株在体外尚未发生分化。
2.2 HPC分化情况检测结果 3组间AFP、Alb、CK19 mRNA和蛋白的表达水平比较差异均有统计学意义(P值均<0.01)(表2,图2)。提示,在外源性TGFβ1的诱导下HPC有着向胆管细胞分化的趋势,当阻断TGFβ1信号通路时,HPC能够向肝细胞分化。
2.3 HPC分化后的糖原合成及储存功能 HPC组的糖原染色表达阳性面积比例比其余2组低(P<0.05) (表2,图3),提示TGFβ1信号通路诱导HPC分化后的胆管细胞和肝细胞具有正常的糖原储存和合成功能,这些细胞可能能够参与代谢活动。

图2WesternBlot法检测HPC分化后目的蛋白的表达情况



注:a,HPC组;b,HPC+TGFβ1组;c,HPC+SB431542组。
图3HPC分化后糖原染色表
达情况(×200)

图1 HPC免疫荧光鉴定结果(×200)

表2 qRT-PCR、Western Blot和 PAS染色定量分析结果
注:与HPC组比较,1)P<0.05。
3 讨论
在胚胎肝的发育中,细胞周围微环境中的各种因子在HPC的分化过程中起关键作用,并且能够诱导其定向分化成肝细胞或胆管细胞。相关研究[11]表明,TGFβ1信号通路能够促进肿瘤细胞的繁殖、分化及转移,富含有TGFβ1的肿瘤上清液或肝星状细胞在体外可诱导肝星状细胞向胆管细胞分化[12-14]。因此,TGFβ1有望成为体外诱导HPC产生大量有功能的肝细胞或胆管细胞,并用于“细胞治疗”的一个理想手段。本实验选用小鼠HPCs-E14.5细胞株,并通过细胞免疫荧光法证实其体外尚未分化,可用于研究其增殖分化特性。TGFβ1重组蛋白和TGFβ1信号通路特异性抑制剂SB431542的作用呈现剂量及时间依赖性,并浓度分别在8 ng/ml、 1 μmol/L和作用时间48~72 h时发挥其最大的作用[15-16]。因此,笔者使用无血清饥饿培养方式来排除血清中的微量TGFβ1对实验结果的影响,并以TGFβ1及其抑制剂的最佳浓度刺激HPC,研究TGFβ1信号通路对HPC分化的影响。
结果显示,加入外源性的TGFβ1培养72 h后,HPC中作为胆管细胞标志物的CK19高表达,而成熟肝细胞标志物Alb和AFP表达量明显低于其他2组,说明TGFβ1信号可能诱导HPC向胆管细胞分化,而且分化后的细胞具有糖原合成及储存等功能。此外,通过TGFβ1受体特异性抑制剂SB431542阻断TGFβ1信号通路后,HPC中Alb表达量显著增加,而CK19和AFP的表达量明显降低。在HPC组中AFP的表达量最高,而且仅有少量细胞可合成及储存糖原,提示该组中HPC仍保持干细胞特性。
因此,以上结果表明TGFβ1信号通路的激活能够诱导HPC分化为有功能的胆管细胞,而抑制该通路可使HPC向肝细胞方向分化。目前,TGFβ1信号通路在HPC增殖分化中直接作用方面的相关研究尚少,该信号通路具体通过什么途径影响HPC的分化以及是否与其他信号通路之间存在协同作用等问题仍需要进一步探索。本实验中,HPC分化成为具有类似肝脏组织结构和功能的胆管细胞或肝细胞受TGFβ1信号通路的调控,可为后续的肝胆疾病的细胞治疗和基因治疗提供可靠、简便的细胞来源或理论基础。
