乙型肝炎肝硬化患者血浆D-二聚体水平变化的临床意义
2020-03-26王春艳付懿铭陈松海李忠斌陈国凤
徐 静, 纪 冬, 王春艳, 付懿铭, 陈松海, 李忠斌, 陈国凤
1 安徽省阜阳市第二人民医院 肝脏病科二病区, 安徽 阜阳 236000;2 解放军总医院第五医学中心 肝硬化诊疗二中心,北京 100039
肝硬化的死亡率和致死率均较高[1],2009年-2016年,由肝硬化造成的年病死率从10.5%上升至200%[2]。我国乙型肝炎肝硬化约占全部肝硬化病例的66.7%~75%[3]。随着病情进展,乙型肝炎肝硬化患者一旦进入失代偿期,可出现肝功能衰竭、门静脉高压及多种并发症,预后差,死亡率高[4]。早期发现失代偿期肝硬化,可以改善乙型肝炎肝硬化患者的预后。
血浆D-二聚体(D-dimer,D-D)是纤维酶水解所产生的一种特异性降解产物,可反映机体纤维蛋白溶解功能。目前血浆D-D水平常用于静脉血栓形成的诊断与治疗[5]。临床诊疗中发现,乙型肝炎肝硬化患者往往出现血浆D-D水平升高,尤其是病情较重的失代偿期患者。因此本研究旨在探索乙型肝炎肝硬化患者血浆D-D水平升高与患者病情严重程度的关系,同时分析其与门静脉血栓形成(portal vein thrombosis,PVT)有无相关性,以期指导临床实践。
1 资料与方法
1.1 研究对象 选取解放军总医院第五医学中心2018年1月-12月收治的乙型肝炎肝硬化患者。纳入标准:(1)患者明确诊断乙型肝炎肝硬化,诊断标准依据《慢性乙型肝炎防治指南(2015年更新版)》[6];(2)检测D-D水平;(3)所有患者均行增强CT或MRI检查以评估是否存在PVT,包括肝内门静脉分支、门静脉主干、肠系膜上静脉及脾静脉。排除标准:(1)患者合并恶性肿瘤;(2)入院时因缺乏相关数据资料,Child-Pugh及MELD评分无法计算;(3)合并其他病因所致肝硬化者。本研究方案经由解放军总医院第五医学中心伦理委员会审批(批号:2019024D),患者均签署知情同意书。
1.2 方法
1.2.1 血清学检查方法 患者入院第2日清晨抽取空腹静脉血3~5 ml送至解放军总医院第五医学中心检验科,选择美国ACLTOP500型全自动生化分析仪及其配套试剂,采用免疫比浊法检测D-D水平。
1.2.2 观察指标 收集资料包括患者的年龄、性别、BMI、D-D水平、ALT、AST、TBil、Alb、Child-Pugh分级、MELD评分及是否存在PVT。
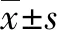
2 结果
2.1 患者一般资料及实验室指标比较 共纳入500例乙型肝炎肝硬化患者,根据D-D水平分为正常组(D-D≤0.55 mg/L,n=217)和升高组(D-D>0.55 mg/L,n=283)。两组患者性别、年龄及BMI比较,差异均无统计学意义(P值均>0.05);而ALT、AST、TBil、Alb、Child-Pugh分级、MELD评分、PVT发生率比较,差异均有统计学意义(P值均<0.05)(表1)。
2.2 血浆D-D水平与Child-Pugh分级的关系 在D-D水平正常组、D-D水平升高组及全部患者中Child-Pugh C级患者D-D水平均最高,其次为Child-Pugh B级患者,Child-Pugh A级患者D-D水平最低(图1)。进一步相关性分析结果显示,D-D水平正常组、D-D水平升高组及全部患者组D-D水平与Child-Pugh分级均呈正相关(r值分别为0.463、0.455、0.677,P值均<0.001)。

表1 两组患者一般资料及实验室指标比较
注:a,全部患者;b,D-D正常组患者;c,D-D升高组患者。
图1不同Child-Pugh分级乙型肝炎肝硬化患者的血浆D-D水平比较
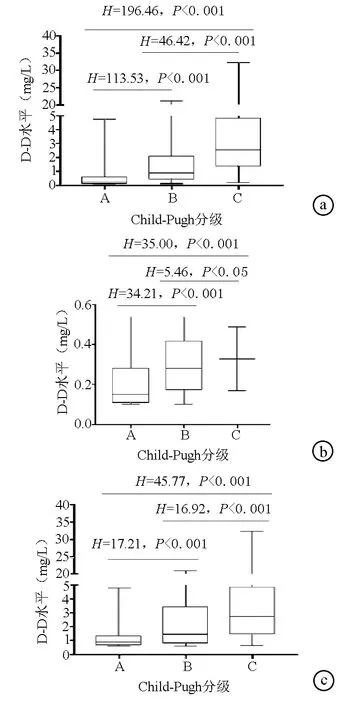
2.3 血浆D-D水平与MELD评分的关系 D-D水平正常组、升高组及全部患者血浆D-D水平与MELD评分均呈正相关(r值分别为0.214、0.756、0.781,P值均<0.05)(图2)。此外,MELD评分>18的患者(高危)其D-D水平明显高于MELD评分≤18的患者[(1.80±0.15) mg/L vs (0.18±0.02) mg/L,t=3.071,P=0.002]。
2.4 血浆D-D水平与PVT的关系 共50例乙型肝炎肝硬化患者合并PVT。分析结果显示,PVT阳性患者的D-D水平明显高于PVT阴性患者[1.96(0.82~4.91) mg/L vs 0.61(0.19~1.54) mg/L,Z=-6.02,P<0.001](图3)。绘制D-D诊断PVT的ROC曲线,结果显示,最佳诊断界值为0.76 mg/L,ROC曲线下面积(AUC)和95%可信区间为0.758(0.719~0.796),敏感度为86.0%,特异度为57.8%(图4)。
3 讨论
D-D是一种纤维蛋白降解产物,通常在机体继发性纤溶亢进时升高[7]。目前检测D-D水平已应用于各种临床实践[8-9],其在排除诊断下肢深静脉血栓形成和肺栓塞中的应用价值已得到充分肯定[5,10]。本研究分析了乙型肝炎肝硬化患者的血浆D-D水平,发现部分患者血浆D-D水平明显升高,且与Child-Pugh分级及MELD评分呈明显的正相关。该结果与之前的几项研究基本一致。如Drolz等[11]评估肝硬化患者常规凝血参数对新发大出血的影响时发现,肝硬化患者血浆D-D水平明显升高;Rautou等[12]在肝硬化患者循环微粒组织因子活性增加的研究中也发现肝硬化患者D-D水平明显升高;Li等[13]对703例肝硬化患者进行了回顾性分析,发现肝硬化患者D-D水平明显升高,且D-D水平与Child-Pugh评分呈正相关(r=0.219,P<0.001)。该研究还发现D-D水平与MELD评分呈正相关(r=0.207,P<0.001),MELD评分>15的患者其D-D水平明显高于评分≤15的患者。Child-Pugh分级和MELD评分是对肝硬化患者肝功能储备及预后进行量化评估的分级标准,在临床上应用广泛。Child-Pugh分级和MELD评分越高,表明肝功能的储备越差,患者预后越差[14-15]。MELD评分>18通常被划分为高危患者,住院3个月的病死率在10%以上。本研究结果显示,MELD评分>18的患者D-D水平明显高于MELD评分≤18的患者,可见乙型肝炎肝硬化患者病情越重,D-D水平越高,提示血浆D-D水平可能与乙型肝炎肝硬化病情严重程度有关。Qi等[16]研究发现血浆D-D水平越高的乙型肝炎肝硬化患者,其病情越重,与本文研究结果一致,且这些患者病死率更高,也支持了D-D水平可能与乙型肝炎肝硬化严重程度有关。肝硬化患者血浆D-D水平升高的原因尚不清楚,肝脏是凝血因子合成的场所,失代偿期肝硬化患者合成凝血减少,凝血酶原时间延长,打破了人体内凝血-纤溶系统的平衡,机体为了维持这种平衡而进行代偿性的调节,使得部分患者可能恰好能够维持平衡,部分患者可能表现为代偿不足,还有部分患者代偿过度处于高凝状态,出现继发性纤溶亢进,导致血浆D-D水平升高。已有学者[17-18]提出重症肝硬化患者存在肝内高凝状态和纤维蛋白沉积,微血栓形成导致门静脉微脉管系统逐渐闭塞,导致继发性纤溶亢进,进而引起体内D-D水平升高。然而先前提及的关于肝内高凝的研究大部分都是基于酒精性肝硬化,关于乙型肝炎肝硬化血液凝固和纤维蛋白溶解状态的报道较少。需要进一步的大样本研究为乙型肝炎肝硬化肝内高凝与D-D水平之间的关系提供证据。

注:a,全部患者;b,D-D正常组患者;c,D-D升高组患者。
图2乙型肝炎肝硬化患者血浆D-D水平与MELD评分的关系
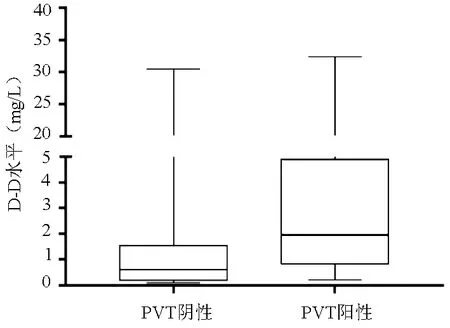
图3 PVT阴性组与阳性组患者血浆D-D水平比较

图4 D-D诊断PVT的ROC曲线
PVT是肝硬化患者常见的并发症之一,严重的PVT可导致门静脉高压,进而引起反复的消化道出血、顽固性腹水及脾功能亢进[19-20],因此早期发现PVT可以改善乙型肝炎肝硬化患者的预后,提高生存质量。本研究纳入500例乙型肝炎肝硬化患者中有50例合并PVT,发生率为10%。Cui等[21]对106例乙型肝炎肝硬化患者进行分析,试图寻找PVT的预测因素,发现PVT的发生率为12.8%,与本研究相仿。本研究同时发现50例PVT阳性患者较PVT阴性患者有更高的血浆D-D水平,在最佳诊断界值为0.76 mg/L时,AUC为0.758,提示血浆D-D水平可能用于PVT的诊断。Wei等[22]研究也显示,合并PVT的患者血浆D-D水平明显高于无PVT者[(261.85±135.00) ng/ml vs (164.15±132.45) ng/ml,P<0.001)],与本研究结果一致。Malaguarnera等[23]研究同样支持笔者的研究结果。但Dai等[24]对肝硬化患者D-D水平与PVT关系的回顾性分析发现,PVT阳性与PVT阴性患者D-D水平无明显差异(P=0.146);进一步的ROC曲线分析显示,D-D预测PVT的AUC为0.606(95%可信区间:0.478~0.724,P=0.139)。分析可能原因为Dai等研究的样本量较少(66例),且肝硬化病因不单一。肝硬化PVT形成的机制目前尚不明确,除了与肝硬化患者肝内高凝状态有关外,门静脉血流缓慢减少、门周淋巴管炎和纤维化的存在均可能起着很重要的作用[25]。
本研究的主要局限在于为回顾性研究,患者可能存在潜在的选择偏差,但因本研究样本量相对较大,且基线资料无明显差异,故此偏差影响较小。
综上,D-D水平与乙型肝炎肝硬化患者的病情严重程度及PVT密切相关,可能作为判断乙型肝炎肝硬化患者预后的指标;同时PVT患者通常具有较高的D-D水平,因此对于D-D水平升高的患者应警惕合并PVT的可能,及时干预,积极复查,早期发现栓塞的存在,早期治疗,有助于改善患者预后。
