不同阶段慢性乙型肝炎患者外周血单个核细胞中NF-κB/iNOS的表达及免疫状态
2020-03-26张美泉何道兴
黄 津, 张美泉, 何道兴
1 福建医科大学附属南平第一医院 感染科, 福建 南平 353000;2 福建省立医院北院 感染科, 福州 350000
HBV仍是世界性的难题,平均每年死于HBV感染相关性疾病(如肝衰竭、肝硬化和肝癌)约100万人[1]。目前,HBV感染的发病机制仍处于探索阶段,主要与感染的年龄、途径、病毒因素和机体免疫因素等有关,特别是针对HBV产生的特异性免疫反应成为研究热点[2]。研究[3]表明,HBV感染者个体差异较大,在HBV感染过程中,淋巴细胞具有向感染的肝组织迁移、浸润的特点,参与抗病毒免疫应答及炎症发生发展过程,并发挥着关键作用。核因子-κB(NF-κB)具有介导调控免疫炎症相关基因的转录功能;诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)作为NF-κB下游重要的结合位点,在炎症反应时呈高度表达,其产生NO作为细胞免疫和细胞毒性的效应分子,NF-κB-iNOS-NO信号通路在肝脏疾病的炎症、细胞凋亡、氧化应激等反应中起重要作用,在HBV患者不同阶段外周血单个核细胞(PBMC)中的研究甚少,而将二者相关联的研究尚无。因此,本课题旨在研究HBV患者不同发病阶段外周血淋巴细胞亚群计数水平,同时检测PBMC中NF-κB、iNOS的蛋白表达水平并探讨其对机体免疫的影响,深入研究宿主抵抗HBV感染的免疫反应机制并挖掘潜在的免疫治疗靶点具有重要的临床意义。
1 资料与方法
1.1 研究对象 选取2017年10月-2019年1月福建医科大学附属南平第一医院感染科收治的慢性乙型肝炎、肝衰竭、失代偿期肝硬化、原发性肝癌患者各20例,其中男46例,女34例,年龄22~69岁,平均(49.6±13.3)岁,另选取10例健康志愿者作为对照组。入选标准:(1)慢性乙型肝炎患者诊断符合《慢性乙型肝炎防治指南(2015年更新版)》[4],同时HBsAg阳性>6个月,且HBV DNA持续阳性,ALT>200 U/L;(2)肝衰竭患者诊断符合《肝衰竭诊治指南(2018年版)》[5];(3)肝硬化患者诊断符合2018年欧洲肝病学会制订的“失代偿期肝硬化患者的管理临床实践指南”[6],评分达Child-Pugh分级C级;(4)肝癌诊断符合《原发性肝癌诊疗规范(2017年版) 》[7],属于Ⅱa期到Ⅲb期。排除标准:妊娠、心血管疾病、代谢性疾病、严重感染性疾病、血液系统疾病、风湿免疫性疾病。本研究获得福建医科大学附属南平第一医院伦理委员会同意。
1.2 方法
1.2.1 主要仪器和试剂 GIS凝胶成像分析系统(上海天能科技有限公司);流式细胞仪(美国Becton Dickinson公司);CD3-FITC、CD4-APC、CD8-PE、CD19-APC、CD16/CD56-PE标记抗体及IgG2bFITC/IgG1PE同型对照抗体(美国Becton Dickinson公司);人淋巴细胞分离液(天津灏洋生物有限公司);NO检测试剂盒和人IL-6 ELISA试剂盒(南京建成公司);胎牛血清(美国Gibco公司);NF-κB p65抗体、iNOS抗体(武汉杰圣德生物科技有限公司)。
1.2.2 流式检测淋巴细胞 留取各组外周静脉血3 ml,使用EDTA抗凝,各取100 μl于流式专用试管中,分别加入50 μl荧光素标记的单克隆抗体,室温避光孵育20 min。各管均加红细胞裂解液500 μl,室温静置15 min,加入500 μl稀释液混匀,1500 r/min离心5 min,弃上清,再加稀释液500 μl混匀,最后使用FACSCalibur型流式细胞仪上机检测,记录CD3+、CD3+CD4+、CD3+CD8+、CD4+/CD8+、CD3-CD19+、CD16+/CD56+结果。
1.2.3 Western Blot方法检测NF-κB、iNOS蛋白的表达 各组研究对象均采集清晨空腹静脉血(肝素抗凝)8 ml,3000 r/min离心10 min,分离血浆,-80 ℃冰箱保存。应用密度梯度离心法分离PBMC,吸取白膜层放入离心管,加入PBS,室温1500 r/min离心10 min,共2次。弃上清,加1 ml含10%胎牛血清RPMI-1640培养基,吹打混匀,制成PBMC细胞悬液,培养24 h后检测。胰酶消化离心获得细胞,加入冰预冷裂解缓冲液,高速冷冻离心机离心获得蛋白,BCA法检测蛋白浓度后,每管取20 μg蛋白量上样,经SDS-PAGE进行凝胶电泳分离,湿法转膜,将蛋白转移至PVDF膜上。在室温下用50 g/L牛血清白蛋白封闭液进行封闭2 h,洗膜后加NF-κB、iNOS、GAPDH一抗孵育(用5%的BSA抗体缓冲液按1∶1000稀释抗体),4 ℃封闭过夜;TBST洗涤3次,每次30 min,加入辣根过氧化物酶标记的二抗,温室封闭孵育2 h;用增强型化学发光系统ECL显影,通过曝光、显影、定影,最后用Bandscan5.0图像分析软件分析各组蛋白目标带的分子量和灰度值,以NF-κB、iNOS与对应的内参GAPDH蛋白灰度值相比,计算二者灰度比值。
1.2.4 硝酸还原酶法和ELISA法分别检测血清中NO、IL-6水平 收集各组患者血清,严格依据检测试剂盒说明书进行操作。
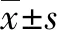
2 结果
2.1 各组外周血总淋巴细胞计数比较 与对照组比较,肝炎组、肝衰竭组、肝癌组、肝硬化组总淋巴细胞计数均下降,且肝衰竭组、肝癌组及肝硬化组下降更明显,组间比较差异均有统计学意义(P值均<0.05);肝衰竭组、肝癌组、肝硬化组总淋巴细胞计数与肝炎组比较亦明显下降(P值均<0.05)(表1)。
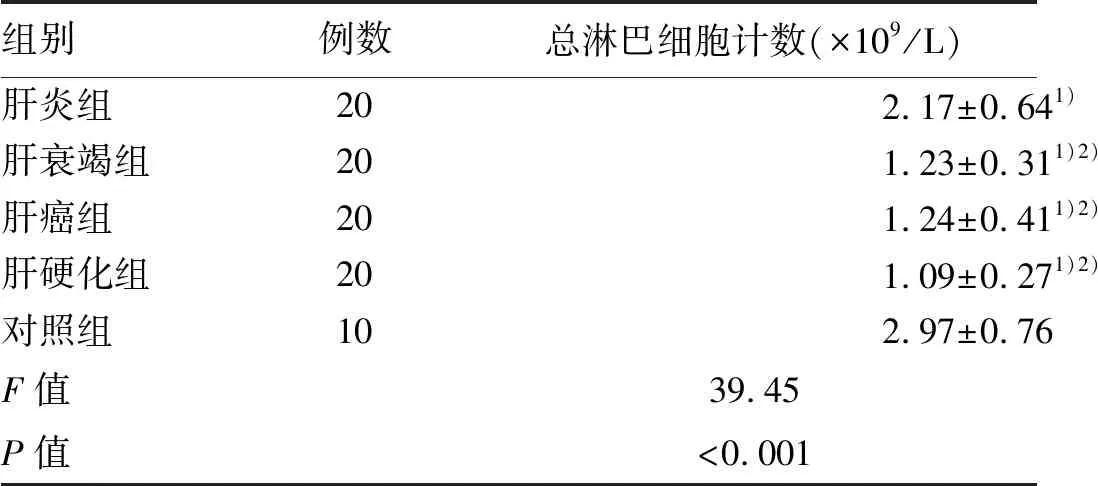
表1 各组外周血总淋巴细胞计数水平比较
注:与对照组比较, 1)P<0.05;与肝炎组比较, 2)P<0.01。
2.2 各组外周血淋巴细胞亚群计数水平比较 与对照组比较,肝衰竭组、肝癌组、肝硬化组CD3+下降,差异均有统计学意义(P值均<0.05),与肝炎组比较,差异也均有统计学意义(P值均<0.05);肝衰竭组、肝癌组、肝硬化组与肝炎组比较CD4+下降,差异均有统计学意义(P值均<0.05);肝衰竭组较肝癌组、肝硬化组、对照组CD8+升高,差异均有统计学意义(P值均<0.05);肝衰竭组较其他4组CD4+/CD8+降低,差异均有统计学意义(P值均<0.05)(表2)。
肝衰竭组、肝硬化组、肝炎组和对照组比较,CD3-CD19+升高,差异均有统计学意义(P值均<0.05);肝衰竭组、肝癌组、肝炎组和对照组比较,CD16+CD56+下降,差异均有统计学意义(P值均<0.05)(表3)。
2.3 各组PBMC中NF-κB、iNOS蛋白表达水平的比较
各组间NF-κB蛋白表达水平差异有统计学意义(F=30.62,P<0.001),其中肝硬化组、肝衰竭组、肝癌组NF-κB蛋白表达水平明显高于肝炎组,亦明显高于对照组(P值均<0.05);各组间iNOS蛋白表达水平差异有统计学意义(F=51.32,P<0.001),其中肝硬化组、肝衰竭组、肝癌组iNOS蛋白表达水平明显高于肝炎组,亦明显高于对照组(P值均<0.05)(图1)。
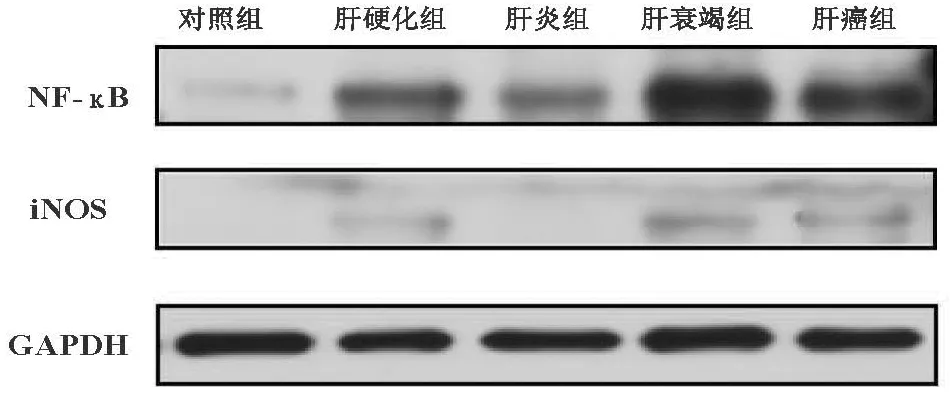
图1 NF-κB、iNOS和GAPDH蛋白表达情况
2.4 各组NO和IL-6水平的比较 肝炎组、肝衰竭组、肝癌组、肝硬化组的NO水平与对照组比较明显升高(P值均<0.05);肝炎组、肝衰竭组、肝癌组、肝硬化组的IL-6的表达水平与对照组比较亦明显升高(P值均<0.05)(表4)。
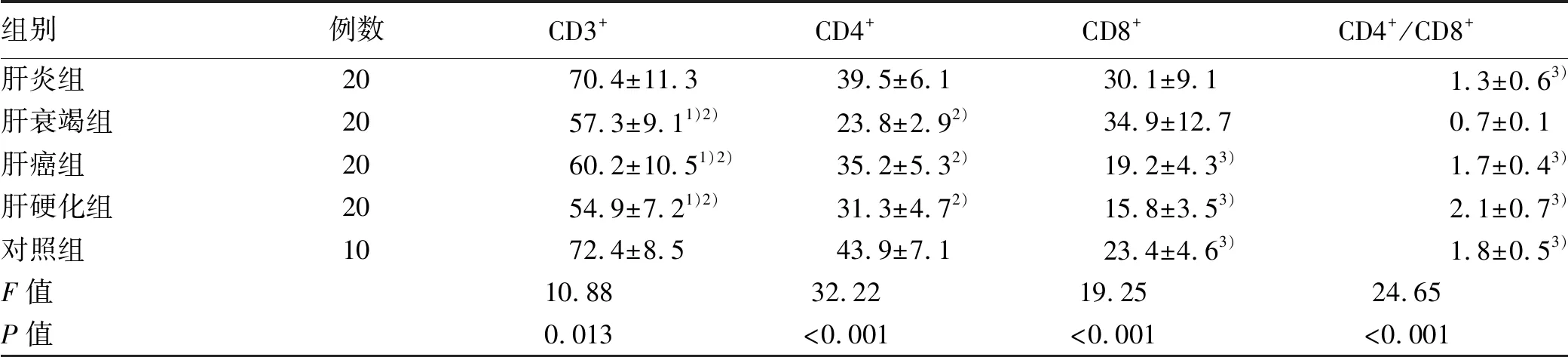
表2 外周血T淋巴细胞亚群百分率比较
注:与对照组比较, 1)P<0.05;与肝炎组比较, 2)P<0.05;与肝衰竭组比较, 3)P<0.05。
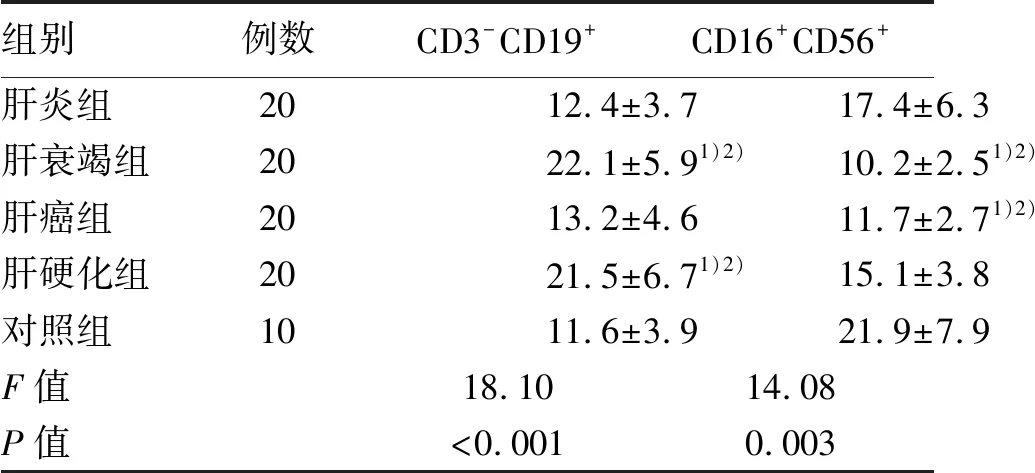
表3 自然杀伤细胞和B淋巴细胞亚群百分率比较
注:与对照组比较, 1)P<0.05;与肝炎组比较,2)P<0.05。

表4 各组NO和IL-6水平比较
注:与对照组比较, 1)P<0.05。
3 讨论
HBV感染者可以通过机体较强的免疫反应将病毒完全清除,但仍有很大部分演变成慢性病毒感染[8]。慢性HBV感染后的结局包括无症状携带者、肝炎,甚至肝硬化和肝癌。研究[9]表明,HBV感染者个体差异很大,在不同阶段的免疫功能、病毒复制水平及肝脏炎症程度皆不尽相同,淋巴单核细胞在机体抗病毒免疫应答中起关键作用。本研究发现,HBV感染后机体免疫细胞数量和比例下降,尤其以肝硬化组、肝衰竭组和肝癌组患者淋巴细胞比例下降更为明显,与对照组比较差异均有统计学意义(P值均<0.05),这也提示了HBV感染者免疫状态与乙型肝炎相关疾病的病程和病情严重程度有关。
HBV特异性免疫应答在HBV清除中起主要作用,慢性感染时,HBV特异性T淋巴细胞易凋亡,寡克隆存在,分泌细胞因子功能和增殖能力显著降低,T淋巴细胞功能耗竭,HBV持续复制[10]。CD3+、CD4+、CD8+T淋巴细胞在抗原的识别、递呈及各种细胞因子的分泌方面都起着极其重要的作用,在抗HBV感染免疫中起核心作用[11]。在HBV感染过程中CD3+、CD4+T、CD8+T淋巴细胞亚群的激活可能导致机体对HBV产生不同的免疫反应,从而导致不同的临床表现和转归[12]。本研究发现,在慢性乙型肝炎患者的不同感染阶段,T淋巴细胞表达存在差异,肝衰竭组、肝癌组、肝硬化组与肝炎组比较,CD3+差异具有统计学意义;肝衰竭组、肝癌组、肝硬化组与肝炎组比较,CD4+明显下降;肝衰竭组较肝癌组、肝硬化组、对照组CD8+明显升高;肝衰竭组CD4+/CD8+较其他4组明显降低。上述结果均提示HBV感染在发病阶段细胞免疫功能明显紊乱,CD4+T淋巴细胞消耗,细胞毒性T淋巴细胞功能亢进,尤其是肝衰竭阶段表现最为明显,导致病毒不能有效的清除,加重肝细胞坏死。因此,在HBV感染过程中了解各亚群所发挥的作用是很关键的。
本研究同时发现,肝衰竭组、肝硬化组CD3-CD19+与肝炎组、对照组比较明显升高,肝衰竭组、肝癌组CD16+CD56+与肝炎组、对照组比较明显下降,表明HBV感染早期阶段机体免疫力尚能代偿,随着疾病进展,机体体液免疫下降,有肿瘤恶性病变、肝衰竭发生倾向,表明体液免疫在乙型肝炎相关疾病中发挥一定的作用,这与文献[13]报道一致。
NF-κB是一种具有多向性调节作用的核转录因子,参与细胞内信号传导的重要转录因子,其生物学功能是调控基因,特别是免疫炎症相关基因的转录[14]。NF-κB除了对T淋巴细胞的活化、增殖有重要作用外,还可调节B淋巴细胞免疫球蛋白基因的表达[15]。iNOS催化NO生成速度慢、量较多、持续时间长,主要造成细胞和组织损伤。马雪莲等[16]使用刀豆蛋白A刺激小鼠建立免疫性肝损伤模型,随着刀豆蛋白A诱导时间延长,NF-κB转入细胞核的水平不断增高,小鼠肝组织内的iNOS增加,从而生成超过生理剂量并具有细胞毒性的NO,加重肝组织免疫损伤;而使用NF-κB抑制剂后,iNOS的表达下降,减少了NO的生成,肝损伤较前改善,由此认为NF-κB调控iNOS可能是发生免疫性肝损伤的关键环节。本研究发现肝硬化组、肝衰竭组、肝癌组NF-κB和iNOS蛋白表达水平与肝炎组、对照组比较明显增高,组间差异均具有统计学意义(P值均<0.05)。它们产生NO、IL-6等炎症因子水平明显超过正常健康人水平,由此推想NF-κB-iNOS-NO信号通路可能在肝脏疾病的炎症、细胞凋亡、氧化应激等反应中起重要作用。
总之,HBV感染相关疾病是以肝脏炎性病变为主,引起多器官损害的传染性疾病。但其确切的发生机制尚不明确,目前国内外研究均认为HBV感染后激发机体的细胞免疫机制是导致肝组织损伤的主要原因。依据上述研究,NF-κB/iNOS/NO信号通路很可能参与HBV相关疾病的免疫反应及影响。下一步将使用NF-κB抑制剂吡咯烷二硫代氨基甲酸盐干预各组研究对象后再检测NF-κB/iNOS/NO的表达,明确对下游炎症因子及免疫细胞的调控作用,深入探讨乙型肝炎及其相关疾病发生的分子机制,以期对HBV感染性疾病的进展及转归在临床免疫干预方面提供新的思路。
