响应面法优化耧斗菜根系多糖提取工艺
2020-03-26郭爱华
武 江,杨 阳,杨 冉,郭爱华,张 超
(山西省农业科学院园艺研究所,山西太原030031)
耧斗菜(Aquilegia vulgaris L.)为毛茛科耧斗菜属多年生草本宿根植物,耐寒,根肥大,圆柱形,外皮黑褐色,有少数分枝,原产于欧洲和北美洲[1]。我国有丰富而珍贵的耧斗菜野生资源,分布于青海东部、甘肃、宁夏、陕西、山东、河北、山西、内蒙古、辽宁、吉林、黑龙江等地[2]。耧斗菜具有较高的观赏价值,此外其嫩茎、叶营养丰富可食用,根含糖,可制作饴糖或酿酒,全草或根可做妇科用药,有免疫活性、抗肿瘤活性、肝保护作用,具有较高的经济价值[3]。近年来,随着对植物多糖研究的不断深入,发现多糖对肿瘤、肝炎、心血管病等疾病的预防和治疗[4],以及调节糖代谢和抗衰老等方面具有独特的生物活性[5]。因其毒副作用小、安全性强、功能多等特点而被越来越多的人关注,相关的研究也日益受到重视[6]。对华北耧斗菜的化学成分分离后鉴定出13 种化合物[7]。另有研究表明,耧斗菜提取物对黑腹果蝇具有抗衰老作用[8]。在植物多糖的提取方法中,多采用热提法[9]、回流法和超声波法[10],回流波法与超声波法曾应用在提取蒙药耧斗菜多糖中,但是目前采用响应面法分析优化耧斗菜多糖的最佳提取工艺还鲜有报道。
本研究以大花耧斗菜为试材验料,通过微波方法提取根系多糖,在单因素试验的基础上,利用Box-Behnken 对耧斗菜多糖的提取工艺进行响应面法(RSM)分析优化,考察关键工艺参数对耧斗菜根系多糖提取率的影响,旨在为进一步探究耧斗菜多糖的生物学活性提供依据。
1 材料和方法
1.1 试验材料
供试材料为大花耧斗菜(Aquilegia glandulosa Fisch.ex Link.),2019 年6 月定植于山西农业大学园艺站。
1.2 试剂与仪器
丙酮、葡萄糖、苯酚、浓硫酸、无水乙醚、无水乙醇,均为分析纯。
可见分光光度计VIS-723N(北京瑞利分析仪器有限公司)、万能破碎机FW80(天津泰斯特仪器有限公司)、电热鼓风干燥箱GZX-9146MBE(上海博讯有限公司医疗设备厂)、冷藏冷冻冰箱BCD-252KSA(青岛海尔股份有限公司)。
1.3 试验方法
1.3.1 耧斗菜根系粗多糖的提取 挖取大花耧斗菜根系,烘干并研磨成粉末,过0.177 mm 筛。准确称取耧斗菜根系粉末0.2 g,倒入烧杯中,按照一定的料液比与蒸馏水混合,后置于微波炉中进行辅助提取。将辅助提取后的提取液于80 ℃热水浸提1 h,离心20 min(3 500 r/min),取上清液,加入3 倍体积的无水乙醇,在4 ℃冰箱中放置过夜,后离心20 min(3 500 r/min)得沉淀,再依次用无水乙醇、丙酮、无水乙醚清洗,通风干燥,得粗多糖。
1.3.2 耧斗菜根系多糖含量的测定 采用苯酚-硫酸法测量粗多糖含量[11-15],并于490 nm 的波长处测定吸光值。回归方程为:a=1.186x-0.007 8(R2=0.994),其中,x 为490 nm 的吸光值,a 为还原糖质量浓度(mg/mL)。
式中,a 为回归方程计算所得多糖质量浓度(mg/mL);b 为稀释倍数;c 为耧斗菜根系多糖相对于葡萄糖的换算因子1.272;M 为耧斗菜粉末质量。
1.3.3 单因素试验 在1.3.2 试验基础上,使用微波辅助提取法,设置不同的微波时间(20、30、40、50、60 s)、微波功率(20、40、60、80、100 W)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)),进行单因素试验,检测所得到的耧斗菜根系多糖粗提液中多糖含量,并计算粗多糖提取率。
1.3.4 Box-Behnken 试验设计及响应面分析 使用Design Expert 8.0.6 软件中的中心组合试验设计原理,在单因素试验的基础上,以微波时间(X1)、微波功率(X2)、料液比(X3)为自变量,以多糖提取率(Y)为响应值,进行3 因素3 水平响应面法分析试验。将各因素以1、0、-1 编码,其中,0 为最佳条件,-1 为较低水平,1 为较高水平(表1)。通过对试验结果的回归方差分析,优化耧斗菜根系多糖的提取工艺条件。

表1 Box-Behnken 试验设计因素和水平
2 结果与分析
2.1 微波工艺单因素试验结果分析
2.1.1 微波时间对耧斗菜根系多糖提取率的影响由图1 可知,在微波功率60 W、料液比1∶20(g/mL)的条件下,耧斗菜根系多糖提取率随着微波时间的延长缓慢增大,当微波时间超过50 s 后,多糖提取率呈快速下降趋势。这是因为随着微波时间的增加,提取温度升高,多糖降解率也增加,从而导致提取率下降。因此,考虑50 s 为微波法中耧斗菜根系多糖提取的适宜微波时间。
2.1.2 微波功率对耧斗菜根系多糖提取率的影响由图2 可知,在微波时间30 s、料液比1∶20(g/mL)条件下,随着微波功率的增加,耧斗菜根系多糖提取率增加,微波功率为40 W 时,耧斗菜根系多糖提取率达到最大,继续提高微波功率,则多糖提取率下降。这可能是因为微波功率增大造成提取液温度升高,部分多糖分解造成提取率降低。
2.1.3 料液比对耧斗菜根系多糖提取率的影响 由图3 可知,在微波时间30 s、微波功率60 W 的条件下,随着料液比的增加,多糖提取率逐渐增大,当料液比为1∶20(g/mL)时,耧斗菜根系多糖提取率达到最大。但若继续增大料液比,多糖溶出量反而降低。这是因为料液比达到一定比值时,根系中的多糖基本全部溶出,扩散达平衡,继续增大溶剂量也不会促进多糖的提取,反而会加重后续浓缩负担[16]。
2.2 微波法多糖提取工艺的响应面分析
2.2.1 响应面法优化试验结果 采用Box-Behnken设计原理对耧斗菜根系多糖提取条件进行3 因素3 水平的响应面分析试验,结果如表2 所示。
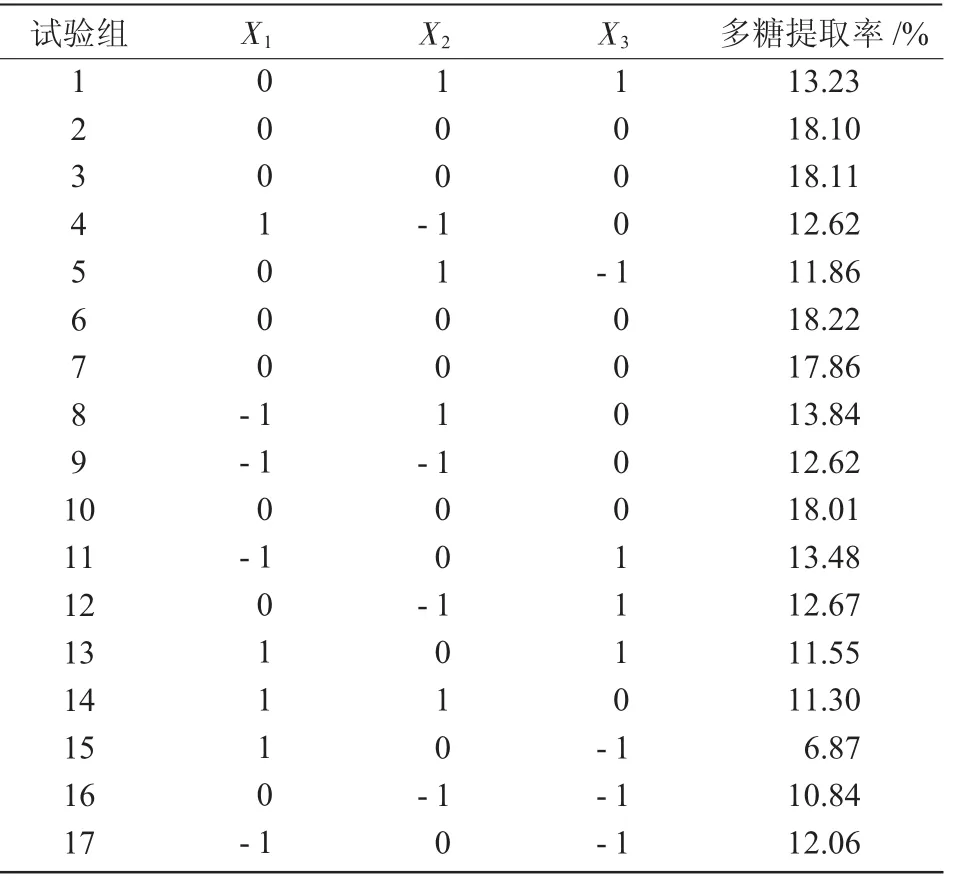
表2 微波法响应面试验设计及结果
以耧斗菜根系多糖提取率(Y)为响应值,得到提取率对微波时间(X1)、微波功率(X2)、料液比(X3)的回归方程为Y=-32.434 726+7.716 296X1+3.139 657X2-0.019 000X3-0.058 190X1X2+5.890 070X1X3+0.001 008X2X3-0.001 488X12-0.025 040X22+0.002 029X32。对模型方程进行显著性检验,由表3 可知,回归模型极显著(P<0.000 1),失拟项不显著(P=0.110 6),实际试验值与预测具有高度相关性。表明模型与试验值拟合良好,试验方法可信度高,该模型可以对耧斗菜根系多糖的提取率进行准确预测和分析。从表3 还可以看出,微波时间、料液比对耧斗菜根系多糖提取率有极显著影响,微波功率对耧斗菜根系多糖提取率的影响不显著。
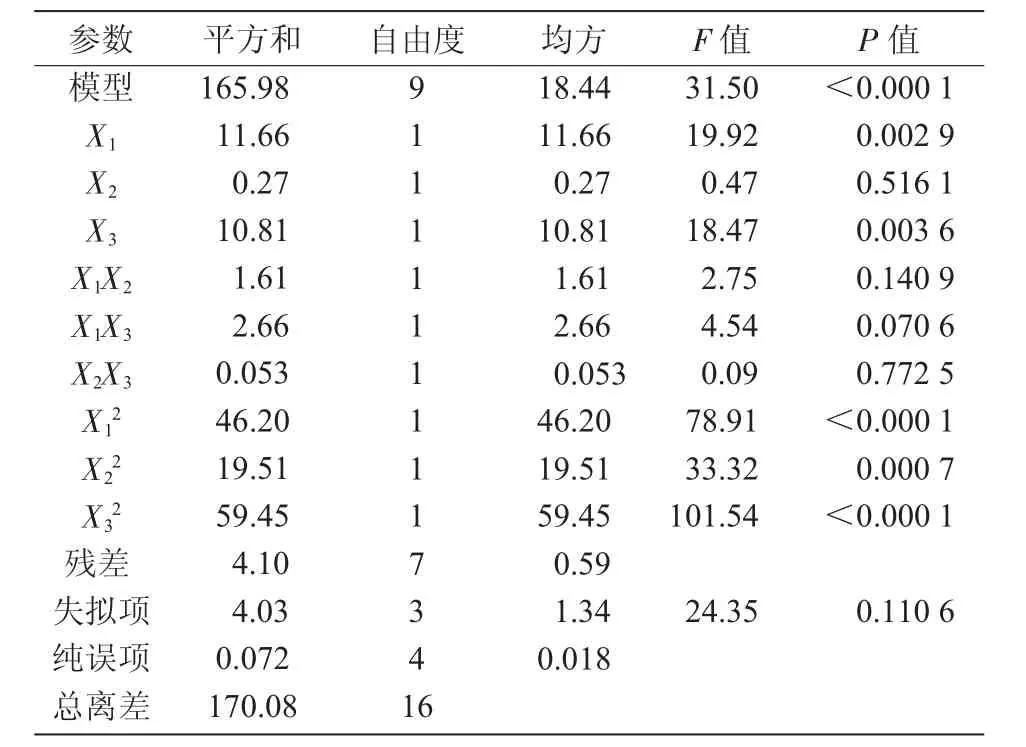
表3 微波法回归模型
2.2.2 响应面直观分析 依据回归方程,可以获得耧斗菜根系多糖提取的微波时间、微波功率和料液比两两因素交互作用的响应曲面和等高线,如图4、5、6 所示。
从图4、5、6 可以看出,任何2 个交互因素的响应面都存在最高点,微波时间和微波功率的交互作用、微波时间和料液比的交互作用以及料液比和微波功率的交互作用对多糖提取率的影响均为显著(等高线为椭圆形)。同一料液比水平下,随微波时间和微波功率的增加,多糖提取率逐渐增加,到达最高点后下降。即多糖得率在合适的微波时间和微波功率下具有极大值,该极大值存在于响应面的顶部,也就是等高线最小椭圆的中心点[17]。同理可得,微波时间和料液比、微波功率和料液比这2 对交互因素之间也具有极大值。通过软件分析得到,提取耧斗菜根系多糖的最优条件为:提取时间44.57 s、提取功率56.47 W、料液比1∶20.82(g/mL)。
2.3 试验验证
为了检验模型的准确性,根据试验条件调整的最佳提取条件为:提取时间44 s、提取功率60 W、料液比1∶21(g/mL)。在此条件下进行试验验证和重复性考察,得到真实最佳得率为17.64%,与理论得率18.21%仅相差0.57 百分点。进一步表明,所得模型可以较好地预测耧斗菜根系多糖的提取情况。
3 结论与讨论
本研究选择微波时间、微波功率和料液比3 个对耧斗菜根系多糖提取率影响较大的因素设计试验,在单因素试验的基础上,通过Box-Behnken 设计,建立相应的二次回归方程。通过方差分析和响应曲面分析发现,微波时间和料液比为耧斗菜根系多糖提取过程中的显著因素,并且它们的二次项对多糖提取率的响应面曲线有非常显著的影响。同时,料液比分别与微波时间、微波功率之间的交互作用显著。
利用响应面法得到耧斗菜根系多糖的微波法提取过程优化的工艺条件为:提取时间44 s、提取功率60 W、料液比1∶21(g/mL);在此条件下,多糖提取率为17.64%,与理论值接近,模型方程高度显著,拟合度良好,可以较好地预测耧斗菜多糖的提取得率。
目前,植物药物中粗多糖的制备主要用常规的水提醇沉法[17]。本研究对大花耧斗菜多糖的提取方法进行了优化,通过响应曲面优化微波法中各提取条件,得到了较为理想的大花耧斗菜根系多糖的提取工艺,为进一步研究耧斗菜属其他植物药效物质基础提供理论依据。
