两种黏土矿物催化木质素腐殖化过程机理
2020-03-25徐俊平陈殿元
王 楠, 徐俊平,2, 陈殿元, 王 帅
(1. 吉林农业科技学院 农学院, 吉林 吉林 132101; 2. 中国农业大学 资源与环境学院, 北京 100094)
腐殖质(HS)形成主要分为两个阶段: 第一阶段, 产生形态不一、 分解阶段不同的有机残体; 第二阶段, 以微生物为主导的生化合成阶段, 即将第一阶段产生的化合物通过聚合作用形成不同分子量的复杂环状化合物. 目前, 关于第二阶段的研究有3种经典理论: 1) 木质素-蛋白质聚合理论, 认为木质素可为HS形成提供基础材料; 2) 生化合成理论, 认为微生物在HS形成中具有驱动作用; 3) 化学催化聚合理论, 认为矿物在HS形成中起催化作用[1]. 上述理论相互依存, HS形成的各种途径[2-3]均有木质素、 微生物及矿物的贡献. 其中, 木质素是HS芳香性的主要贡献者[4], 微生物是影响HS形成的直接驱动因素[5].
黏土矿物含量较高的土壤中HS含量也较高[6], 即黏土矿物有利于形成HS. Martin等[7]通过在E.nigrum和S.chartarum的固态培养基中添加蒙脱石和高岭石的研究表明, 黏土矿物可缩短暗色腐殖酸类聚合物的形成时间, 并增加聚合物产生的数量; 文献[8]研究表明, 黏土矿物的催化作用主要通过加速酚类物质形成而间接实现; 文献[9]研究表明, 土壤有机质(SOM)的稳定是由于矿物参与使微生物难以降解含碳物质所致. 蒙脱石、 高岭石和伊利石等硅酸盐矿物可提供永久或可变电荷, 具有较大的比表面积, 这些性质对土壤有机碳(SOC)的固定尤为重要[10]. 黏土矿物通过静电引力、 疏水作用、 配体交换及π键等多种机制结合SOC, 使其更易抵御微生物的矿化分解[11], 产生更多稳定性有机碳, 从而有利于合成HS. 不同矿物类型提供SOC的稳定机制不同[12], 由于蒙脱石大于高岭石的比表面积, 因此富含蒙脱石比富含高岭石的土壤固定更多的SOC.
目前对黏土矿物促进HS形成的非生物催化作用研究已有文献报道, 但对矿物在HS形成中的作用文献报道较少, 基于此, 本文采用液体摇瓶培养法, 以木质素为碳源, 通过接种混合菌株悬液, 添加高岭石和蒙脱石, 培养110 d, 对收集含有矿物的沉淀物质进行水淋洗去除有机分子, 并用扫描电子显微镜(SEM)、 Fourier变换红外光谱(FTIR)和X射线衍射(XRD)分析参与木质素转化的矿物表面结构.
1 材料与方法
1.1 材 料
木质素(CAS No[9005-53-2])购于日本东京化成工业株式会社; 高岭石(Kaolinite, K)和蒙脱石(Montmorillonite, M)均为国药集团化学试剂有限公司生产的高岭土(CAS No.[1332-58-7])和蒙脱土(CAS No.[1318-93-0]), 单位化学分子式分别为Al2[Si2O5](OH)4和Mg0.33Al1.67(Mg,Fe2+)0.33[Si4O10](OH)2, 高岭石和蒙脱石的N2-BET比表面积(SSA)分别为11.1,30.7 m2/g.
复合菌株由4种细菌(枯草芽孢杆菌(B.subtilis), 巨大芽孢杆菌(B.megaterium), 短小芽孢杆菌(B.pumilus), 地衣芽孢杆菌(B.licheniformis)), 2种放线菌(灰色链霉菌(S.griseus), 细黄链霉菌(S.microflavus))和3种真菌(绿色木霉(T.viride), 黑曲霉(A.niger), 桔青霉(P.citrinum))组成. 上述9种单一菌株悬液等体积掺混制成复合菌株悬液, 悬液中各菌落数(cfu)如下:B.subtilis,B.megaterium,B.pumilus,B.licheniformis,S.griseus和S.microflavus分别为5.9×106,2.6×106,7.2×106,4.4×106,6.0×109,4.2×109cfu/mL,T.viride,A.niger,P.citrinum孢子数分别为201, 68,158 cfu/mL.
1.2 方 法
采用液体摇瓶培养法, 由木质素提供碳源, 培养液配方为: 2.0 g NaNO3, 1.0 g K2HPO4, 0.5 g KCl, 0.5 g MgSO4, 0.01 g FeSO4, 1.0 g木质素, 1 000 mL水. 称取300 mL培养液装入500 mL锥形瓶中, 添加1.0 g黏土矿物, 塞紧自制棉塞, 用报纸包扎后进行高压蒸汽灭菌, 于121 ℃灭菌20 min, 彻底灭菌后, 在无菌条件下自然冷却, 接种复合菌株悬液.
为分析高岭石和蒙脱石在木质素腐殖化进程中的作用机理, 实验共设两个系列处理: 复合菌株悬液的接种体积按300 mL培养液接种20 mL进行, 接种后, 塞紧棉塞, 用报纸包扎, 在28 ℃恒温条件下摇瓶(180~200 r/min)培养110 d, 按10,30,60,110 d动态取样, 分别用K-10,K-30,K-60,K-110,M-10,M-30,M-60,M-110表示, 取样后立即离心(12 000 r/min, 10 min), 收集含有矿物的沉淀物质. 设置两个培养110 d后的对照(CK)处理: 用K-110-CK2或M-110-CK2表示不接种复合菌株悬液, 仅在木质素培养液中添加高岭石或蒙脱石; 用K-110-CK3或M-110-CK3表示在缺失木质素、 添加高岭石或蒙脱石的培养液中, 接种复合菌株悬液, 在110 d培养结束后立即离心, 收集沉淀物质. 将上述沉淀物质置于60 ℃鼓风干燥箱中烘至恒质量、 磨细过0.25 mm筛. K-样品和M-样品分别为高岭石和蒙脱石的原样品. 先用体积分数为30%的优级纯H2O2对上述沉淀物质及矿物原样品进行淋洗处理, 去除矿物表面的有机成分, 再用去离子水多次洗涤矿物样品后, 置于60 ℃鼓风干燥箱中烘至恒质量、 粉碎过0.25 mm筛, 最终得到产物.
1.3 测定方法
用日本岛津仪器公司生产的SS550型扫描电子显微镜(SEM)观察矿物样品的表面微观形貌. 测试条件: 15.00 kV, 分辨率为6 nm.
用天津港东科技发展股份有限公司生产的FTIR-850型Fourier变换红外光谱仪测试矿物样品的Fourier变换红外光谱(FTIR). 测试条件: 扫描次数32, 分辨率4 cm-1,Y轴格式为透过率, 切趾方式为Triangle, 每次采集样品前对背景进行采集并自动扣除.
用德国布鲁克公司生产的D8 FOCUS型X射线衍射仪对矿物样品进行检测. 测试条件: CuKα射线, Ni滤波, 40 kV, 40 mA, LynxEye192位阵列探测器, 扫描步长2θ=0.01°, 扫描速度为每步0.05 s,λ=0.154 059 8 nm.
1.4 数据处理方法
用FTIR-850型红外光谱仪自带的ZWin 850软件对FTIR谱进行背景扣除、 平滑、 自动基线校正、 标峰、 积分峰面积后, 按文件类型(*.CSV)导出数据; X射线衍射(XRD)数据用MDI Jade 6.0软件读取、 扣除背底、 平滑、 计算峰面积, 以文本格式(*.txt)保存数据, 并用Origin 8.0软件绘图.
2 结果与讨论
2.1 高岭石参与木质素转化的结构特征变化

图1 高岭石参与木质素腐殖化过程前后的SEM照片
图1为高岭石参与木质素腐殖化过程前后的SEM照片. 由图1(A)可见, 高岭石样品呈多颗粒聚集状态[13], 颗粒间结合松散、 边缘多由管状体卷曲而成, 其铝氧八面体层使其具有有序结构. 由图1(B)可见, 将含有结构水的高岭石添加到木质素培养液中, 经微生物转化后, 其结构水失衡, 边缘断键, 导致高岭石表面集聚负电荷, 铝氧八面体在培养液中形成氢氧化铝表面, 层间结构易遭破坏[14], 呈长程无序特征, 但硅氧四面体层仍可维系其原有层状结构特征. 图2为高岭石参与木质素腐殖化过程前后的FTIR光谱. 由图2可见, 3 421~3 438 cm-1处的吸收峰为高岭石表面水分子的对称伸缩振动(ν1型), 1 632~1 641 cm-1处的吸收峰为高岭石表面水分子的弯曲振动(ν2型), 1 100~1 103 cm-1处的吸收峰为Si—O的伸展振动, 831~849 cm-1处的吸收峰为AlMgOH的变形振动[15], 735 cm-1处的吸收峰为Si—O—Al的振动[16], 472,563 cm-1处的吸收峰为Si—O—Si的弯曲振动[13].
高岭石参与木质素腐殖化过程FTIR光谱主要吸附峰的相对强度列于表1. 由表1可见, 随着培养时间的延长, 高岭石表面水分子对称伸缩振动频率(ν1型)先降低再大幅度升高, 水分子弯曲振动频率(ν2型)逐渐增加. 与培养10,30,60 d的结果相比, K-110的Si—O伸展振动及Si—O—Si弯曲振动频率均下降. 高岭石比蒙脱石的比表面积(SSA)更小, 但蒙脱石较大比例的SSA为内表面积, 由于空间位阻, 菌株无法嵌入蒙脱石层间[13], 因此高岭石对复合菌株的亲和力更大, 在参与木质素微生物的转化过程中, 高岭石使表面水化层多点形成氢键, 增加了对菌体碳水化合物的固定[17], 使缔合—OH的伸缩振动(ν1和ν2型)增强. 在该过程中, Al—OH的边缘及基底八面体O发生脱羟作用[18], 产生更多自由基, 使四面体片和八面体片变形并产生大量断键, 导致Si—O,Si—O—Al和Si—O—Si的振动频率弱化, 晶体结构趋于无序化.
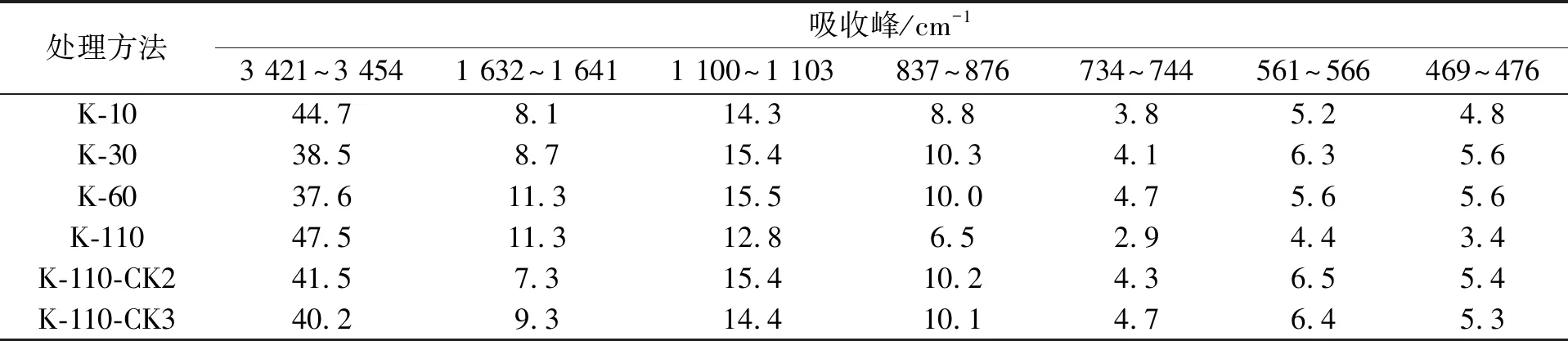
表1 高岭石参与木质素腐殖化过程FTIR光谱主要吸收峰的相对强度

图2 高岭石参与木质素腐殖化过程的FTIR光谱
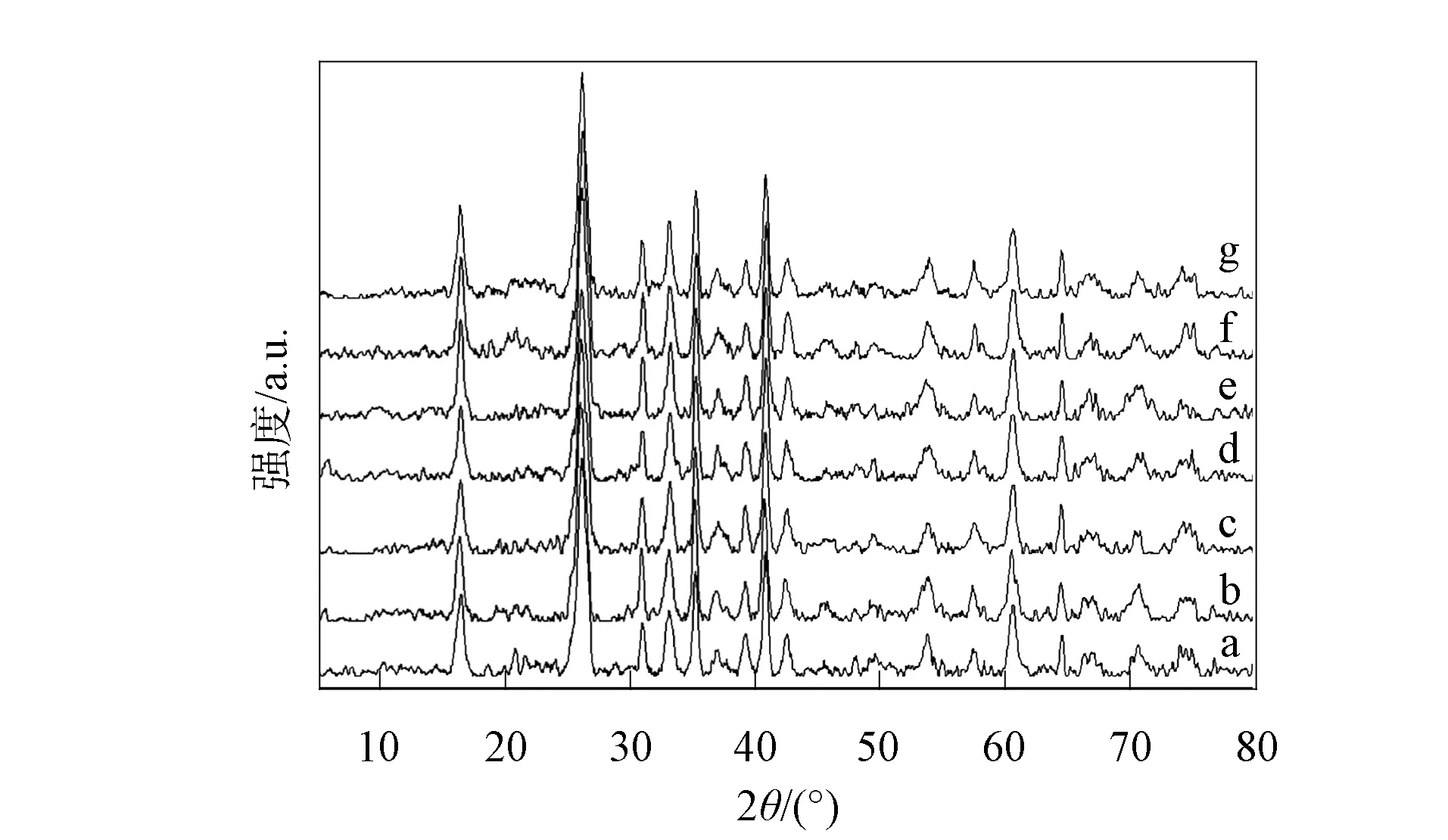
a. K-10; b. K-30; c. K-60; d. K-110;e. K-110-CK2; f. K-110-CK3; g. K-样品.
高岭石参与木质素转化形成类胡敏酸[19], 其Si—O—Al和Si—O键参与反应是其振动频率弱化的主要原因. 在高岭石存在的条件下, 仅添加木质素(K-110-CK2)或接种复合菌株悬液(K-110-CK3), AlMgOH,Si—O—Al和Si—O—Si的振动频率均无明显变化. 因此, 高岭石表面与菌株有较大的亲和力, 形成的氢键是高岭石稳定木质素并促使其转化的主要机制之一.
图3为高岭石参与木质素腐殖化过程的XRD谱, 高岭石参与木质素腐殖化过程XRD特征衍射峰的晶面间距列于表2. 由图3和表2可见: 高岭石在2θ=10°~16°几乎没有衍射峰, 属于低结晶度、 无序的高岭石样品; 在2θ=26.2°,31.0°,33.1°,35.2°,39.3°处均出现特征衍射峰, 衍射峰d值(晶面间距)分别位于3.40~3.41,2.88~2.89,2.69~2.70,2.54,2.28~2.30 nm处. 因此, 高岭石参与木质素转化过程, 衍射角2θ和晶面间距d仅发生了较小偏移, 未发生物相改变.
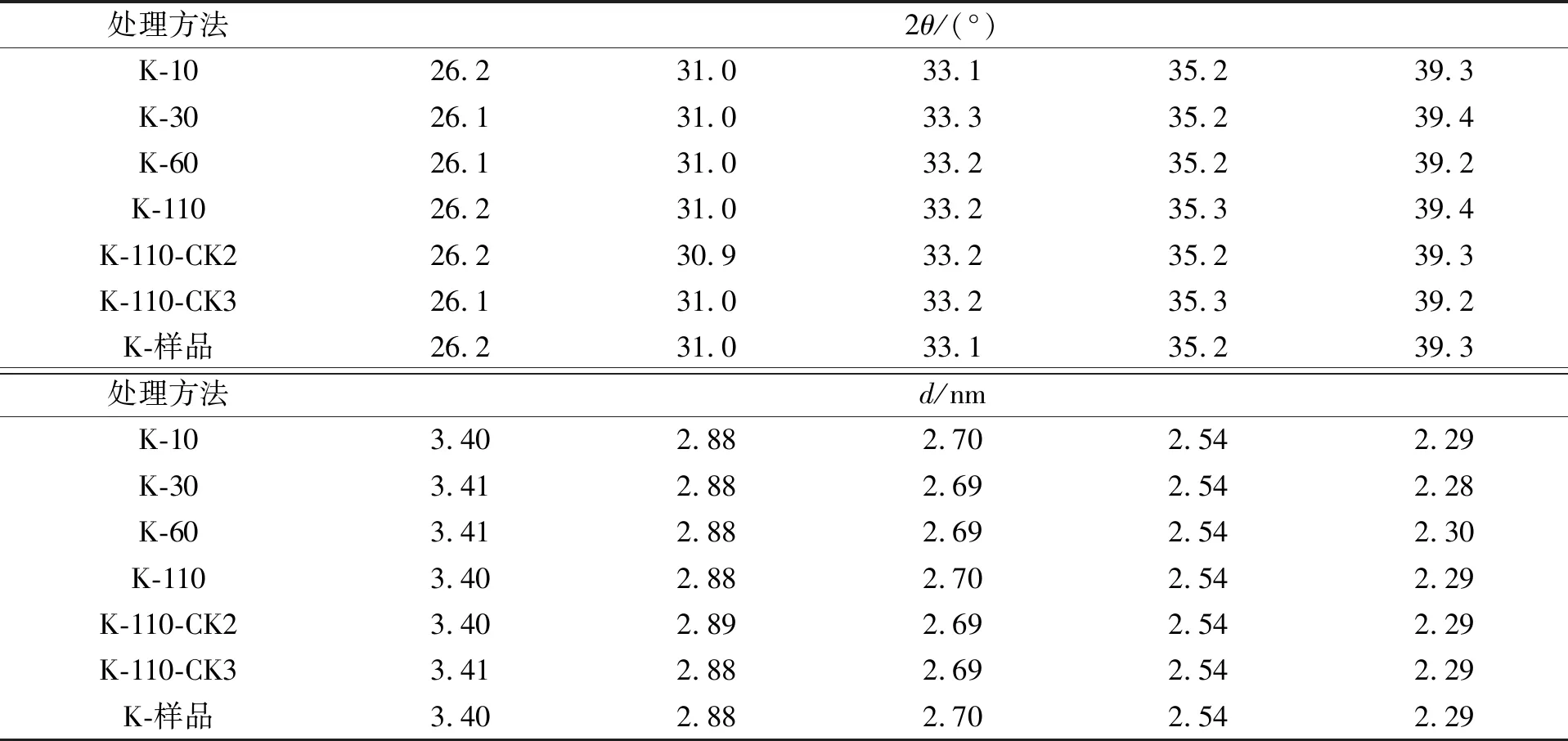
表2 高岭石参与木质素腐殖化过程XRD特征衍射峰的晶面间距
2.2 蒙脱石参与木质素转化的结构特征变化
图4为蒙脱石参与木质素腐殖化过程前后的SEM照片. 由图4可见, 蒙脱石表面微观结构呈团粒状、 颗粒较大、 紧密规整、 表面较光滑. 参与木质素转化后, 蒙脱石团粒状结构破损, 呈不规则多边形颗粒结构, 颗粒呈片层结构堆叠, 表面出现大量的细褶皱和纹理, 粗糙程度增加. 蒙脱石属于膨胀性矿物, 内部亲水[20], 在木质素培养液中充盈, 培养结束后结晶水收缩使层间结构被破坏.

图4 蒙脱石参与木质素腐殖化过程前后的SEM照片

图5 蒙脱石参与木质素腐殖化过程的FTIR光谱
图5为蒙脱石参与木质素腐殖化过程的FTIR光谱. 由图5可见, 在3 624 cm-1处的吸收峰归属于蒙脱石内层羟基基团的伸缩振动[15], 在3 421~3 431 cm-1处的吸收峰归属于蒙脱石表面水分子的对称伸缩振动(ν1型), 在1 630~1 641 cm-1处的吸收峰归属于蒙脱石表面水分子的弯曲振动(ν2型), 在1 038~1 041 cm-1处的吸收峰归属于Si—O的伸展振动, 在796 cm-1处的吸收峰由Mg—Al—OH的振动所致[16], 在519,467 cm-1处的吸收峰归属于Si—O—Si的弯曲振动[13], 分别与Fe—O—Si和Mg—O—Si键有关[16].
蒙脱石参与木质素腐殖化过程FTIR光谱主要吸附峰的相对强度列于表3. 由表3可见, 与M-10相比, M-30,M-60,M-110处理蒙脱石的表面羟基总量、 层间及晶格中结晶水含量均减少, Si—O晶格的伸缩振动、 Mg—Al—OH键以及表示Fe—O—Si键(或Mg—O—Si键)的弯曲振动频率均增加. 通常情况下, 蒙脱石对木质素等较难降解的疏水性有机成分有较强的表面吸附能力[15]. 此外, 微生物在转化木质素过程中可释放胞外聚合物[20], 与蒙脱石表面官能团形成氢键, 可降低羟基总量以及层间和晶格中结晶水, 并提高Si—O,Mg—Al—OH,Fe—O—Si键(或Mg—O—Si键)的振动频率. M-110-CK2处理下因木质素的添加也有上述规律, M-110-CK3处理下仅接种复合菌株, 无碳源基质, 菌株会失活形成菌体, 菌体表面羧基与蒙脱石表面水合基发生配位体交换[21], 增加表面OH-的伸缩振动[20], 对Si—O,M—Al—OH,Fe—O—Si键(或Mg—O—Si键)的影响较小. 因此, 微生物转化木质素过程释放胞外聚合物与蒙脱石表面形成氢键, 以及菌体与蒙脱石表面水合基发生配位体交换是蒙脱石参与木质素腐殖化过程的主要机制.

表3 蒙脱石参与木质素腐殖化过程FTIR光谱主要吸收峰的相对强度
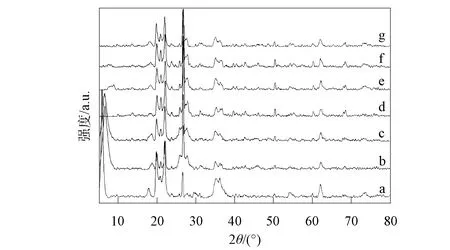
a. M-样品; b. M-110-CK3; c. M-110-CK2; d. M-110; e. M-60; f. M-30; g. M-10.
图6为蒙脱石参与木质素腐殖化过程的XRD谱, 蒙脱石参与木质素腐殖化过程XRD特征衍射峰的晶面间距列于表4. 由图6和表4可见: 蒙脱石原样品在2θ=5.9°,19.8°,22.0°,26.6°,36.1°处均出现了强衍射峰, 在M-110-CK2和M-110-CK3两种处理下, 因缺失微生物或木质素, 未发生腐殖化过程, 蒙脱石在2θ=6.5°~6.7°,19.9°,22.0°~22.1°,26.7°,36.2°处出现强衍射峰, 其中, 在2θ=6.2°附近为蒙脱石特征衍射峰, 在2θ=19.8°~19.9°,26.7°处归属于云母特征峰, 2θ=22.0°~22.1°处为钙长石衍射峰. 与原样品相比, M-110-CK2和M-110-CK3处理下的蒙脱石在低波处发生偏移. 蒙脱石在参与木质素转化后, 其在低波处(5.9°~6.7°)的衍射峰消失, 在2θ=18.1°处的衍射峰出现, 在19.9°~20.0°,22.1°~22.2°,26.8°,36.2°~36.6°处的衍射峰均被保留. 因此, 蒙脱石参与木质素转化后的结构发生了改变, 表明蒙脱石的特征衍射峰消失, 与SEM结果一致.
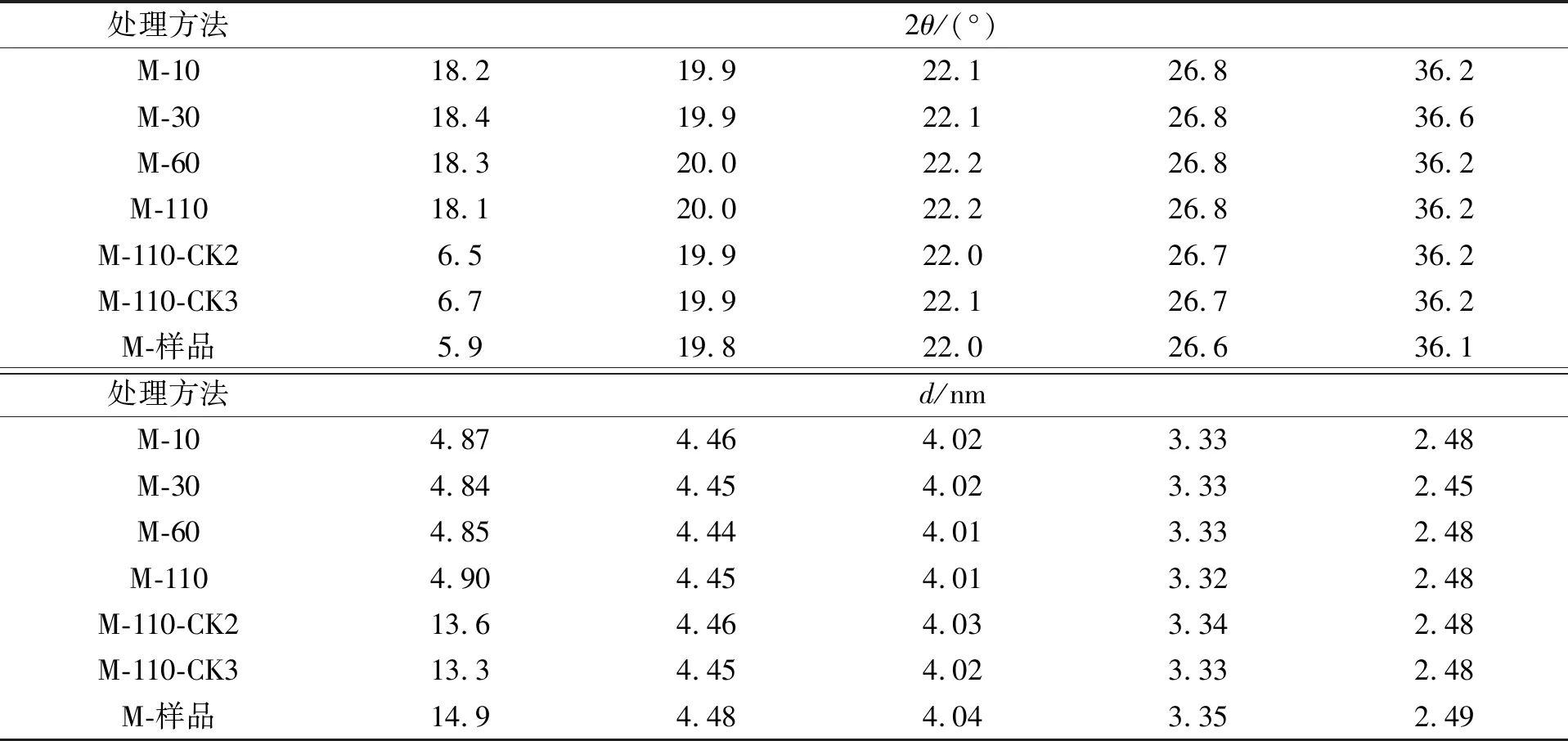
表4 蒙脱石参与木质素腐殖化过程XRD特征衍射峰的晶面间距
3 结 论
1) 高岭石参与木质素微生物转化后, 结构水失衡, 边缘断键使其表面集聚负电荷, 表面水化层多点形成氢键, 增加了缔合—OH的伸缩振动. Al—OH的边缘及基底八面体O发生脱羟作用, 使四面体片和八面体片变形并产生大量断键, 导致Si—O,Si—O—Al,Si—O—Si振动频率弱化, 晶体结构趋于长程无序化, 但未发生物相改变, 静电作用和氢键是其催化木质素腐殖化进程的主要机制.
2) 蒙脱石内部亲水, 参与木质素微生物转化后结晶水收缩使层间结构被破坏. 微生物释放的胞外聚合物与其表面官能团形成氢键, 使羟基总量及层间和晶格中的结晶水降低, 并提高了Si—O,Mg—Al—OH,Fe—O—Si键(或Mg—O—Si键)的振动频率, 蒙脱石在低波处(5.9°~6.7°)的特征衍射峰消失, 氢键和配位体交换是蒙脱石参与木质素腐殖化进程的催化机理.
