磺基水杨酸和精氨酸构筑的Cu(Ⅱ)配合物与DNA的相互作用
2020-03-25李小芳冯小强朱元成王彦博
李小芳, 冯小强, 朱元成, 王彦博
(天水师范学院 化学工程与技术学院, 甘肃 天水 741001)
通过调控中心金属离子和配体可合成结构多样的功能配合物. 金属配合物结构新颖、 性能优异[1-2], 在磁性、 荧光、 催化、 生物化学和生物制药等领域应用广泛. 由于配合物与脱氧核糖核酸(DNA)间的嵌插作用对抗癌、 防癌药物发挥药效影响较大[3], 因此, 研究DNA与配合物间的相互作用, 对定向设计及构筑新型抗癌药物有重要意义.
铜是机体必需的微量元素, 具有重要的生理作用[4], 铜配合物具有抗糖尿病、 抗诱变剂、 抗溃疡和抗癌作用: 莫慧雯等[5]合成了以 5-甲基-2-(2′-吡啶基)苯并咪唑为主配体的铜(Ⅱ)混配配合物[Cu(HPBM)(Gly)(H2O)]ClO4·0.5H2O(HPBM=5-甲基-2-(2′-吡啶基)苯并咪唑, Gly=甘氨酸根), 通过沟槽结合方式与DNA结合及线粒体功能失调途径诱导Eca-109细胞凋亡, 对癌细胞Eca-109,HeLa和A549具有显著的抑制作用(IC50<10 μmol/L), 配合物与DNA间存在较强的嵌插作用, 且强于配体间的相互作用[5]; Lü等[6]合成了配合物[Cu(L)Br]·DMF, [Cu(L)Cl]·2H2O和[Cu2(L)2(SO4)]·H2O·CH3OH(HL为3-乙基-2-乙酰吡嗪缩4-甲基氨基硫脲), 研究表明, 配合物与DNA强于配体间的相互作用; 严世承等[7]研究表明, 以4-甲基-1,2,3-噻二唑-5-甲酸与氯化铜合成的配合物[CuNa(L)3]n属于三斜晶系, Cu2+的配位数为4, 构成一个变形的平面四边形结构, Na+的配位数为6, 构成一个略变形的八面体结构, 最终形成三维网状结构; 何大青等[8]以5,6-二甲基-2,3-吡嗪二甲酰胺和芹菜素为配体合成了铜配合物, 研究表明, 当不加还原剂时, 配合物呈核酸酶的特性, 对DNA有明显的切割作用; 寇莹莹等[9]合成了单核铜配合物[Cu(L)(5-Cl-sal)(DMF)] ClO4·DMF(5-Cl-Hsal=5-氯-水杨醛), 配合物以嵌插作用与CT-DNA结合, 配合物在H2O2存在下可将pBR322质粒DNA切割为开环缺口型 DNA和线型DNA, 配合物浓度越大切割效果越好.
氨基酸作为一种重要的生理活性物质, 具有较好的生物兼容性及抗氧化和抗肿瘤等活性, 作为配体可提高配合物的生物活性并改善配合物在溶液中的溶解性, 从而提高其生物利用率, 降低其毒副作用[10]. 由于磺基水杨酸(5-sulfosalicylic acid, SSA)的水溶性较好、 稳定、 无毒, 对过渡金属和重金属离子具有较强的配合能力, 在医药中间体、 染料工业、 有机合成工业、 制造表面活性剂等领域应用广泛, 因此, 本文以精氨酸(L-Arg)和磺基水杨酸为配体制备Cu(Ⅱ)配合物Cu2(L-Arg)2(SSA)(H2O)2(L-Arg=精氨酸, SSA=磺基水杨酸), 并用电化学法、 光谱法和黏度法研究配合物与DNA间的相互作用.
1 实 验
1.1 药品和仪器
磺基水杨酸(天津市化学试剂二厂); 精氨酸(上海伯奥公司); 鲱鱼精DNA(美国Sigma公司), 用Tris-HCl/NaCl缓冲溶液配制, 配制后溶液的A260/A280=1.85, 表明溶液中基本不含蛋白质, 且浓度以ε260=6 600 L/(mol·cm)确定, 溶液置于4 ℃冰箱保存.
CHI660B型电化学工作站(上海辰华仪器有限公司); UV-2450型紫外可见光谱仪(日本岛津有限公司); Spectrum One型Fourier红外光谱仪(美国Perkin Elmere仪器有限公司).
1.2 配合物的制备
将0.5 mmol的CuCl2·2H2O和0.5 mmol的磺基水杨酸溶于20 mL体积分数为95%的乙醇中, 在50 ℃水浴加热搅拌下, 将已中和的0.5 mmol精氨酸水溶液加入上述溶液中, 调节溶液 pH=4.0~5.0, 继续加热搅拌30 min. 反应结束后, 将反应液冷却, 静置过夜, 过滤沉淀, 并用体积分数为95%的乙醇洗涤3次, 于60 ℃烘干保存, 得到Cu2(L-Arg)2(SSA)(H2O)2配合物.
1.3 配合物与DNA间的作用方式
用紫外吸收光谱法、 循环伏安法和黏度法研究配合物与DNA间的作用方式, 其实验方法参见文献[11-12].
2 结果与讨论
2.1 表 征
SSA,L-Arg和配合物的红外光谱数据列于表1. 由表1可见: 配体SSA在1 671 cm-1处出现羧羰基的特征峰, 在形成配合物后消失; 配合物在1 329,1 596 cm-1处出现羧酸根的对称和反对称吸收峰, 二者的峰位相差267 cm-1, 表明SSA中的羧基与Cu2+以单齿形式配位[13]; SSA在1 282 cm-1处的吸收峰归属于Ar—OH伸缩振动峰, 在形成配合物后未发生变化, 表明酚羟基中的氧原子未参与配位; 氨基酸配体L-Arg在908 cm-1处的吸收峰归属于O—H伸缩振动吸收峰, 在形成配合物后消失, 表明L-Arg中氧原子参与配位; 配合物在424,502 cm-1处出现新吸收峰, 可归属于Cu—O的吸收峰.
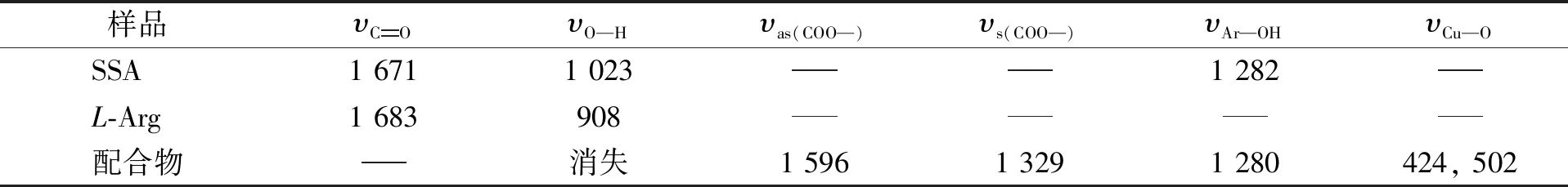
表1 SSA,L-Arg和配合物的红外光谱数据(cm-1)
以N,N-二甲基甲酰胺(DMF)为配合物的溶剂, SSA,L-Arg和配合物的紫外光谱如图1所示. 由图1可见: SSA的紫外光谱有两处吸收峰, 其中λmax1=256 nm处归属于π-π*跃迁,λmax2=317 nm处归属于n-π*跃迁;L-Arg在225 nm处的吸收峰归属于π-π*跃迁; 当SSA,L-Arg和Cu2+发生配位后, 在257,301 nm处出现两个吸收峰谱带, 其中配合物在257 nm处谱带相对于配体的峰位均发生了移动, 且吸光强度增大, 表明配合物的共面性及π键共轭程度增大, 体系能量降低, 配合物在301 nm处谱带相对于SSA的λmax2发生蓝移, 但吸光强度减小, 表明形成配合物后, 以配体的π-π*跃迁为主[14].
测定浓度为1×10-3mol/L配合物溶液在25 ℃时的摩尔电导率为10.8(s·cm2)/mol, 确定配合物在DMF中以中性分子存在[15]. 用乙二胺四乙酸(EDTA)滴定法测定Cu2+的浓度, 并结合元素分析、 红外光谱和紫外光谱数据确定配合物的分子式为Cu2(L-Arg)2(SSA)(H2O)2(L-Arg=精氨酸, SSA=磺基水杨酸), 其结构示意图如图2所示.

图1 SSA,L-Arg和配合物的紫外光谱

图2 配合物的分子结构示意图
2.2 配合物与鲱鱼精DNA的相互作用

a~h: 描速率分别为0.1,0.2,0.4,0.5,0.7,0.8,0.9,1.0 V/s.
2.2.1 电化学法 不同扫描速率下配合物的循环伏安曲线及Ip和υ1/2的变化关系如图3所示. 由图3(A)可见: 当扫描速率为0.1 V/s时, 配合物在0.124 8,-0.518 9 V处出现一对明显的氧化还原峰, 式量电位为-0.197 1 V, 峰电位差ΔEp=0.643 7 V, 氧化还原峰的峰电流分别为2.677 8×10-5,-3.122×10-5A; 配合物的氧化还原峰电位随扫描速率变化而变化, 峰电流随扫描速率的增大而逐渐增大, 当扫描速率为1.0 V/s时, 还原峰和氧化峰的峰位分别移至-0.751,0.239 V处, 对应的峰电流分别增大至7.648×10-5,-1.514×10-4A. 由图3(B)可见,Ip和υ1/2呈良好的线性关系, 其线性方程为
Ipa(10-5A)=0.35 +7.29υ1/2,R=0.993 6;
Ipc(10-5A)=-1.34-14.32υ1/2,R=0.990 3.
表明配合物在玻碳电极上的反应由扩散过程控制.
DNA加入前后配合物的循环伏安曲线如图4所示. 由图4可见: 当扫描速率为1.0 V/s时, 配合物在0.125,-0.603 V处出现一对明显的氧化还原峰, 式量电位为-0.239 V; 当DNA和配合物的浓度比为0.5时, 配合物氧化还原峰的峰位分别位于0.151,-0.501 V处, 式量电位为-0.175 V, 即配合物的式量电位较加入DNA前正移了64 mV. 若配合物与DNA间存在嵌插作用, 则配合物的式量电位发生正移[16]. 因此, 根据DNA加入前后配合物的循环伏安曲线可知, 配合物与DNA以嵌插作用结合.
为进一步验证循环伏安法的结论, 用差分脉冲伏安法研究配合物与鲱鱼精DNA间的作用方式, 结果如图5所示. 由图5可见: 配合物在0.034 V处的峰电流为-6.3×10-6A, 当R(c(DNA)/c(配合物))=1.0时, 峰电流降至-2.95×10-6A, 峰电位正移至0.12 V处; 在配合物中滴加DNA后, 配合物的峰电流降低, 峰电位逐渐正移, 与循环伏安法所得结论一致, 且峰电流降低程度及峰电位正移趋势与DNA加入呈正相关.

a: DNA加入前; b: DNA加入后.

a~e: R=0,1/5,1/3,1/2,1.
2.2.2 紫外吸收光谱 先在空白池和样品池中分别加入3 mL Tris-HCl/NaCl缓冲溶液和50 μmol/L配合物溶液, 在波长为200~350 nm内扫描吸收光谱, 再依次向空白池和样品池中分别加入不同体积的2 mmol/L DNA溶液, 静置5 min后扫描紫外吸收光谱, 结果如图6所示. 由图6可见, 配合物的紫外吸收光谱在滴加DNA后变化较大, 当配合物中滴加140 μL DNA后, 在257 nm处的吸收峰位移至248 nm处, 强度降低58.6%, 在301 nm处的吸收峰未发生移动, 但吸收强度降低36%. 若小分子与DNA间存在嵌插作用, 则小分子的吸收峰峰位发生红移, 吸收强度降低[17]. 因此, 根据DNA加入后配合物的紫外吸收光谱可知, 配合物与DNA间存在相互作用.

a~h: 加入DNA的体积分别为0,20,40,60,80,100,120,140 μL.

图7 配合物浓度对DNA黏度的影响
2.2.3 黏度法 配合物浓度对DNA黏度的影响如图7所示. 由图7可见, DNA溶液的黏度随配合物浓度的增大而增大. 这是由于配合物嵌插到DNA分子内部, 使DNA分子链不断增长, 导致DNA的黏度增大所致, 与文献[18]结果相符.
综上所述, 本文首先合成并表征了配合物Cu2(L-Arg)2(SSA)(H2O)2(L-Arg=精氨酸, SSA=磺基水杨酸), 然后研究了该配合物与鲱鱼精DNA间的相互作用. 实验结果表明: 当扫描速率为0.1 V/s时, 配合物在0.124 8,-0.518 9 V处出现一对明显的氧化还原峰, 式量电位为-0.197 1 V, 配合物在玻碳电极上的反应由扩散过程控制; 在加入DNA后, 配合物的氧化还原峰电流逐渐降低, 式量电位呈增大趋势, 配合物的吸收峰峰位发生位移, 吸收强度下降; DNA的黏度随配合物浓度的增大而增大. 因此, 配合物Cu2(L-Arg)2(SSA)(H2O)2与鲱鱼精DNA间存在嵌插作用.
