白虫草多糖的提取及其抗炎功能
2020-03-25吕偲丞
吕偲丞, 孙 尧, 高 冷
(长春工业大学 化学与生命科学学院, 长春 130012)
白虫草(CordycepsmilitarisLink)是一种新型植物, 是长白山区进行蛹虫草繁育过程中在培育床边自然衍生的一种植物, 具有完全的植物生长性质, 它与蛹虫草的生长周期、 生长环境一致, 目前已成功进行人工驯化养殖. 研究表明, 白虫草与蛹虫草的功效相近, 具有抗氧化、 抗肿瘤、 抗衰老、 降血脂、 提高免疫力等功效[1]. 由于白虫草具有完全植物性, 可大规模养殖, 生产成本低, 具有极高的应用价值, 因此白虫草可作为冬虫夏草和蛹虫草的替代品.
蛹虫草多糖具有多种药理作用, 如抗氧化、 免疫调节、 降血糖、 消炎和抗癌等[2]. 由于多糖分子量较大且结构复杂, 因此对其结构表征难度较大, 目前多采用色谱和光谱等方法获得多糖的分子量、 单糖组成及三级结构等信息, 但过程复杂[3]. 分析多糖中单糖组成的方法较多, 其中水解法使多糖中单糖相互间连接的糖苷键断裂, 释放出单糖, 再用色谱法对单糖进行定性定量分析. 常用的水解方法有硫酸水解法、 盐酸水解法和三氟乙酸水解法等[4]. 本文用超声水提法提取白虫草多糖. 以单因素实验为基础, 分析各提取因素对白虫草多糖得率的影响, 再用响应面法优化各研究因素间的交互作用, 最终确定白虫草多糖的最佳提取工艺参数[5]. 通过高效液相色谱(HPLC)法对白虫草多糖的成分进行检测, 鉴定其主要单糖组成[6], 并用RAW264.7体外细胞抗炎模型对白虫草多糖的抗炎效果进行检测[7].
1 实 验
1.1 材料和仪器
白虫草产自吉林省白山市板石岭长白山山脉; RAW246.7细胞由长春工业大学生物工程实验室提供. 紫外分光光度计(北京普析通用仪器有限公司); HPLC仪(美国沃特世公司); 超声提取装置(宁波新芝生物科技股份有限公司); 酶标仪(济南鑫贝西生物技术有限公司); 细胞抗炎试剂盒(武汉默沙克生物).
1.2 白虫草多糖的提取
称取50 g白虫草超微粉末置于烧杯中, 加蒸馏水500 mL, 搅拌均匀, 以20 ℃, 1 000 W超声3.0 h. 超声结束后先用纱布粗滤, 再离心, 将上清液浓缩至200 mL, 于4 ℃冷藏. 取浓缩后的上清液加入无水乙醇搅拌至溶液总体积为1 L, 即乙醇的体积分数为80%, 静置24 h. 将醇沉后的沉淀收集、 干燥, 得到白虫草多糖. 分别对提取温度、 超声波功率、 提取时间和料液比(m(料)∶V(液))进行单因素实验, 每个因素分3组进行平行实验, 通过响应面法确定最佳提取工艺, 其中
提取率=[粗多糖质量(g)/原料质量(g)]×100%.
1.3 白虫草多糖的分离纯化
将200 g白虫草多糖超声溶解于蒸馏水中, 搅拌均匀后样品于500 r/min离心10 min, 除去不溶物, 取上清液加样到DEAE Sepharose色谱柱(20 mm×300 mm)中, 用蒸馏水及0.05,0.1,0.2 mol/L的NaCl溶液分别洗脱240 min, 收集洗脱液(每管5 mL, 1 mL/min), 用苯酚-硫酸比色法在490 nm处测定洗脱液A值(OD值), 绘制洗脱时间与A的关系曲线. 收集单一对称峰, 透析除去NaCl, 浓缩后进行冷冻干燥. 重复上述分离操作以得到足够的多糖样品.
1.4 白虫草中多糖的质量分数测定
用苯酚-硫酸比色法测定样品中总糖的质量分数, 以葡萄糖标准品为对照品, 绘制葡萄糖的质量浓度ρ(mg/mL)与吸光度(A)间的标准曲线, 测定白虫草多糖中总糖的质量分数[8]. 用咔唑-硫酸比色法测定多糖糖醛酸的质量分数, 以葡萄糖糖醛酸为对照品, 绘制标准曲线, 测定白虫草多糖中糖醛酸的质量分数[9]. 用考马斯亮蓝染色法测定蛋白质的质量分数, 以牛血清白蛋白为标准对照品, 绘制标准曲线, 测定白虫草多糖中蛋白质的质量分数[10].
1.5 白虫草多糖中单糖组成分析
将分离得到的多糖样品称量10 mg置于反应釜中, 加入H2SO4(2 mol/L, 2 mL)溶液使样品完全溶解, 通入氮气, 于95 ℃烘箱中密封水解8 h, 将反应釜冷却至室温, 向水解液中加入NaOH(6 mol/L)溶液至样品呈中性, 用蒸馏水定容至2 mL, 分别吸取上述样品500 μL, 加入NaOH(0.5 mol/L, 200 μL)溶液和PMP(1-苯基-3-甲基-5-吡唑酮)的甲醇溶液(0.5 mol/L, 200 μL)中, 完全溶解后通入氮气, 于70 ℃密封水浴加热30 min. 先加入约150 μL HCl(0.5 mol/L)使样品呈中性, 再加入1 mL氯仿反复萃取3~5次, 取水溶液过0.45 μm水系滤膜, 进行HPLC分析, 选取肌醇为内标.
分别称取单糖标准品10 mg, 制成5 mg/mL的标准品水溶液, 分别取上述标准品溶液200 μL, 按样品的单糖衍生化操作进行HPLC分析. HPLC条件: 色谱柱为C18, 流动相A为φ(甲酸)=0.1%+去离子水, 流动相B为乙腈; 测定波长为200~400 nm; 流速为0.4 mL/min; 柱温为45 ℃; 进样量为10 μL. 梯度洗脱程序为: 0~20 min(φ(B)=0~14%), 21~40 min(φ(B)=14%~25%), 41~45 min (φ(B)=25%~60%), 46~75 min(φ(B)=60%~100%), 76~80 min(φ(A)=100%).
1.6 建立RAW264.7细胞抗炎模型
取对数生长期的RAW264.7细胞于96孔板中, 每孔105个细胞. 加入含有质量分数为10%血清的DMEM(dulbecco’s modified eagle medium)培养液中培养, 每孔体系100 μL, 培养4 h, 实验设置空白对照组(不加LPS(脂多糖)和样品)、 LPS组(终质量浓度为10 μg/mL)、 LPS+给药组(终质量浓度分别20,15,10,5,1 mg/mL)、 LPS+阳性对照组(加罗非昔布, 终质量浓度分别为20,15,10,5,1 mg/mL), 每组3个复孔. 用PGE2试剂盒对体外细胞RAW264.7分泌PGE2的质量浓度进行计算、 比较和分析, 并研究白虫草多糖的抗炎效果[11].
1.7 噻唑蓝(MTT)法检测白虫草多糖对细胞活力的影响
取对数生长期的RAW264.7细胞配置细胞悬液, 接种于96孔板, 每孔含100 μL细胞悬液, 置于培养箱培养; 当细胞完全粘连贴壁后加入等体积不同质量浓度样品, 使各样品终质量浓度分别为50,10,5,2,1 mg/mL, 以DMEM培养基为空白组, L-NMMA(广谱性一氧化氮合酶抑制剂)为阳性对照, 经培养箱培养24 h后, 每孔加入5 mg/mL的MTT溶液15 μL, 继续培养4 h后舍弃上清液, 再向每孔加入DMSO(二甲基亚砜)150 μL, 转移至酶标仪中振荡10 min, 使结晶物充分溶解, 测定490 nm处的吸光度(A), 计算细胞存活率: 细胞存活率=(A(给药组)/A(空白对照组))×100%.
2 结果与讨论
2.1 不同提取条件对白虫草多糖提取率的影响

图1 不同因素对白虫草多糖提取率的影响
用超声波辅助提取白虫草多糖, 影响提取率的主要因素有提取温度、 超声波功率和提取时间. 图1为不同因素对白虫草多糖提取率的影响. 由图1(A)可见: 当超声波功率为1 000 W, 提取时间为3 h时, 提取率在50 ℃达最大值, 这是因为温度升高, 细胞壁渗透性增强所致; 当提取温度大于50 ℃时, 随着温度的升高, 提取率下降, 可能是因为温度过高使多糖发生降解所致. 由图1(B)可见: 当提取时间为3 h, 提取温度为20 ℃时, 随着超声波功率的增加, 提取率升高, 表明超声波在提取液中产生的机械作用和空化效应可使细胞壁破碎, 促进多糖溶出; 再增加超声波功率, 提取率的升高不明显. 由图1(C)可见, 当超声波功率为1 000 W, 提取温度为50 ℃时, 随着提取时间的延长, 提取率增加, 这是因为超声波使细胞破碎, 促进内溶物溶出所致. 由图1(D)可见, 随着溶剂比例的增加, 提取率增加, 但当料液比超过1∶30时, 提取率趋于平稳, 因此选择1∶30的料液比为最佳反应条件.
2.2 白虫草多糖提取率的响应面实验结果
根据单因素实验结果, 各因素交互作用的三维响应面如图2所示. 通过Design-Expert 8.0.6软件分析, 确定最佳提取工艺为提取温度67.5 ℃, 超声波功率1 817.53 W, 提取时间2.64 h, 提取量15.97 g. 考虑实验设施的可操作性, 对该提取工艺修正为提取温度65 ℃, 超声功率1 800 W, 提取时间3 h. 对该工艺参数进行验证得到的提取率为31.56%, 与预测值接近, 即该响应面模型正确.

图2 各因素交互作用的三维响应面
2.3 白虫草多糖的分离纯化结果
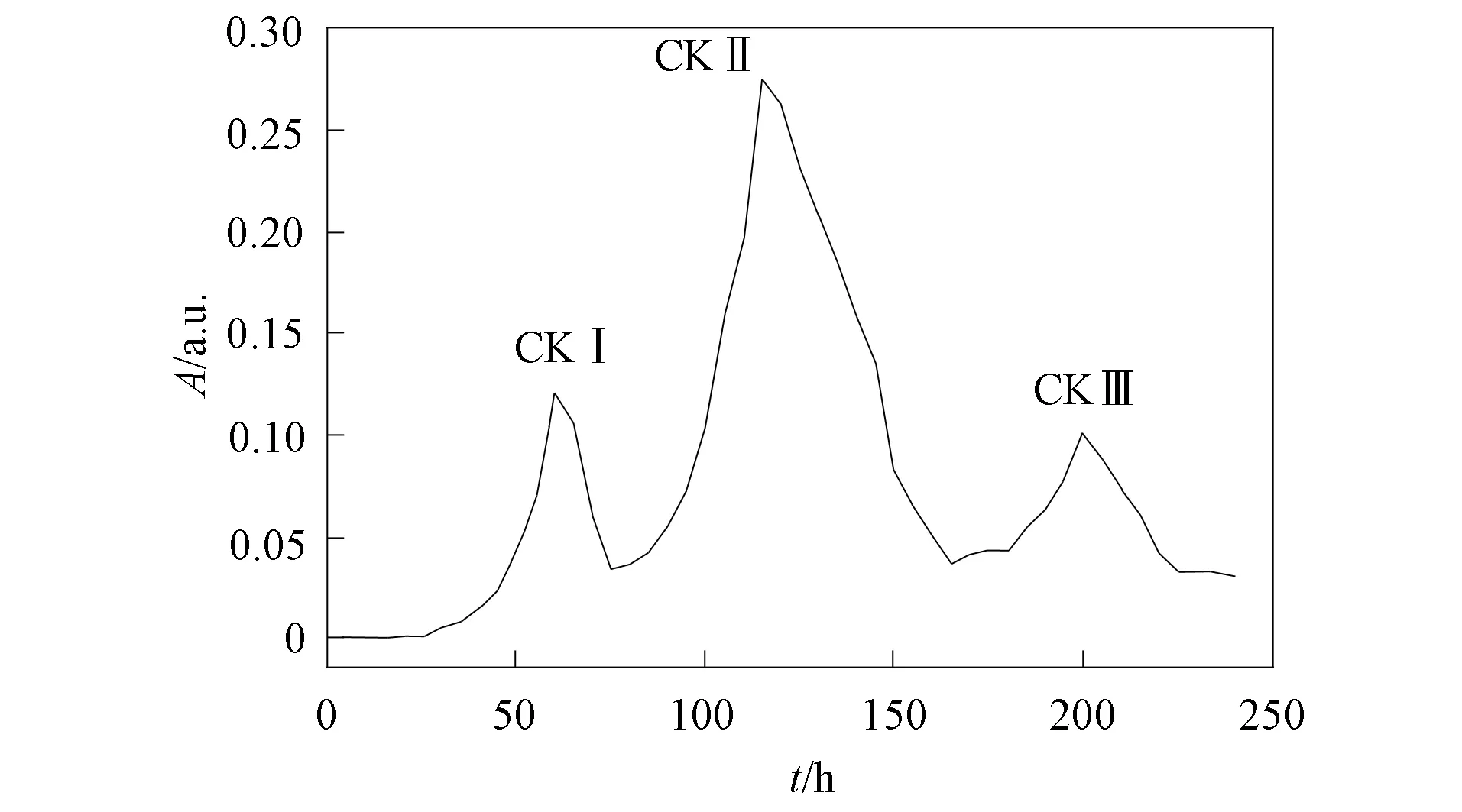
图3 白虫草多糖的洗脱曲线
白虫草多糖经DEAE Sepharose色谱柱分离, 分别以蒸馏水和0.05,0.1,0.2 mol/L NaCl洗脱, 在水洗和0.05 mol/L NaCl洗脱后得到3个明显主峰, 洗脱曲线如图3所示, 分别将其命名为CKⅠ,CKⅡ,CKⅢ. 由图3可见, CKⅡ峰值最高, 因此用其进行多糖质量分数的分析与检测, 通过苯酚-硫酸比色法测定样品中总糖的质量分数, 以葡萄糖为标准品, 绘制葡萄糖标准曲线, 用紫外分光光度计测定吸光度, 测定其总糖的质量分数为86.51%; 以葡萄糖糖醛酸为标准品, 用咔唑-硫酸比色法测定多糖醛酸的质量分数, 绘制标准曲线, 通过吸光度测定其糖醛酸的质量分数为7.36%; 以牛血清蛋白为标准品, 用考马斯亮蓝染色法测定蛋白质的质量分数, 对其染色后绘制标准曲线, 通过吸光度测定其蛋白质的质量分数为0.01%.
2.4 白虫草多糖的单糖组成分析结果
白虫草多糖CKⅡ先用2 mol/L的H2SO4水解成单糖, 再经PMP衍生氯仿萃取后, 样品直接进入HPLC进行分析, 与标准单糖PMP衍生萃取后的保留时间进行对比, 结果如图4所示, 其单糖组成与摩尔分数列于表1. 由表1可见, CKⅡ主要由Ara,Gal,Xyl,Man,Glc和Rha组成, 其中Glc摩尔分数最高, 其次为Xyl. Glc作为新陈代谢的中间产物, 是生物的主要供能物质及活细胞的能量来源. Xyl为无热量甜味剂, 对双歧杆菌具有增值作用, 可改善人体肠道内的微生物环境, 并可制备木糖醇.

1. Ara; 2. Gal; 3. Xyl; 4. Man; 5. Glc; 6. Rha.

表1 白虫草单糖组成与摩尔分数
2.5 MTT及抗炎实验结果分析
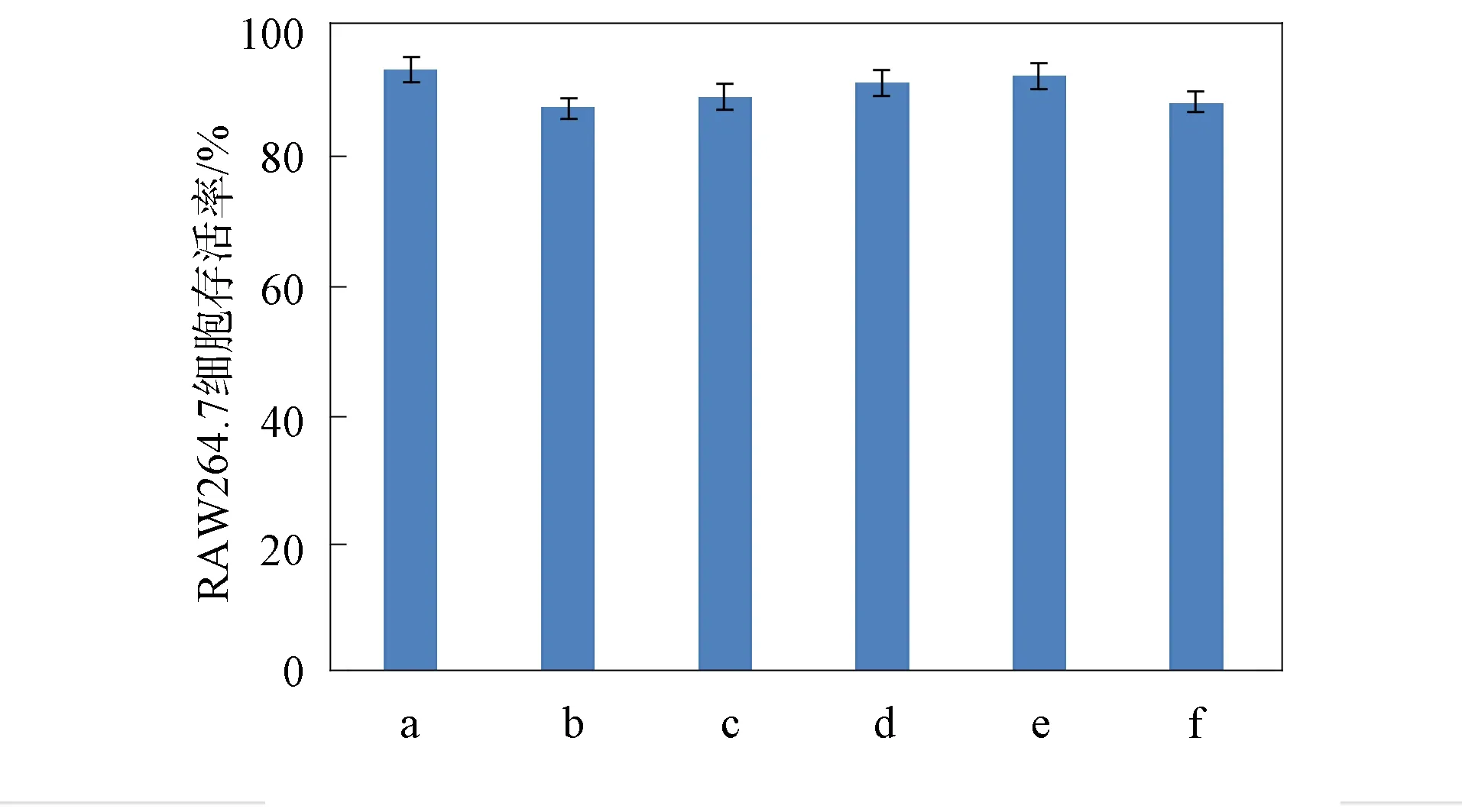
a: 空白对照; b~f: ρ(白虫草多糖)=1,5,10,15,20 mg/mL.

与阴性对照比较; a: 阴性对照;b: 罗非昔布; c~g: ρ (白虫草多糖)=1,5,10,15,20 mg/mL.
白虫草多糖对RAW264.7细胞活力的影响如图5所示. 由图5可见, 当样品质量浓度为20 mg/mL时, 细胞存活率仍大于90%, 表明样品对细胞无毒害作用. 用RAW264.7细胞生成的PGE2质量浓度分析样品白虫草多糖的抗炎效果,并将其与罗非昔布抗炎效果进行对比, 结果如图6所示. 由图6可见: 当白虫草多糖以RAW264.7细胞为实验模型, 样品质量浓度分别为1,5,10,15,20 mg/mL时, PGE2分泌量均低于阴性对照, 表明白虫草多糖具有抗炎效果; 当样品质量浓度为15 mg/mL时, 与罗非昔布抗炎效果相似, 其抗炎效果较好, 与阴性对照组比较p<0.01, 有显著意义.
综上所述, 本文用超声波辅助提取法提取白虫草多糖, 通过响应面法确定了最佳提取工艺, 当提取温度为65 ℃, 超声波功率为1 800 W, 提取时间3.0 h时, 提取率为31.56%. 用苯酚-硫酸比色法、 咔唑-硫酸比色法及考马斯亮蓝染色法分别测定白虫草多糖总糖、 糖醛酸和蛋白质的质量分数为86.51%,7.36%,0.01%. 通过HPLC法测定单糖的组成, 其主要成分为Ara,Gal,Xyl,Man,Glc和Rha, 其摩尔分数分别为8.35%,23.18%,24.63%,8.85%,26.32%,8.67%. 通过测定RAW264.7细胞生成PGE2的质量浓度可见, 白虫草多糖具有抗炎效果.
