番红砗磲外套膜颜色多态性及其与生长性状相关性研究*
2020-03-25何园园刘二田顾志峰石耀华王爱民刘春胜
何园园 刘二田 顾志峰 石耀华 王爱民,2 刘春胜
番红砗磲外套膜颜色多态性及其与生长性状相关性研究*
何园园1#刘二田1#顾志峰1石耀华1王爱民1,2刘春胜1①
(1. 海南大学海洋学院 海口 570228;2. 海南大学 南海海洋资源利用国家重点实验室 海口 570228)
本研究以南海西沙海域番红砗磲()为实验对象,通过CSE-1成像色度检测分析系统和聚类分析方法研究其外套膜颜色多态性,同时,比较外套膜颜色与形态性状的相关性。结果显示,大部分番红砗磲外套膜颜色分布在蓝原色和红原色区域,少部分个体分布在绿原色区域,且偏亮绿色;番红砗磲外套膜颜色共聚为6个颜色类群,各类群间颜色色差均>15,其中,第4类深蓝色和第6类黄色色差最大,为74.68;第3类浅蓝色和第4类深蓝色色差最小,为18.98;番红砗磲外套膜颜色、、值与壳高呈显著正相关(<0.05),相关系数分别为0.2080、0.2210和0.2375。本研究结果可为砗磲资源保护和珊瑚礁生态系统恢复提供参考。
番红砗磲;外套膜颜色;多态性;相关性
砗磲(sp.),包括砗磲属()和砗蚝属()2个属,已报道的有13种,分布于西太平洋到印度洋非洲东海岸的热带海域(Richter, 2008; Huelsken, 2013; Penny, 2014; Su, 2014; Borsa, 2015)。我国南海海域是砗磲分布海域之一,常见的有6种(董杨等, 2015)。砗磲是珊瑚礁生态系统的重要组成生物,它不但可为其他生物提供栖息地,而且是鱼类和腹足类的重要食物来源 (李元超, 2015; Mingoa-Licuanan, 2002; Ling, 2008)。与其他双壳贝类相比,砗磲具鲜艳醒目的外套膜和共生虫黄藻(Zooxanthellae) (Todd, 2009; Lucas, 2014; 张跃环等, 2016; 刘春胜等, 2018)。Todd等(2009)研究表明,外套膜在砗磲隐态保护和调控虫黄藻光合作用方面具有重要作用。
番红砗磲()主要分布在水深为0.5~3.5 m的珊瑚礁海区,是外套膜颜色最为鲜艳复杂的种类之一(Yasin, 2000; Todd, 2009)。如马来西亚刁曼岛番红砗磲群体外套膜颜色可分为蓝色、蓝色轮廓、绿色或浅棕色、深棕色或黑色、绿色/棕色图案、深棕色图案、白色/浅色图案、复杂图案共 8类(Todd, 2009)。生物体色的多态性对于生活在高度复杂环境中的物种至关重要,当其体色与背景颜色相似时,很难被敌害生物发现(Endler, 1978、1984; Merilaita, 2001、2005; Merilaita, 2003; Cuthill, 2005; Todd, 2004、2006)。Ozog(2009)在对长砗磲外套膜与栖息环境颜色比较发现,二者之间存在显著相关性,当外套膜颜色与栖息环境颜色不匹配时,被捕食的几率显著提高。研究发现,南海番红砗磲群体外套膜颜色与现有报道有所不同。本研究以南海海域番红砗磲为实验对象,研究其外套膜颜色多态性及其与生长性状的相关性,以期探讨砗磲外套膜颜色的区域差异性,为砗磲资源保护和珊瑚礁生态系统恢复提供参考。
1 材料与方法
1.1 实验材料
实验所用番红砗磲采自南海西沙海域(112°12¢~ 112°19¢N,16°57¢~16°59¢E)。实验前,先将番红砗磲放入循环水养殖池中暂养7 d,挑选无损伤活力好的个体(=190)作为研究对象。先将所有砗磲外壳表面的附着物用刷子仔细清洗干净,并贴上防水标签予以区分,而后用肉眼将番红砗磲按外套膜颜色初步分为黄棕色、暗红色、蓝色、绿色、黄色和杂色6组(图1),并分别命名为A组、B组、C组、D组、E组和F组。由于F杂色组(=27)颜色数据复杂不易采集,因此,本研究暂不对其进行分析。实验期间,番红砗磲暂养经砂滤沉淀的新鲜天然海水中,pH为7.8~8.2,盐度为32~34,水温为23℃~24℃。
1.2 形态数据测量
将所有实验番红砗磲个体使用游标卡尺测量壳高、壳长和壳宽。
1.3 番红砗磲外套膜颜色测量
图片收集:将砗磲按照编号顺序依次放置于实验室自主研发的砗磲外套膜图像采集装置中,待砗磲外套膜完全舒展后拍照,每个砗磲拍照3次,选取最佳的图片进行后续分析。砗磲外套膜图像采集装置中,光源为全光谱卤素灯,光照强度为8000 lx,光线与水平面呈30°,相机型号为佳能EOS6D (日本)。
拍照参数:快门速度()为1/15,光圈大小()为5.0,感光度(ISO)为200,放大倍数3倍。
外套膜颜色数据获取:采用Photoshop软件截取待测番红砗磲外套膜图片,而后将待测量图片导入CSE-1成像色度检测分析系统,随机选取5个点,获得其、、值和、、值(其中,为明度,数值介于0~100之间;为颜色的红绿特征,+a为红色,-a为绿色;b为黄蓝色特征,+b为黄色,-b为蓝色;、、分别指红、绿、蓝三原色值,表示颜色的光色度特性)。计算这6个点、、和、、值的平均值,分别作为该砗磲的外套膜颜色参数和三刺激值,同时,根据三刺激值、、计算色度坐标和。
不同颜色群体间色差D公式:
DE=[(D)2+(D)2+(D)2]1/2
明度差:D=1-2;
色度差:=1-2;D=1-2;
式中,1、1和1是1个颜色群体外套膜颜色各参数平均值,2、2和2是另1个颜色群体外套膜颜色各参数平均值。
1.4 数据统计分析
实验结果采用平均值±标准差(Means±SD)表示。实验数据采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),若组间存在显著差异,再进行Turkey多重比较,差异显著水平为<0.05。对壳高、壳长、壳宽与、、之间的相关性进行偏相关分析,差异显著水平为<0.05。
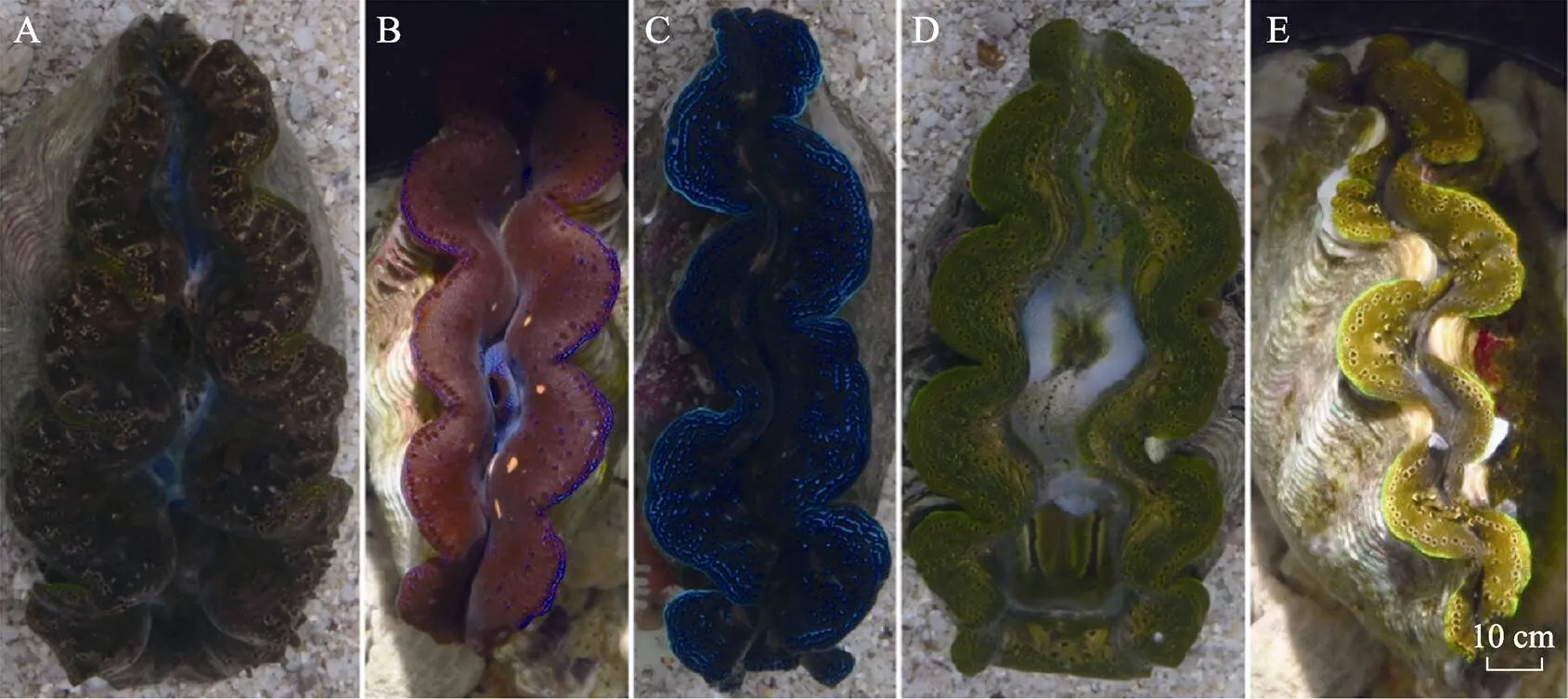
图1 不同外套膜颜色的番红砗磲
enter">A: 黄棕色; B: 暗红色; C: 蓝色; D: 绿色; E: 黄色
A: Yellow brown; B: Dark red; C: Blue; D: Green; E: Yellow
应用SPSS 19.0软件对番红砗磲做系统聚类分析,聚类方法为Ward法,计算明氏平均距离,观测位统一进行z得分标准化。
2 结果
2.1 番红砗磲外套膜颜色色度分布
经CSE-1成像色度检测分析系统测量得到5组番红砗磲外套膜颜色参数、、(表1)。明度()在17.87~ 45.37之间,其中,D组值最大,为45.37;C组值最小,为17.87,与其他各组的值差异显著(<0.05)。值在-23.89~7.50之间,D组值最小,为-23.89,显著低于其他各组(<0.05);A组与C组和E组值差异不显著;B、D、E组间值差异显著(<0.05)。值在-24.60~30.66之间,A组值最小,为-24.60,显著低于其他各组(<0.05);A组、C组和E组间值差异显著(<0.05)。A组色品为红色(+)和黄色(+),B组色品为红色(+)和黄色(+),C组色品为红色(+)和蓝色(-),D组色品为绿色(-)和黄色(+b),E组色品为绿色(-)和黄色(+)。该结果与肉眼直接观察的各组外套膜颜色相符(图1)。
图2是所有实验番红砗磲在CIE1931色度图上的分布。从图2可以看出,色度图中轴色度坐标相当于红原色的比例,轴色度坐标相当于绿原色的比例。结果显示,各组番红砗磲外套膜颜色的三刺激值、、集中在色度图上=0.3~0.35和= 0.3~0.35区间。其中,大部分在蓝原色和红原色区域,少部分D组和E组个体分布在绿原色区域,偏向亮绿色。
2.2 聚类分析及色差计算
从图3可以看出,对所有番红砗磲外套膜颜色聚类分析显示,共聚为6大类群。各类番红砗磲外套膜颜色分别为:第1类为褐色;第2类为红棕色;第3类为淡蓝色;第4类为深蓝色;第5类为绿色;第6类为黄色。
表1 各组番红砗磲外套膜颜色参数(、、)
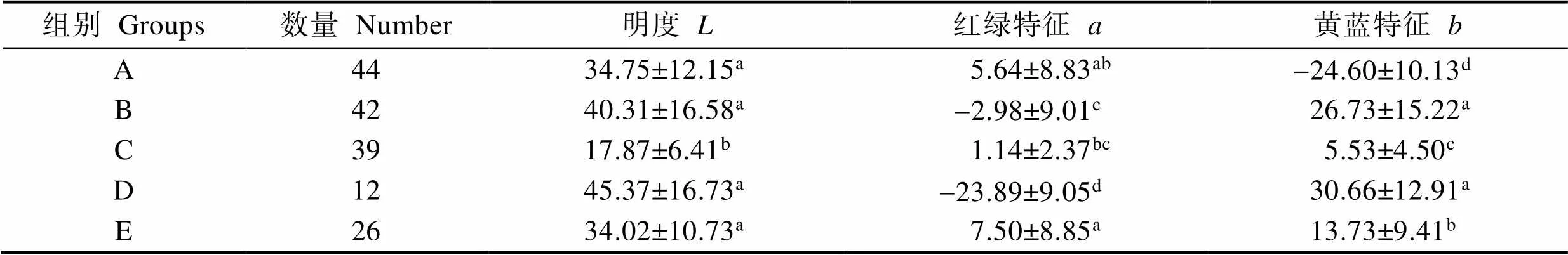
Tab.1 Colour parameters (L, a, and b) of T. crocea mantlein each group
注:同一列上标字母相同表示差异不显著(>0.05),不同字母表示存在显著性差异(<0.05),下同
Note: The same letter in same column are of no significant difference (>0.05), those with different letters are of significant difference (<0.05), the same as below

图2 番红砗磲外套膜颜色色度分布

图3 番红砗磲外套膜颜色系统聚类
聚类后各颜色番红砗磲颜色特征(、、)结果显示(表2),第1类外套膜颜色的值最低,为16.81,显著低于其他各类外套膜颜色的值(<0.05)。第6类外套膜颜色的值最大,为53.85,显著高于其他各类外套膜颜色的值(<0.05)。第2类和第4类外套膜颜色的值无显著差异;第1类和第3类外套膜颜色的值无显著差异(>0.05)。第2、4、5、6类外套膜颜色的值差异显著(<0.05);第3类和第4类外套膜颜色的值无显著差异(>0.05)。第1、2、5、6类外套膜颜色的值差异显著(<0.05)。同时,由聚类结果可知,第1类褐色番红砗磲数目最多,为50,占群体的30.67%;第2类红棕色个体为43,占26.38%;第6类黄色个体为27,占16.56%;第3类浅蓝色个体共17,占总体的10.43%;第4类深蓝色个体共15,占总体的9.20%;第5类绿色个体为11,占总体的6.75%。
6类番红砗磲外套膜颜色间色差见表3。从表3可以看出,各类间的色差均>15,表明6类之间的颜色用肉眼可以区分。其中,第4类和第6类色差最大,为74.68;第3类和第4类色差最小,为18.98;第1类和第2类之间的色差为19.86,仅大于第3类和第4类之间的色差。
2.3 壳长、壳宽和壳高与外套膜颜色的相关性
对番红砗磲的壳长、壳宽、壳高与、、值进行偏相关分析见表4。从表4可以看出,壳长、壳宽与、、均无显著相关性(>0.05)。与之相比,壳高与值呈显著正相关(=0.2080,=0.0190<0.05);壳高与值呈显著正相关(=0.2210,=0.0125<0.05);壳高与值呈极显著正相关(=0.2375,=0.0072< 0.01)。
对不同壳高的番红砗磲各颜色比例进行了统计,从图4可以看出,壳高为30~40 mm的番红砗磲外套膜主要为褐色和淡蓝色,随着砗磲个体生长,褐色和淡蓝色个体所占比例逐渐降低;小个体番红砗磲中(壳高为30~60 mm)未发现深蓝色外套膜个体,壳高为60~70 mm的深蓝色外套膜个体为5.88%,壳高为70~ 90 mm的番红砗磲群体中,深蓝色占50%以上;绿色番红砗磲仅在壳高为40~60 mm群体中有少量出现;红棕色番红砗磲在壳高为40~90 mm群体中占23.33%~ 47.06%;黄色个体在40~80 mm及<90 mm群体中有少量分布。
表2 聚类各颜色番红砗磲组形态及、、特征(平均值±标准差)
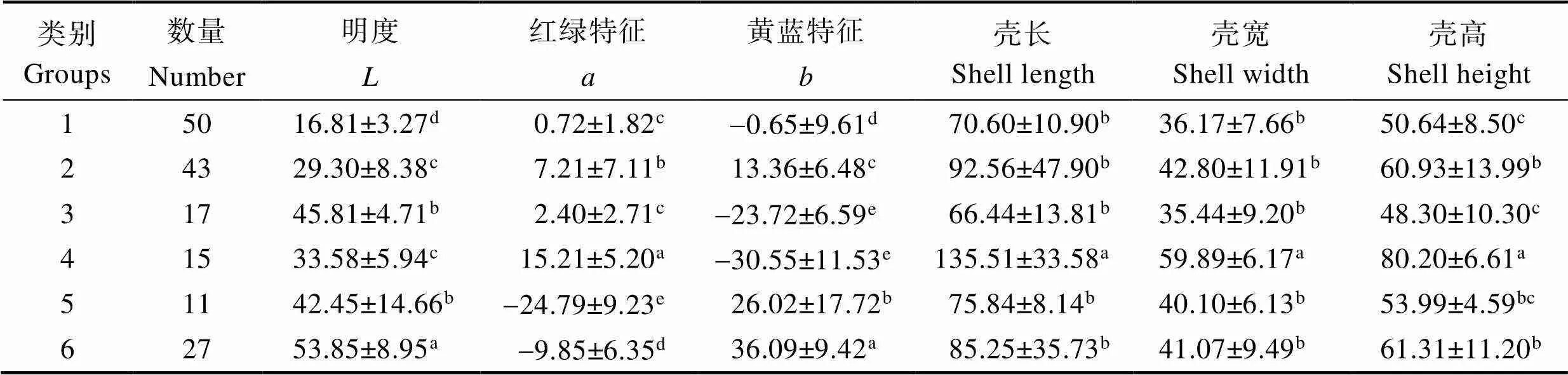
Tab.2 The morphological and L, a, b characteristics of each clustering T. crocea group (Means±SD)
表3 6类番红砗磲外套膜颜色间色差D

Tab.3 Colour aberration DE among the 6-classe T. crocea
3 讨论
本研究对南海海域番红砗磲外套膜颜色进行了分析。结果发现,纯色番红砗磲可分为褐色、红棕色、浅蓝色、深蓝色、绿色、黄色共6类。与之相比,马来西亚刁曼岛番红砗磲群体外套膜颜色有蓝色、蓝色轮廓、绿色或浅棕色、深棕色或黑色、绿色/棕色图案、深棕色图案、白色/浅色图案、复杂图案共8类(Todd, 2009)。通过比较可以看出,2个不同地区群体外套膜颜色存在一定差异,可能是群体遗传与外界环境共同作用产生的。Deboer等(2008)利用基因对整个印度–西太平洋485个番红砗磲遗传多样性分析表明,该物种至少存在3个独立群体。Loto等(1998)在进行棕色和蓝色外套膜砗磲的杂交研究表明,外套膜颜色是可遗传的。番红砗磲生存的热带珊瑚礁生态系统及其复杂,其光照、水流状况及悬浮颗粒物等理化要素在极小的时空尺度范围内就有多样性变化(Huston,1985)。有报道称,当砗磲外套膜颜色与背景颜色相近时,其受敌害生物攻击几率显著降低(Palma, 2001; Wente, 2003 )。因而,番红砗磲为更适应多变环境,进化产生了外套膜颜色多样性程度更高的子代,以维持其种群延续(Todd, 2009; Lyod, 1984)。
表4 颜色参数、、与壳长、壳宽和壳高的相关性

Tab.4 Correlation between colour parameter (L, a, and b) and shell length, shell width and shell height
注::相关系数;:显著性水平
Note:: Correlation coefficient;: Significance level
番红砗磲外套膜颜色多种多样,在色度图上极少数个体呈离散状,表明其颜色占比较低,进一步分析发现,这些个体色泽非常鲜艳。在番红砗磲外套膜颜色分析中,根据值的聚类结果可以分为6类。对比肉眼分组和系统聚类分组结果表明,系统聚类时,将蓝色分为第3类淡蓝色和第4类深蓝色,同时,E组黄色中偏棕色个体被分进B组成为第2类红棕色,剩下的个体成为第6类黄色。A组和D组基本保持不变,分别对应第1类褐色和第5类绿色,说明系统聚类比人工分组更加系统科学。
在番红砗磲形态性状与外套膜颜色参数、、值的偏相关分析中发现,壳高与颜色参数、、值均具有显著相关性(<0.05)。出现这种现象有2种假设,首先是当番红砗磲外套膜颜色与背景颜色不同时,对于其捕食者来说更加显眼,因此,优先被捕食;其次是随着番红砗磲的生长,其由虹彩细胞引起的结构着色或者共生虫黄藻发生变化,继而导致颜色发生变化。就第1种假设而言,如果所有易被捕食颜色的番红砗磲在幼体时被捕食,那么在整个进化过程中,该颜色群体就会逐渐消亡,所以,随着年龄的增长,番红砗磲的虹彩细胞发生变化更为可信(Todd, 2009)。为什么番红砗磲具有与其背景不同的外套膜颜色?目前,尚未有相关报道,但普遍猜测可能与光保护有关(Weingarten, 1991; Mercier, 1996),即番红砗磲通过颜色转变以保护自身或共生虫黄藻免受强光和紫外线的伤害。对于年幼和正在发育的番红砗磲而言,这种功能可能比隐蔽性更重要。
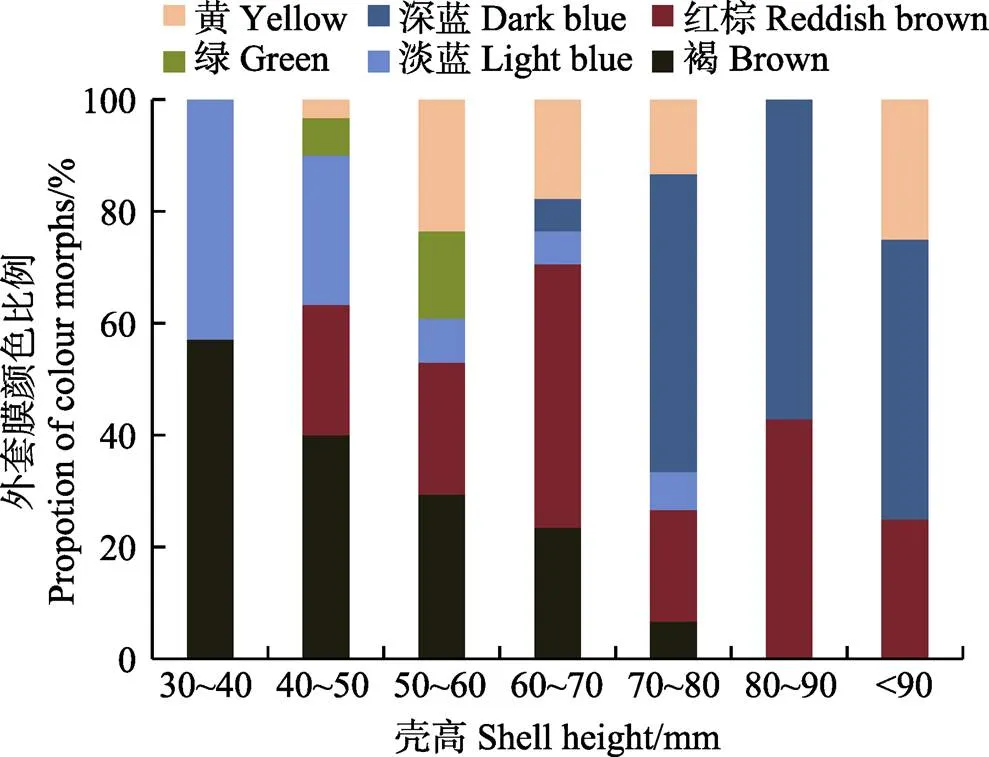
图4 不同壳高番红砗磲6种外套膜颜色分布
Borsa P, Fauvelot C, Tiavouane J,. Distribution of Noah’s giant clam,. Marine Biodiversity, 2015, 45(2): 339–344
Cuthill IC, Stevens M, Sheppard J,. Disruptive colouration and background pattern matching. Nature, 2005, 434: 72–74
Deboer TS, Subia MD, ErdmannMV,. Phylogeography and limited genetic connectivity in the endangered boring giant clam acrsos the coral triangle. Conservation Biology, 2008, 22(5): 1255–1266
Dong Y, Li XM. Protection, development and industrialization ofstock. Fisheries Science, 2015, 34(3): 195–200 [董杨, 李向民. 砗磲资源保护、开发及其产业化发展前景. 水产科学, 2015, 34(3): 195–200]
Endler JA. A predator’s view of animal colour pat-terns. Evolutionary Biology, 1978, 11: 319–364
Endler JA. Progressive background matching in moths, and a quantitative measure of crypsis.Biological Journal of the Linnean Society, 1984, 22: 187–231
Huelsken T, Keyse J, Liggins L,. A novel widespread cryptic species and phylogeographic patterns within several giant clam species (Cardiidae:) from the Indo- Pacific Ocean. PLoS One, 2013, 8(11): e80858
Huston MA. Pattern of species diversity on coral reefs. Annual Review of Ecology and Systematics, 1985, 149–177
Ling H, Todd PA, Chou LM,. The defensive role of scutes in juvenile fluted giant clams (). Journal of Experimental Marine Biology and Ecology, 2008, 359: 77–83
Liu CS, Liu XX, Wang H,. Effects of light intensity and spectra on metabolism of ammonia, active phosphates, and oxygen consumption in. Oceanologia et Limnologia Sinica, 2018, 49(2): 314–318 [刘春胜, 刘晓霞, 汪浩, 等. 光照强度和光色对番红砗磲()氨氮、活性磷酸盐及氧代谢的影响. 海洋与湖沼, 2018, 49(2): 314–318]
Li YC, Han YD, Chen SQ,. Damages of coral reef ecosystem by the giant clam excavation—A case study on North Reef of Xisha Islands.Journal of Applied Oceanography, 2015, 34(4): 518–524 [李元超, 韩有定, 陈石泉, 等. 砗磲采挖对珊瑚礁生态系统的破坏——以西沙北礁为例. 应用海洋学学报, 2015, 34 (4): 518–524]
Loto’ahea T, Sone S. Giant calms in Tonga. Nuku’akofa, Kingdom of Tonga. Minstry of Fisheries, 1998
Loyd DG. Variation strategies of plants in hetero-geneous environments. Biological Journal of the Linnaean Society, 1984, 21: 357–385
Lucas JS. Giant clams. Current Biology, 2014, 24(5): 183–184
Mercier A, Hamel JF. The secret of the giant clam. Freshwater and Marine Aquarium, 1996, 19(5): 112–113
Merilaita S, Lind J. Background-matching and dis-ruptive coloration and the evolution of cryptic colour-ation. Proceedings of the Royal Society of London, Series B: Biological Sciences, 2005, 272: 665–670
Merilaita S, Lyytinen A, Mappes J. Selection for cryptic coloration in a visually heterogeneous habitat. Proceedings of the Royal Society of London, Series B:Biological Sciences, 2001, 268(1479): 1925–1929
Merilaita S. Visual background complexity facilitates the evolution of camouflage. Evolution, 2003, 57(6): 1248–1254
Mingoa-Licuanan SS, Gomez ED. Giant clam conservation in Southeast Asia. Tropical Coasts, 2002, 3: 24–56
Ozog ST. Balancing anti-predation and energetic needs: Color polymorphism in the giant clammaxima.UCB Moorea Class: Biology and Geomorphology of Tropical Islands, Student Research Paper, 2009
Palma AT, Steneck RS. Does variable coloration in juvenile marine crabs reduce the risk of predation? Ecology, 2001, 82: 2961–2967
Penny SS, Willan RC. Description of a new species of giant clam (Bivalvia:) from Ningaloo Reef, Western Australia. Molluscan Research, 2014, 34(3): 201–211
Richter C, Roa-Quiaoit H, Jantzen C,. Collapse of a new living species of giant clam in the Red Sea. Current Biology, 2008, 18: 1–6
Su Y, Hung JH, Kubo H,.(Röding, 1798)–A valid giant clam species separated from(Röding, 1798) by morphological and genetic data. Raffles Bulletin of Zoology, 2014, 62: 124–135
Todd PA, Briers RA, Ladle RJ,. Phenotype-environment matching in the shore crab (). Marine Biology, 2006, 148: 1357–1367
Todd PA, Ladle RJ, Lewin-Koh N,. Genotype 9 environment interactions in transplanted clones of the massive coralsand. Marine Ecology Progress Series, 2004, 271: 167–182
Todd PA, Lee JH, Chou LM. Polymorphism and crypsis in the boring giant clam (): Potential strategies against visual predators. Hydrobiologia, 2009, 635(1): 37–43
Weingarten RA. Tridacna-the giant clam. Freshwater and Marine Aquarium, 1991, 14(2): 101–106
Wente WH, Phillips JB. Fixed green and brown color morphs and a novel color-changing morph of the Pacific tree frog. American Naturalist, 2003, 162: 461–473
Yasin Z, Tan SH. Quantitative and qualitative effects of light on the distribution of giant clams at the Johore Islands in South China Sea. Phuket Marine Bio-logical Center Special Publications, 2000, 21(1): 113–118
Zhang YH, Xiao S, Li J,The artificial breeding and early development of the fluted giant clam () in South China Sea. Journal of Fisheries of China, 2016, 40(11): 1713–1723 [张跃环, 肖述, 李军, 等. 鳞砗磲的人工繁育和早期发生. 水产学报, 2016, 40(11): 1713–1723]
Colour Polymorphism ofMantle and Its Correlation with Growth Traits
HE Yuanyuan1#, LIU Ertian1#, GU Zhifeng1, SHI Yaohua1, WANG Aimin1,2, LIU Chunsheng1①
(1. Ocean College, Hainan University, Haikou 570228; 2. State Key Laboratory of Marine Resource Utlization in South China Sea, Hainan University, Haikou 570228)
As one of the main members in coral reef ecosystems, giant clams have important economic and ecological value. The conspicuous, brightly coloured mantle shared by all giant clams is a unique feature distinct from other bivalve mollusks and plays an important role in energy harvesting and privacy protection. The boring giant clamis usually found at depths of 0.5~3.5 m and is one of the most colourful giant clam species. In this study,from Xisha, South China Sea was used to study mantle colour polymorphism by CSE-1 imaging and colour-measuring system and cluster analysis. Moreover, the relationship between mantle colour and morphological traits ofwas also studied. The results showed that the mantle colour of mostindividuals was distributed in the blue and red primary regions, and only a few individuals showed colour distribution in the green primary and bright green regions.were clustered into six colour groups (including brown, reddish brown, light blue, dark blue, green and yellow), and the colour differences between each group were >15, among which the difference between dark blue colour of the fourth type and yellow colour of the sixth type was the largest (D=74.68), while the difference between light blue of the third type and dark blue of the fourth type was the smallest (D=18.98). The,, andvalues ofmantle had significant positive correlations with shell height (<0.05); the correlation coefficients were 0.2080, 0.2210, and 0.2375, respectively. This study provided a basic reference for the conservation of giant clam resources and the recovery of coral reef ecosystems.
; Mantle colour; Polymorphism; Correlation
S917.4
A
2095-9869(2020)02-0176-07
刘春胜,副教授,E-mail: lcs5113@163.com
2019-01-10,
2019-01-30
* 海南省自然科学基金项目(317029)和国家重点研发计划(2018YFD0900704)共同资助[This work was supported by Natural Foundation of Hainan Province (317029), and National Key Research and Development Plan (2018YFD0900704)].
10.19663/j.issn2095-9869.20190110003
http://www.yykxjz.cn/
何园园, 刘二田, 顾志峰, 石耀华, 王爱民, 刘春胜. 番红砗磲外套膜颜色多态性及其与生长性状相关性研究. 渔业科学进展, 2020, 41(2): 176–182
He YY, Liu ET, Gu ZF, Shi YH, Wang AM, Liu CS. Colour polymorphism ofmantle and its correlation with growth traits. Progress in Fishery Sciences, 2020, 41(2): 176–182
# 共同第一作者:何园园,E-mail: 291807274@qq.com; 刘二田,E-mail: 601840695@qq.com
LIU Chunsheng, E-mail: lcs5113@163.com
(编辑 陈 严)
