miR⁃214抑制牙囊细胞成骨分化的体外研究
2020-03-24王智亨左婕王梦琪朱少军刘奕杉
王智亨,左婕,王梦琪,朱少军,刘奕杉
新疆医科大学第一附属医院(附属口腔医院)儿童口腔科-口腔预防科,新疆维吾尔自治区口腔医学研究所,新疆维吾尔自治区乌鲁木齐(830054)
1 材料和方法
1.1 主要试剂
α-MEM培养液、PBS缓冲液、胎牛血清及2.5 g/L胰蛋白酶、opti-MEM、双抗(Hyclone,美国);谷氨酰胺和Ⅰ型胶原酶溶液(Gibco,美国);β-甘油磷酸钠、地塞米松、抗坏血酸(Sigma,美国);lipofectamine 3000(Invitrogen,美国);miR-214-3p mimics(5′-ACAGCAGGCACAGACAGGCAG-3′,5′-GCCUGUCUGUGCCUGCUGUUU-3′)、miR-214-3p inhibitor(5′-CUGCCUGUCUGUGCCUGCUGU-3′)和染料法Hairpin-it miRNAs定量和U6校准qRT-PCR试剂盒(吉玛,上海);荧光定量试剂盒、反转录试剂盒和RIPA裂解液、ECl显色液、AP显色液(Thermo,德国);RUNX-2抗体、β-actin抗体、β-catenin抗体、山羊抗兔荧光二抗(Abcam,美国)、兔抗鼠荧光二抗(中杉金桥,中国),茜素红(北京索莱宝科技有限公司)。
1.2 牙囊细胞的分离与培养
取3~4日龄SD大鼠的乳鼠(动物合格证号:SCXK(新)2013-0002,新疆医科大学动物实验中心)脱颈处死,75%酒精浸泡5 min,取双侧下颌骨,PBS冲洗,洗净血液,剥除颌骨多余肌肉组织,置于装有α-MEM的培养皿中,显微手术器械剥离牙胚,体视显微镜下剥离牙胚表面牙囊,剪碎,吸取置15 mL离心管中,以1 000 r/min离心5 min,弃去上清,置2 mL胰酶于离心管中重悬组织碎片。将离心管至于37℃水浴锅中震荡5 min,加入4 mLⅠ型胶原酶。将离心管至于37℃摇床中,200 r/min消化35min。置4 mL完全培养基终止消化,以1 000 r/min离心5 min,弃去上清。以10 mL完全培养基(含有15%FBS、1%双抗及1%谷氨酰胺,以α-MEM配制)重悬离心管底部细胞团块,至于培养瓶中放入37℃,含有饱和湿度及体积分数5%二氧化碳的细胞培养箱中,12~15 h换液,双向差速传代法纯化牙囊细胞,此前本课题组已进行鉴定[10],传代至第3~4代备用。
1.3 转染与成骨诱导
转染前一天取3~4代牙囊细胞接种于6孔板中,确保细胞处于对数生长期,24 h内可生长至70%,弃去原培养基,PBS冲洗3次,每孔加入完全培养基1.5 mL待用。每孔取250μL Opti-MEM与4μL Lipofectamin 3000混合5 min,250μL Opti-MEM与5μL miR-214 mimics(miR-214 mimics组),miR-214 inhibitor(miR-214 inhibitor组),混合5 min,将两种混合液混合20 min,滴入孔板,轻晃混匀。5 h后更换成骨诱导液培养(质量分数为10%FBS、0.1μmol/L地塞米松、10 mmol/Lβ-甘油磷酸钠和50 mg/L维生素C的α-MEM培养液),每2日换液。
1.4 RNA提取及qRT-PCR
1.4.1 转染效率及成骨诱导后miR-214的表达 转染1、2、3 d后,提取miR-214 mimics组、miR-214 inhibitor组和DFCs组(正常DFCs)细胞,利用Trizol提取总RNA,qRT-PCR检测miR-214。以上3组成骨诱导7 d,利用Trizol提取总RNA,进行qRTPCR。逆转录条件:采用20μL体系,温度设置为25℃30 min,42℃30 min,85℃5 min,4℃保存。PCR反应条件为:20μL体系,温度设置为:预变性95℃3 min,PCR反应95℃12 s,62℃40 s,40个循环。引物见表1。
1.4.2 成骨相关基因的检测 上述3组经成骨诱导7 d的细胞,利用Trizol提取总RNA,使用反转录试剂盒将所提取RNA反转录为cDNA,再使用Syber Green检测试剂盒将所得的cDNA进行扩增,qRTPCR进行成骨相关基因:成骨相关转录因子2(runtrelated transcription factor-2,RUNX-2)、碱性磷酸酶(alkaline phosphatase,ALP)、骨粘连蛋白(osteonectin,OSN)的检测。均采用20μL体系,引物见表1。反应条件为:PCR反应条件:95℃预变性2 min,95℃5 s;60℃10 s,45个循环。

表1 qRT-PCR目的基因引物序列Table 1 qRT-PCR target gene primer sequence
1.5 蛋白免疫印迹
上述3组成骨诱导7 d,培养皿使用PBS冲洗3次后,加入细胞裂解液,置于冰上30 min;用细胞刮刀仔细刮擦六孔板底,将刮取的细胞碎片吸入预冷的微量离心管中,超声裂解细胞;将获得的细胞裂解液离心5 min(4℃120 000 r/min),取上清用BCA蛋白定量试剂盒测定蛋白浓度,加入蛋白上样缓冲液后,100℃煮沸蛋白5 min使其变性,冰上冷却,短暂离心后备用。制胶,电泳后80 mA转膜条件2 h,封闭2 h后,以脱脂牛奶稀释RUNX-2、βcatenin、β-actin一抗4℃孵育过夜。TBST洗膜3次,每次10 min。二抗孵育2 h,TBST洗膜3次,每次10 min,β-catenin、β-actin使用ECL发光剂液显色,RUNX-2使用AP显色液显色蛋白凝胶成像系统分析样品中目标蛋白的相对含量。
1.6 茜素红染色
将miR-214 mimics组、miR-214 inhibitor组、DFCs组细胞接种于30 mm培养皿中,成骨诱导14 d,弃去培养液,使用PBS冲洗3次,用多聚甲醛固定细胞,茜素红染液染色5 min,ddH2O漂洗3次,倒置显微镜下观察。
1.7 统计学分析
2 结果
2.1 牙囊细胞的分离培养
原代细胞接种于培养瓶中10 d可生长至80%~90%,经双向差速法提纯3~4代可得纯化的牙囊细胞(图1)。
Figure 1 Primary DFCs and DFCs purified to the third generation by bidirectional differential passaging图1 原代DFCs及经双向差速传代法提纯至第三代的DFCs
2.2 qRT-PCR
2.2.1 转染效果 经qRT-PCR检测,转染1 d,miR-214 inhibitor组miR-214表达受抑制,较正常DFCs下降43倍(P<0.01),miR-214 mimics组表达上调41倍(P<0.01);转染2 d及转染3 d,miR-214的转染效果逐渐弱化(P<0.05)(图2)。
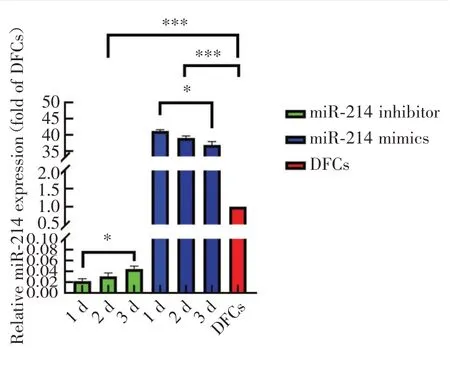
Figure 2 Expression of miR-214 1,2 and 3 days after transfection of the miR-214 mimics and miR-214 inhibitor图2 转染miR-214 mimics及miR-214 inhibitor后1、2、3 d miR-214表达情况
2.2.2 成骨诱导后miR-214的表达 成骨诱导7 d,miR-214 mimics组miR-214的表达较正常DFCs组高22倍(P<0.01),而miR-214 inhibitor组miR-214的表达低于正常DFCs组,差异具有统计学意义(P<0.05)(图3)。
2.2.3 成骨诱导后成骨相关基因的表达 miR-214 mimics组,成骨相关基因ALP、OSN及RUNX-2的mRNA表达均低于正常DFCs组,但仅ALP在两组的差异具有统计学意义(P>0.05),而miR-214 inhibitor组成骨相关基因OSN及RUNX-2、ALP的mRNA表达均高于DFCs组,且差异具有统计学意义(P<0.05)(图4)。

Figure 3 Expression of miR-214 after 7 days of osteogenesis induction after the transfection of the miR-214 mimics and miR-214 inhibitor图3 转染miR-214 mimics及miR-214 inhibitor并成骨诱导7 d miR-214的表达情况

Figure 4 Expression of ALP,OSN,RUNX-2 after 7 days of osteogenesis induction after the transfection of the miR-214 mimics and miR-214 inhibitor图4 转染miR-214 mimics及miR-214 inhibitor并成骨诱导7 d ALP、OSN、RUNX-2 mRNA表达情况
2.3 免疫蛋白印迹结果
miR-214 mimics组,RUNX-2、β-catenin的蛋白表达均低于miR-214 inhibitor组,但miR-214 mimics组及miR-214 inhibitor组RUNX-2、β-catenin的蛋白表达均高DFCs组(图5)。
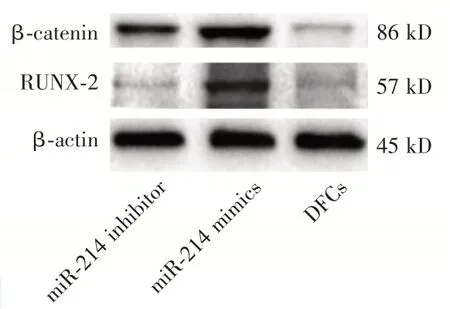
Figure 5 Expression of RUNX-2 andβ-catenin after 7 days of osteogenesis induction in the miR-214 mimics,miR-214 inhibitor,DFCs groups图5 miR-214 mimics组、miR-214 inhibitor组、DFCs组成骨诱导7 d RUNX-2、β-catenin蛋白的表达情况
2.4 茜素红染色结果
成骨诱导14 d,经茜素红染色可明显观察到,miR-214 mimics组钙化结节明显少于DFCs组,而miR-214 inhibitor组的钙化结节却明显多于DFCs组(图6)。

Figure 6 Images of mineralized nodules by alizarin red staining after 14 days of osteogenesis induction in the 3 groups图6 成骨诱导14 d 3组矿化结节茜素红染色图片
3讨论
牙囊在牙齿萌出过程中的作用是不可替代的,在形成牙齿萌出通道,提供牙齿萌出的动力中发挥了不可替代的作用,具体表现为牙囊方的破骨现象以及根方的成骨现象[11-12]。经典的Wnt通路对成骨分化的调控取决于细胞的类型,以及成骨分化的阶段[13-14],在本研究中发现了Wnt/βcatenin经典通路对于牙囊细胞的成骨分化早期的促进作用,而不是抑制。
Wang等[15]通过切除大鼠卵巢建立骨质疏松模型,发现其骨组织miR-214高表达,在后肢卸载小鼠卸载模型中,其成骨细胞中miR-214水平较基线小鼠更高。在体内注射antagomir-214(miR-214拮抗剂)后,发现可以逆转上述现象。其体外细胞实验也得出了相同的结论。并发现miR-214与转录因子4(activating transcription factor 4,ATF4)呈负相关,并通过荧光素酶报告法证明了ATF4是miR-214的靶基因。类似的结果在Yao等[16]的研究中也得以证明,其利用牙周膜干细胞的干细胞特性进行成骨诱导,发现miR-214的表达在成骨诱导后下调,而ATF4的表达下调。将miR-214 inhibitor(miR-214抑制剂)转染至牙周膜干细胞后行成骨诱导发现细胞的成骨基因表达上调,而ATF4表达上调,这与本研究的结果一致。同样,动物实验也有力的证明了这一点,有研究建立小鼠的胫骨骨折模型并定期注射agomir-214及antagomir-214,发现agomir-214组中小鼠骨折愈合状况差于antagomir-214组,且Western-blot实验显示β-catenin的表达也受到抑制[17]。miR-214对于β-catenin的抑制作用还体现在其对于调节人毛囊干细胞的增殖与分化中[18]。除此之外,有研究还发现抑制miR-214可以促进小鼠成骨细胞MC3T3-E1的成活以及其细胞外基质的形成,而细胞外基质的形成是矿物质积累以及成骨现象的基础[19]。已有用于治疗骨质疏松的研究表明,通过纳米粒子向骨吸收表面传送anti-miR-214可以改善骨微结构和骨质量[20-21]。本研究证明了牙囊细胞在成骨诱导后其β-catenin表达上调,转染miR-214 mimics的牙囊细胞其成骨分化受到抑制,β-catenin的表达呈现抑制的现象,而转染miR-214 inhibitor的牙囊细胞与之相反。说明miR-214对于牙囊细胞的成骨分化起这抑制的作用,其中有可能是通过下调β-catenin的表达来实现的。本研究有一定的不足之处,未能进一步检测Wnt/β-catenin通路下游基因的表达,因此未能完全阐述miR-214抑制DFCs成骨分化的确切机制。
进一步明确miR-214对于牙囊的调控作用,将有助于预防及治疗牙齿萌出障碍,更好造福于患者。
