敲低circ_0001273抑制口腔鳞癌细胞增殖、迁移及侵袭的研究
2020-03-24曾藩韬余东升
曾藩韬,余东升
1.广州医科大学附属第二医院口腔科,广东 广州(510260);2.中山大学附属口腔医院·光华口腔医学院·广东省口腔医学重点实验室,广东 广州(510055)
近年来口腔鳞癌及其他恶性肿瘤相关研究有了一定进展,但是口腔鳞癌患者的预后没有明显的改善,口腔鳞癌的5年生存率在过去30年中仍保持在55%~60%左右[1]。因此进一步探索口腔鳞癌的发生发展机制以及潜在分子靶点在口腔鳞癌研究中十分重要。环状RNA(circular RNA,circRNA)是一种以共价配对形成的环状非编码RNA分子,其不具有游离5’端帽子和3’端poly尾巴,前体RNA可变剪接后直接成环,且不被核酸外切酶RNase R降解[2]。环状RNA也被发现与多种人类疾病有关,例如癌症和自身免疫性疾病等,这提示环状RNA可能成为新的肿瘤分子标志物或治疗靶点。在口腔鳞癌中,Chen等[3]发现circ_100290在口腔鳞癌中异常高表达,其可以海绵性吸附miR-29家族成员来调节相关基因表达水平,并最终影响了口腔鳞癌细胞在体内及体外的增殖能力。但口腔鳞癌中circ_0001273的功能尚未见报道。本研究探讨circ_0001273对口腔鳞癌细胞增殖、迁移及侵袭的影响,为口腔鳞癌发生发展机制的研究提供了新的研究基础。
1 材料和方法
1.1 材料、试剂和仪器
口腔鳞癌及癌旁组织来源中山大学附属口腔医院2018年收集病例;本研究获得中山大学附属附属口腔医院伦理委员会批准。口腔鳞癌UM1和CAL27细胞株(ScienCell,美国);circ_0001273 siRNA由上海吉玛生物设计并合成;Trizol Universal(天根生化,中国);cell Titer 96AQ单溶液细胞增殖检测试剂(Promega,美国);Transwell细胞培养板及Matrigel胶(BD,美国);酶标仪(Thermo Fisher Scientific,美国);ABI7500荧光PCR仪(ABI,美国)。
1.2 细胞培养
口腔鳞癌UM1细胞株在含10%胎牛血清的DMEM-F12培养基(含100 U/mL青霉素和100μg/mL链霉素)中培养;口腔鳞癌CAL27细胞株在含10%胎牛血清的DMEM-H培养基(含100 U/mL青霉素和100μg/mL链霉素)中培养。置于37℃、5%CO2和95%相对湿度的细胞培养箱中进行培养。每48 h换液传代1次,取对数生长期细胞进行实验。
1.3 细胞转染
转染前一天将细胞传代,使其融合度为40%左右。吸去完全培养基,用PBS洗两遍后每孔加入1 mL 20%胎牛血清的DMEM高糖培养基。用无RNA酶的去离子水溶解siRNA使其浓度用20μM,再将其溶于500μL opti-MEM培养基中。另取5μL LipofectaminRNAiMAX混匀于500μL opti-MEM培养基中。将两份液体混匀后静置20 min即可分别加入各细胞培养孔中。将24孔细胞培养板放入细胞培养箱4~6 h后,即可换为正常培养基。
1.4 qRT-PCR
提取总RNA,在无RNA酶的PCR管中加入1μg总RNA及11μL纯水,混匀后至于85℃保温5 min,使RNA变性,随后立即置于冰上,以防RNA复性,随后在此PCR管中加入0.5μL Oligo(dT)、0.5μL Random primer、2μL 10 mM dNTP、RNase inhibitor、5×buffer及M-MLV,混匀后置于30℃保温10 min,置于42℃60 min,置于85℃10 min。逆转录完成后,在PCR仪上设置反应条件为50℃2 min、95℃2 min、95℃15 s、60℃32 s、40个循环,并于60℃~95℃分析熔解曲线。引物序列如表1所示。

表1 引物序列Table 1 Primer sequences
1.5 细胞增殖
消化细胞后将细胞吹打散开,细胞计数,调整细胞浓度为1×105个/mL,96孔板中每孔100μL即1×104个细胞。待细胞贴壁后,收集0、12、24、48 h 4个时间点的细胞,加入MTS试剂,每100μL培养基加入10μL检测试剂。孵育4 h后,使用酶标仪读板,读取OD490数据。
1.6 细胞迁移
细胞计数1×105个细胞,使用100μL无血清培养基重悬,加入Transwell小室的上室,并在下室加入600μL完全培养基。置于37℃、5%CO2细胞培养箱孵育48 h后,取出小室,用棉签擦去上室的细胞,用4%多聚甲醛固定15 min后PBS缓冲液洗1次,结晶紫染色10 min后PBS缓冲液洗1次,拍照统计细胞穿过小孔的数量。
1.7 细胞侵袭
4℃溶解Matrigel胶过夜,后预冷的无血清培养基以1∶3体积比稀释Matrigel胶,取40μL加入预冷的Transwell小室中,37℃孵育2 h,使Matrigel胶凝固。吸走Transwell小室中多余的液体,在上室加入100μL无血清培养基,在下室加入600μL无血清培养基,37℃过夜。每组细胞计数1×105个细胞,使用100μL无血清培养基重悬,加入Transwell小室的上室,并在下室加入600μL完全培养基。置于37℃、5%CO2细胞培养箱孵育48 h后,取出小室,用棉签擦去上室的细胞,用4%多聚甲醛固定15 min后PBS缓冲液洗1次,结晶紫染色10 min后PBS缓冲液洗1次,拍照统计细胞穿过小孔的数量。
1.8 统计学统计
2结果
2.1 12例组织中检测3种circRNA表达水平结果
在12例口腔鳞癌及癌旁组织中,相对于癌旁组织,circ_0001273(t=9.054)、circ_0018569(t=5.306)、circ_0027152(t=7.232)3种circRNA在口腔鳞癌组织中均显著高表达(P<0.05),其中circ_0001273差异最为显著,平均差异为8.5倍(图1)。
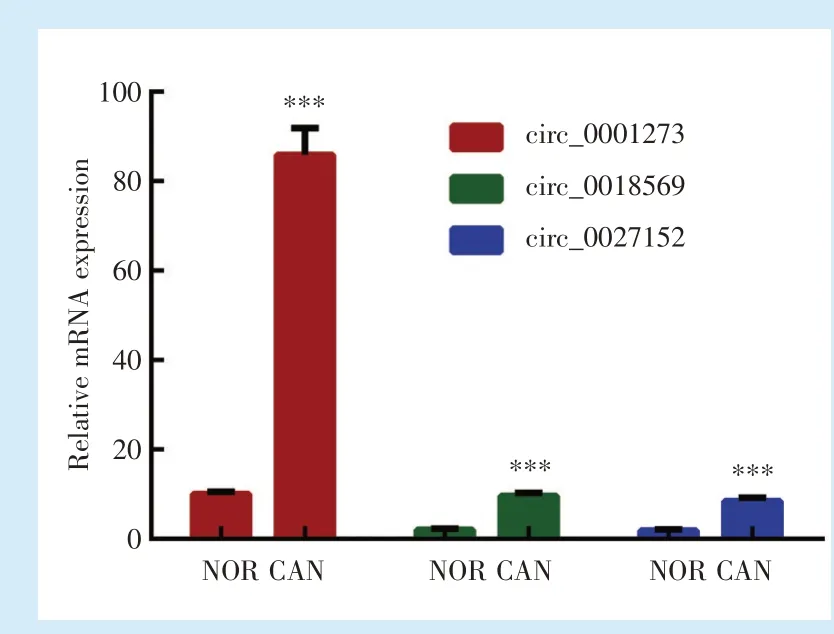
Figure 1 Relative expression of circ_0001273,circ_0018569,circ_0027152 in 12 oral squamous cell carcinoma and adjacent tissues图1 12例口腔鳞癌及癌旁组织中circ_0001273,circ_0018569,circ_0027152的相对表达
2.2 敲低circ_0001273后口腔鳞癌细胞株中circ_0001273的表达水平
UM1及CAL27细胞株中分别转染siRNA NC及siRNA后,circ_0001273表达水平如图2所示。和转染siRNA NC的细胞组相比,转染siRNA的UM1(t=50.408)及CAL27(t=23.556)中circ_0001273表达均明显降低(P<0.05),circ_0001273 siRNA敲低对UM1细胞株中circ_0001273表达的抑制率为73%,对CAL27细胞株的抑制率为80%。
2.3 敲低circ_0001273对口腔鳞癌细胞株增殖功能的影响
UM1及CAL27细胞株中分别转染siRNA NC及siRNA后,各组细胞增殖能力如图3所示。和转染siRNA NC的细胞组相比,转染siRNA的细胞组UM1(t=14.735)及CAL27(t=23.383)增殖能力显著降低(P<0.05)。

Figure 2 Relative expression of circ_0001273 in 4 groups of oral squamous cell carcinoma cells after knockdown of circ_0001273图2 敲低circ_0001273后4组口腔鳞癌细胞中circ_0001273的相对表达
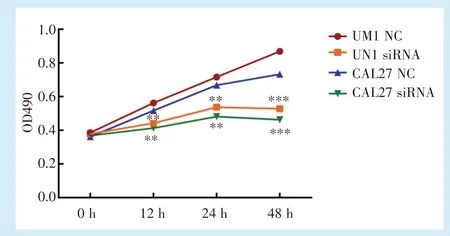
Figure 3 Effect of circ_0001273 siRNA on the proliferation of UM1 and CAL27 cells图3 circ_0001273 siRNA对UM1及CAL27细胞增殖能力的影响
2.4 敲低circ_0001273对口腔鳞癌细胞株迁移功能的影响
UM1及CAL27细胞株中分别转染siRNA NC及siRNA后,各组细胞迁移水平如图4所示。和转染siRNA NC的细胞组相比,转染siRNA的细胞组UM1(t=34.641)及CAL27细胞株(t=60.622)细胞迁移能力表达均显著降低(P<0.05)。
2.5 敲低circ_0001273对口腔鳞癌细胞株侵袭功能的影响
UM1及CAL27细胞株中分别转染siRNA NC及siRNA,各组细胞侵袭水平如图5所示。和转染siRNA NC的细胞组相比,转染siRNA的细胞组UM1(t=22.17)及CAL27(t=33.005)细胞侵袭能力均显著降低(P<0.05)。
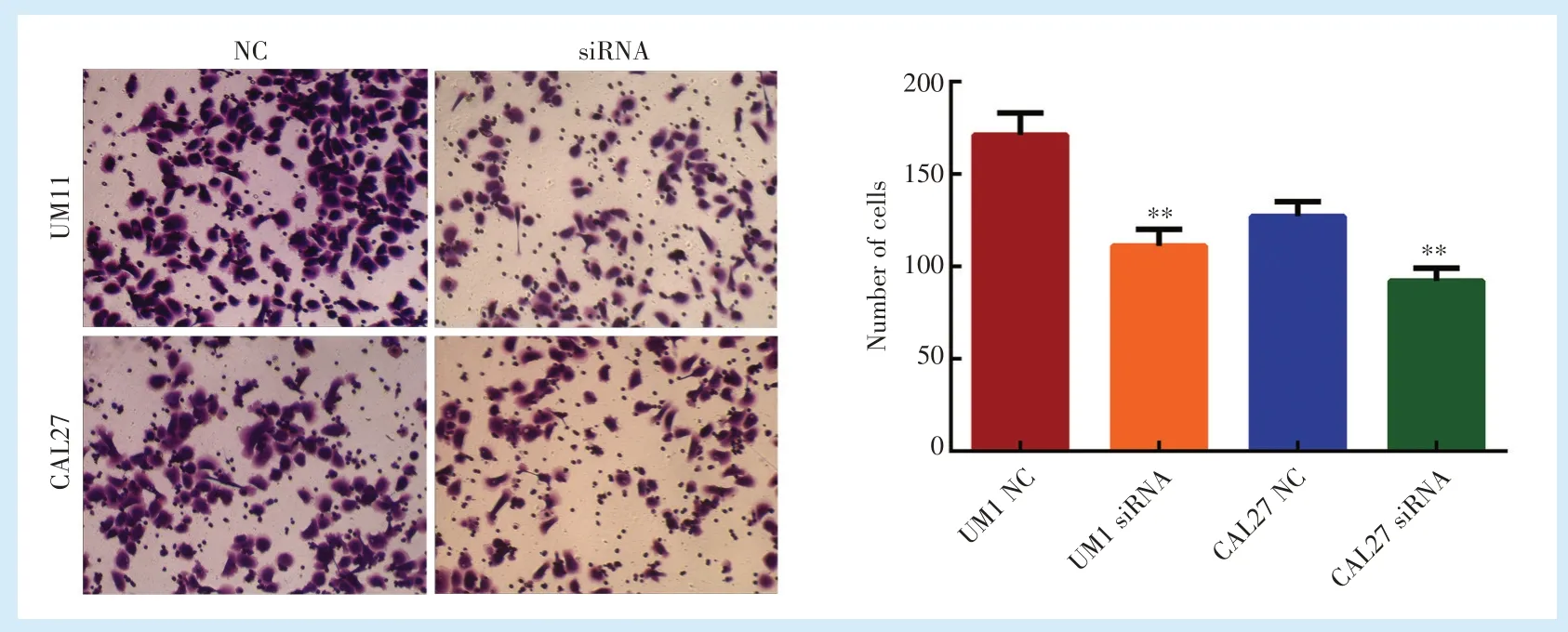
Figure 4 Effect of circ_0001273 siRNA on the migration ability of UM1 and CAL27 cells图4 circ_0001273 siRNA对UM1及CAL27细胞株迁移能力的影响
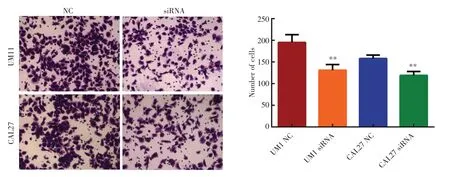
Figure 5 Effect of circ_0001273 siRNA on the invasion ability of UM1 and CAL27 cells图5 circ_0001273 siRNA对UM1及CAL27细胞侵袭能力的影响
3讨论
circRNA早期被认为是一类基因剪切副产物而没有实际作用,如今被发现与多种人类疾病相关,如骨关节炎[4]、自身免疫疾病[5]及动脉粥样硬化[6]等。研究表明circRNA可以海绵式吸附miRNAs,以此阻止miRNA对mRNA的抑制效果[7],并且circRNA能够作为肿瘤的生物标志物[8]。circRNA成为了近几年肿瘤研究中的热门研究对象,在胃癌[9]、骨肉瘤[10]、肺腺癌[11]、肝癌[12]、食管鳞癌[13]及三阴性乳腺[14]中,均有相关circRNA在肿瘤的发生发展中发挥了重要作用。而在口腔鳞癌中,有研究用TNF-α诱导口腔鳞癌细胞株CAL27构建凋亡模型,通过生物信息学预测并在细胞模型上验证,发现circDOCK1可以靶向结合miR-196a-5p,间接调控了miR-196a-5p的靶基因BIRC3,从而抑制了口腔鳞癌细胞凋亡[15]。结合circ_0001273在口腔鳞癌中高表达的情况,circ_0001273可能的作用机制是与促癌基因竞争结合miRNA,海绵式吸附miRNA导致促癌基因的活化,从而参与了口腔鳞癌的发生。
目前circRNA在口腔鳞癌的相关研究仍然较少,因此继续探索口腔鳞癌相关circRNA的研究十分重要。本研究在12例口腔鳞癌及癌旁组织中通过qRT-PCR检测了circ_0001273、circ_0018569、circ_0027152三个circRNA,并选取了差异最大的circ_0001273来进行后续研究,实际上另两个circRNA也在口腔鳞癌中异常高表达(P<0.05),也是值得进一步研究的。研究中发现circ_0001273的高表达,提示circ_0001273可能是口腔鳞癌的生物标志分子,进一步研究需要加大样本量,并可以在患者外周血中进行检测,以验证其作为口腔鳞癌生物标志物的潜力。敲低circ_0001273可以使口腔鳞癌细胞株UM1及CAL27的增殖、迁移及侵袭能力显著下降(P<0.05),这提示circ_0001273可能参与了促进口腔鳞癌肿瘤的生长及转移,然而circ_0001273对口腔鳞癌细胞具体的调控机制仍需要进一步研究。
敲低circ_0001273可以抑制口腔鳞癌细胞株中的增殖、迁移及侵袭,表明其在口腔鳞癌的发生发展中可能发挥重要的作用,circ_0001273可能成为新的口腔鳞癌治疗靶点。
