胶体金标免疫固相膜检测动物性食品中氟甲喹
2020-03-23刘卫华于文龙杨茜王向红
刘卫华,于文龙,杨茜,王向红
(河北农业大学食品科技学院,河北保定071000)
食品的安全危害主要来自农药、兽药以及饲料添加剂等[1]。随着我国养殖业的发展,兽药及饲料添加剂广泛应用,滥用和超标使用的问题一直存在,造成残留。兽药残留的危害主要有毒性作用、过敏及变态反应、致癌或致畸变等[2]。氟甲喹(flumequine,FLU)属于第二代喹诺酮类抗菌药物,用于预防和治疗畜禽类、鱼类、虾蟹类的疾病,作用机理是通过抑制细菌DNA解旋酶的作用,抑制细菌核酸的合成,从而起到杀菌的效果[3]。一些学者研究了氟甲喹的毒性及危害[4-6]。低剂量的氟甲喹对人及和动物产生的危害虽没有明确的报道,但长期摄入含氟甲喹残留的食品,可能对人体健康产生潜在的危害。
为了保障动物性食品的安全,保护消费者的健康,世界各国都对氟甲喹的残留限量作出了规定。欧盟规定,FLU 的最高残留量为:牛、羊、猪肌肉中200 μg/kg,肝脏中 500 μg/kg;牛奶中 50 μg/kg;家禽肌肉中 400 μg/kg,其它种类:肌肉中 200 μg/kg[7]。2002年,我国农业部发布公告,规定FLU 的最高残留量为:牛、羊、猪肌肉中 500 μg/kg,肝脏中 500 μg/kg,奶中50 μg/kg;鸡肉中 500 μg/kg[8]。2018 年 6 月 13 日,加拿大食品检验局发布水产品药物残留监测清单,明确规定不接受使用氟甲喹[9]。为加强动物性食品安全的监管,研究新型、简便、快速、灵敏度高的氟甲喹检测方法十分重要。
国内外有关氟甲喹检测的方法主要是仪器分析法[10-13]、免疫分析法[14-16]及其它方法。相比之下,免疫分析法具有成本低、操作简单、快速、特异性强、灵敏度及准确性较高等优点,很适合大量样本的筛查。固相膜免疫检测技术是一种基于抗原抗体结合反应原理、以微孔膜作为固相载体的免疫检测技术,其最常用的标记物是胶体金。其特点是检测速度快、灵敏度高、特异性强、操作方便、结果直观,无需仪器[17]。目前已有氟甲喹固相膜免疫分析方法的报道[18-19],但检测的灵敏度和准确性还有待提高。本研究针对动物性食品中的氟甲喹残留问题,建立灵敏度和准确性较高的胶体金标记固相膜免疫检测方法。
1 材料与方法
1.1 材料、试剂及仪器
氟甲喹、氯金酸(HAuCl4):上海源叶生物科技有限公司;鸡卵清白蛋白(ovalbumin,OVA)、牛血清白蛋白(bovine serum albumin,BSA)、福氏不完全佐剂、福氏完全佐剂、过氧化氢脲(CH6N2O3):美国Sigma 公司;磷酸氢二钠(Na2HPO4·12H2O),磷酸二氢钠(NaH2PO4·2H2O)、柠檬酸三钠:天津科密欧化学试剂公司;Protein ASepharose CL-4B 凝胶层析柱:北京市热景生物技术有限公司;硝酸纤维素膜(nitrocellulose filter membrane,NC):美国 Millipore 公司。
DYCZ-24KS 垂直电泳仪:北京市六一仪器厂;GL-10000C 冷冻离心机:上海安亭科学仪器厂;99-1 型磁力搅拌器:常州市国华仪器有限公司;Sk-1 型旋涡混匀器:海门市麒麟医用仪器厂;UV-2800 紫外可见分光光度计:尤尼克(上海)仪器有限公司;toppeffe 单道微量可调移液器:上海大龙医疗设备有限公司;Multiskansky 全波长酶标仪:美国Thermo 公司;96 孔酶标板:广州洁特生物过滤股份有限公司。
纯牛奶、虾肉、牛肉、猪肉、猪肝:河北省保定市沃尔玛超市。
试验动物为2 只健康的新西兰大耳白兔,雄性,6 周龄,体重约为 1.5 kg。
1.2 完全抗原的合成与鉴定
选用BSA 和OVA 作为载体,采用活泼酯法将FLU 与载体进行偶联,制备免疫原FLU-BSA 和包被原FLU-OVA。
采用紫外分光光度法和变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法对获得的偶联物进行鉴定。
1.3 氟甲喹多克隆抗体的制备与纯化
以FLU-BSA 为免疫原,免疫新西兰大耳白兔,在颈背部皮下六点和大腿肌肉两点注射,一共免疫6 次。第六次加强免疫10 d 之后,心脏取血,采用间接竞争ELISA 法测定抗血清的效价和亲和力[20]。
采用ProteinA-Sepharose 4B 凝胶柱层析法对抗体进行纯化[21],并采用紫外分光光度法和间接竞争ELISA法鉴定抗体的纯化效果。
1.4 胶体金及金标抗体的制备
1.4.1 胶体金的制备及质量鉴定
采用柠檬酸三钠还原法制备胶体金[22]。
先通过肉眼观察胶体金溶液的透明度和颜色以及是否有漂浮物,初步判断其质量。量取3 mL 的胶体金溶液,在450 nm~600 nm 范围内进行紫外扫描,确定其最大吸收峰的波长,并对金颗粒的大小做出初步的估计。
1.4.2 胶体金与FLU 抗体结合最适pH 值的确定
分别用0.1 mol/L K2CO3或0.1 mol/L HCl 将胶体金溶液的 pH 值调节为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0(为了防止胶体金堵塞pH 计的电极,故用精密pH 试纸进行测定);取100 μL 上述溶液,分别添加到酶标板的孔里,再向每孔中加入0.5 mg/mL 的氟甲喹抗体6 μL,同时设对照组,混合均匀后室温下静置15 min;每孔添加20 μL 的10%NaCl 溶液(对照组添加等体积去离子水),混合均匀,525 nm 波长处测定OD 值。
1.4.3 胶体金标记最佳抗体加入量的确定
用硼酸盐缓冲液将抗体稀释到0.5 mg/mL,依照表3 的方法确定稀释后抗体的加入量,对照管中只加硼酸盐缓冲液。于525 nm 处测吸光值,绘制吸光值-抗体量曲线。曲线发生转折处所对应的抗体量即是需要的抗体量;在此基础上增加10%~20%,即是使1 mL 胶体金溶液稳定实际所需要抗体的最小量。稳定胶体金溶液所需氟甲喹抗体量的优化方案见表1。

表1 稳定胶体金溶液所需氟甲喹抗体量的优化方案Table 1 Optimization methods of FLU antibody quantity for stabilizing colloidal gold solution
将稀释后抗体、硼酸盐缓冲液和胶体金溶液混合均匀后,静置 5 min,分别加入 100 μL 10%NaCl,混合均匀后静置10 min,于525 nm 下测吸光值。
1.4.4 金标抗体的制备
于磁力搅拌下,逐滴地将抗体加入10 mL 胶体金溶液中,搅拌10 min;逐滴加入10 % BSA,一直加到溶液中的BSA 浓度达到1%,缓慢地搅拌30 min,4 ℃下静置12 h 过夜。以10 000 r/min 的速度4 ℃离心30 min,将上清液去除,加入金标抗体储存液至原体积的1/10,备用。
1.5 胶体金标记固相膜的制备
固相膜选用硝酸纤维素膜,在其上面分别包被酶标羊抗兔二抗和FLU-OVA 作为C 带(控制线)和T 带(检测线),二者之间间隔5 mm,37 ℃固定15 min,再用5%脱脂乳封闭30 min 后,用含吐温-20 的磷酸盐缓冲液(phosphate buffered saline with Tween 20,PBST)冲洗 3 次,37 ℃干燥后,4 ℃保存。
将金标抗体与待测液混合均匀后,滴加到反应区。观察T 带和C 带的显色,根据显色情况进行检测结果的判断。结果判断如图1 所示。
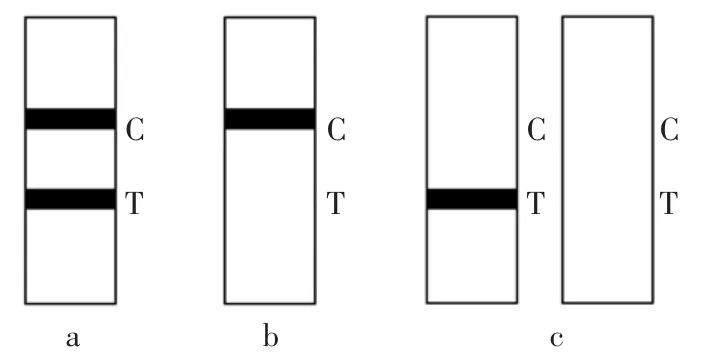
图1 胶体金标记固相膜结果判断Fig.1 Results judgment of colloidal gold labeled solid phase membrane
1.6 胶体金标记固相膜检测条件的优化
1.6.1 封闭液的优化
以1%明胶、1%BSA、1%酪蛋白、5%脱脂乳、5%甘氨酸封闭胶体金标记固相膜,对照则不经任何处理。观察显色情况,选择固相膜的显色条带清晰并且没有背景色的封闭液为优化的结果。
1.6.2 酶标二抗稀释倍数的优化
以0.01 mol/L 磷酸盐缓冲液(0.01 mol/L phosphate buffered saline,1× PBS)溶液稀释酶标二抗,分别稀释20、40、80、160、320 倍,然后将其涂在硝酸纤维素膜上,作为控制线(C 带)。进行显色后,比较C 带与T 带的显色情况。
1.6.3 包被原包被量与金标抗体稀释倍数的优化
用 0.5、1.0、1.5 μg 的包被原在硝酸纤维素膜上包被。用抗体储存液按 1:1、1:5、1:10(体积比)的比例将免疫金稀释后,滴加到包被区,观察显色情况,比较显色的强弱。
1.6.4 氟甲喹标准品与金标抗体混合比例的优化
将免疫金分别与浓度为 0、20、40 μg/L 的氟甲喹标准溶液按照 1 ∶1、1 ∶5、1 ∶10(体积比)混合,滴加到包被区进行显色。
1.7 最低检出限的确定
将 0、10、20、40 μg/L 的氟甲喹标准品分别与金标抗体混合,反应5 min 后,再与包被原进行竞争反应,观察显色情况,与空白对照相比,出现明显色差时所对应的最小浓度即为最低检出限。
1.8 实际样品的测定
1.8.1 样品的基质消除
准确称取牛奶(脱脂后的)、虾肉、牛肉、猪肉、生猪肝、熟猪肝样品各1.0 g,加入6 mL 1%的乙酸乙腈溶液,超声处理5 min 后,3 500 r/min 离心5 min。取上清液加入3 mL 的正己烷,涡旋混匀1 min,离心5 min,取下层的液体过0.22 μm 有机滤膜后,备用。
用0.01 mol/L 磷酸盐缓冲液(0.01 mol/L phosphate buffered saline,1×PBS)将样品提取液分别稀释 0、10、20、40、80 倍,用胶体金标记固相膜进行测定,观察显色情况,找出背景颜色与对照颜色接近时样品提取液的稀释倍数,确定样品基质消除的最佳方法。
1.8.2 样品的加标回收测定
分别向牛奶(脱脂后的)、虾肉、牛肉、猪肉、生猪肝、熟猪肝等6 个样品中,加入3 个不同浓度水平的氟甲喹标准品溶液,按1.8.1 进行基质消除,使稀释后的最终浓度为0、40、60 μg/L,用胶体金标记固相膜测定结果。
2 结果与分析
2.1 完全抗原的鉴定
2.1.1 紫外分光光度法
由FLU 半抗原、载体蛋白BSA、OVA 及其偶联物FLU-BSA、FLU-OVA 的紫外光谱图可知,FLU 与载体蛋白BSA、OVA 发生偶联后,得到的产物FLU-BSA 和FLU-OVA 的紫外扫描光谱图与 FLU、BSA 和 OVA 的紫外扫描光谱图相比,吸收曲线发生了变化,最大吸收峰的吸光值增加了,这证明载体蛋白上连接上了一定量的FLU 半抗原。
2.1.2 SDS-PAGE 分析法
通过载体蛋白与抗原偶联的电泳结果可知,FLUBSA 的条带略滞后于BSA 条带,FLU-OVA 条带也略滞后于OVA 条带。SDS 使蛋白质的结构发生变化,形成蛋白质亚基,蛋白质亚基的迁移率主要取决于其分子量,而可以忽略电荷的影响。分子量大的迁移率小,反之则大[21]。由此即可判断,人工合成完全抗原分子量比载体蛋白分子量大,说明人工抗原合成成功。
2.2 氟甲喹多克隆抗体的制备及纯化
2.2.1 抗血清效价的测定
抗血清效价随着免疫次数的增加而呈现出明显的上升趋势,从第一次取血到最后一次心脏取血,抗血清效价均从1 600 升高到较高的12 800。
2.2.2 抗血清亲和力测定
图2 为4 次取血后测定的抗血清亲和力的变化图。
由图2 可以看出,随免疫次数增多,FLU 的抑制率逐渐增大,IC50从 19.79 μg/mL 降低至 0.213 ng/mL。
2.2.3 抗血清纯化及纯化效果鉴定
抗体纯化曲线见图3。
经过计算得出,纯化后抗体的浓度为0.64 mg/mL。图4 为抗血清在纯化前和纯化后的紫外扫描图。
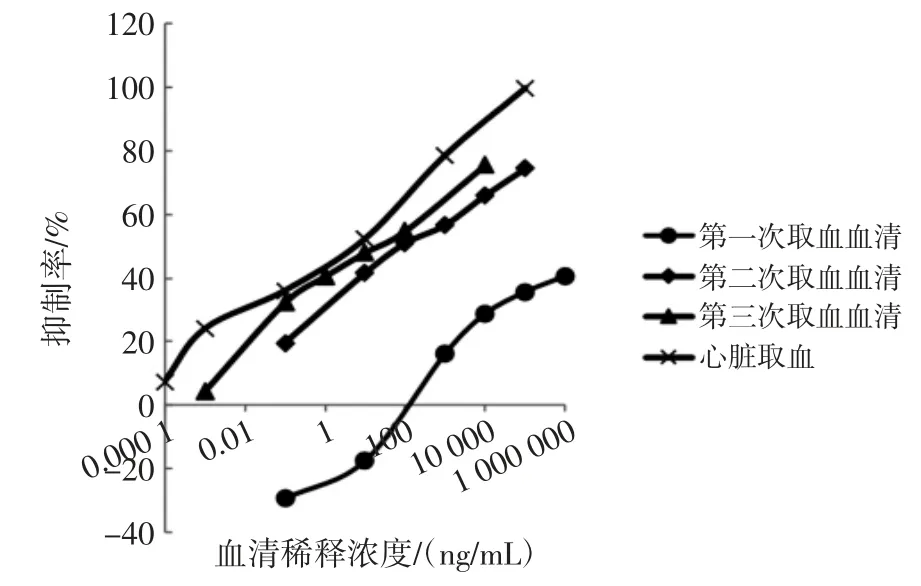
图2 抗血清亲和力的变化图Fig.2 Changes of antiserum affinity

图3 ProteinA-Sepharose-4B 凝胶柱层析法纯化抗血清的色谱图Fig.3 Antiserum purification by ProteinA-Sepharose-4B column chromatography

图4 抗血清在纯化前和纯化后的紫外扫描图Fig.4 Ultraviolet spectrum of antiserum before and after purified
从图4 可看出,在纯化前的抗血清紫外扫描图中,出现在波长415、537 nm 和578 nm 处的峰是由抗血清中影响抗原抗体特异性反应的杂质(例如血红蛋白、脂类、维生素以及无机物)所形成的;而在纯化后的抗血清紫外扫描图中,杂质峰消失了,只有280 nm 波长处存在一个明显的蛋白质吸收峰。这说明,抗血清经过纯化后得到的抗体蛋白较为单一。图5 为抗血清纯化前和纯化后的亲和力变化图。

图5 抗血清纯化前和纯化后的亲和力变化图Fig.5 Changes of antiserum affinity before and after purified
从图5 可以看出,经过纯化后,抗血清与抗原的亲和力得到了显著的提高,灵敏度IC50和检测限IC15均显著地降低。这说明,抗血清纯化能够明显增强抗原和抗体的特异性反应。
2.3 胶体金的质量鉴定
通过肉眼观察,制备的胶体金无杂质,表面无漂浮物,澄清透明,呈酒红色。可以初步判断,胶体金颗粒大小比较均匀,质量比较好。
由胶体金溶液的紫外光谱图可知,在525 nm 处有最大吸收峰。根据最大吸收波长(y)与金颗粒直径(x)的线性回归方程y=0.427 1x+514.56[22],计算出胶体金颗粒直径为24.4 nm。
2.4 胶体金与FLU抗体结合最适pH值的确定
图6 为与抗体结合的胶体金溶液pH 值范围的优化结果。

图6 胶体金溶液pH 值范围的优化Fig.6 Optimization of pH of colloidal gold
当pH 值大于或等于7.0 时,吸光值趋于稳定。一般认为,在大于等于等电点时,被标记的蛋白质呈现电中性,表面张力最大,而且不易聚集,最容易形成牢固的胶体金-蛋白质复合物,使胶体金处于稳定的状态,电解质不能将它破坏。所以,确定标记抗体所用胶体金的pH 值为9.0。
2.5 胶体金标记最佳抗体加入量的确定
图7 为抗体用量的优化试验结果。

图7 抗体蛋白用量的优化Fig.7 Optimization of antibody protein dosage
与目测的结果一致,当抗体用量<12 μg 时,有很多游离的金颗粒存在于溶液中,氯化钠产生的盐离子效应会使胶体金溶液由红变蓝、出现沉淀;当抗体用量≥12 μg 时,胶体金溶液始终保持红色,且没有沉淀产生,吸光值趋于稳定。故选择氟甲喹抗体的加入量为12 μg,在此基础上增加20%,确定为实际的抗体需要量。
2.6 胶体金标记固相膜检测条件的优化
2.6.1 封闭液的优化
从胶体金固相膜封闭液的优化结果可以看出,没有进行封闭处理的NC 膜在显色后,条带较宽;经5%甘氨酸处理的显色条带宽且背景色深;经1%BSA 封闭处理的几乎看不到显色条带,背景色很深;经1%明胶和1%酪蛋白封闭的显色及背景的颜色都比较浅;经5%脱脂乳封闭的NC 膜在显色后,条带颜色很鲜明,且基本上无背景色。而以5%脱脂乳作为封闭液,成本较低且易于取得,因此,本试验的封闭液确定选用5%脱脂乳。
2.6.2 酶标二抗稀释倍数的优化
从酶标二抗的稀释倍数优化结果可以看出,随酶标二抗稀释倍数增大,C 线的显色变得越来越浅,直至肉眼看不出来。当酶标二抗稀释40 倍时,C 线的显色与T 线接近,容易判断结果。当酶标二抗稀释20 倍时,可以明显地看出,C 线的显色比T 线深;当酶标二抗稀释倍数过大时,C 线的显色明显地比T 线浅,则梯度差距不大,均不利于结果的判断。所以,酶标二抗的最佳稀释倍数选定为40。
2.6.3 包被原包被量与金标抗体稀释倍数的优化
包被原包被量及金标抗体稀释倍数直接影响到固相膜的显色,需进行优化。其优化的结果见表2。
从表2 可以看出,包被原包被量为0.5 μg 时,检测线显色偏浅,说明结合的金标抗体比较少;包被原包被量为1.5 μg 时,检测线显色则偏深;包被原包被量为1.0 μg 时,检测线显色较为理想,所以选择包被量为1.0 μg。金标抗体稀释倍数为5 时,所有包被量的固相膜显色均较为理想。因此,确定包被原包被量1.0 μg、金标抗体稀释5 倍为最优。
2.6.4 氟甲喹标准品与金标抗体混合比例的优化
当金标抗体与氟甲喹标准品溶液的混合比例为1 ∶1(体积比)时,检测线的颜色及背景的颜色都比较深,对于不同浓度的氟甲喹标准溶液,看不出明显的差异,不易观察和判断;当金标抗体与氟甲喹标准品溶液的混合比例为1 ∶10(体积比)时,尽管检测灵敏度提高了,但显色整体上都比较浅,也不易观察和判断。而当金标抗体与氟甲喹标准品溶液的混合比例为1 ∶5(体积比)时,都容易进行观察和判断。因此,确定金标抗体与样品溶液的混合比例为1 ∶5(体积比)。
2.6.5 最低检出限的确定
在优化的条件下,用试验制备的胶体金标记固相膜对氟甲喹进行测定,检测结果见图8。

图8 固相膜检测结果Fig.8 Detection result of the solid phase membrane
由图8 可以看出,随氟甲喹浓度逐步提高,检测线的颜色逐步变得越来越浅;氟甲喹浓度<40 μg/L 时,虽然可以看见T 线的颜色,但其颜色与空白对照相比,无法通过目测区分开;当氟甲喹浓度≥40 μg/L 时,T线的颜色变浅,能够通过目测将T 线的颜色与空白对照的颜色区分开。因此,该胶体金标记固相膜对氟甲喹的检出限为40 μg/L,比文献报道的基于多克隆抗体的固相膜检测方法的检出限低[18-19]。
2.7 样品的基质消除
用1×PBS 缓冲液将生鲜的猪肉、牛肉、虾肉的提取液稀释20 倍,将牛奶、生猪肝、熟猪肝的提取液稀释40 倍后,固相膜的显色条带很清晰,并且没有背景颜色,其显色效果接近对照的显色效果,说明消除了基质影响。
2.8 样品的加标回收测定
分别向牛奶(脱脂后的)、虾肉、牛肉、猪肉、生猪肝、熟猪肝等 6 个样品中加入 0、10、20 μg/kg 的氟甲喹标准品溶液,进行加标回收测定,结果见图9。

图9 6 种样品的氟甲喹添加回收测定结果Fig.9 Detection results of recovery of FLU in six kinds of samples
通过肉眼观察可知,所有的样品都可以看到明显的显色梯度,说明建立的胶体金标记固相膜免疫检测方法有效,适用于现场的快速检测筛查。
3 结论
本研究制备了氟甲喹多克隆抗体,建立了动物性食品中氟甲喹残留的胶体金标记固相膜免疫检测方法,对氟甲喹的最低检出限为40 μg/L。该方法不需要任何仪器,目测结果,时间较短,适用于现场大批量样品的快速检测和筛选。
