MnO2@ZnO/C复合材料的制备及电化学性能
2020-03-23罗志刚陈大勇黄守双胡张军陈志文
罗志刚,李 琦,陈大勇,黄守双,胡张军,陈志文
(上海大学环境与化学工程学院,上海200444)
随着传统汽车企业电动化战略布局的展开,以及各国禁售燃油车日程表的提出,电动汽车的发展趋势已不可阻挡.与此同时,电动汽车的快速发展对于续航里程也有着更高的要求[1].众所周知,汽车电动化将带来巨大的电池需求量,这就意味着能量密度竞争赛开跑,而动力电池的有效利用依赖于高效的电化学储能技术[2-3].2016年,我国新增投运的电化学储能项目几乎全部使用锂离子电池和铅蓄电池,两类技术的新增装机占比分别为62%和37%.作为已经工业化生产的二次电池代表,锂离子电池表现出许多优势:较高的能量密度、较低的自放电率、环境友好等[4-7].近年来,锂离子电池负极材料的研究呈逐年上升趋势,工业的快速发展需要更加稳定和高效的电极材料产品.现阶段的石墨负极虽然实际比容量接近理论比容量[8-9],但仍难满足现代生活对高能量密度和高功率密度存储装置的要求.而过渡金属氧化物有着较高的能量密度和功率密度[10-12],是替代石墨负极材料的理想选择之一[13-15].但是,过渡金属氧化物存在一个明显的缺点就是导电性较差,这极大地限制了其进一步应用.同时,在充放电循环过程中这类材料会与锂反应而产生较大的体积膨胀效应,使得活性物质粉末化而出现活性物质团聚现象.因此,设计独特的纳米结构是提高过渡金属氧化物电极材料电化学性能的一种重要手段,目前对过渡金属氧化物进行的目的性改性措施主要有纳米化和复合化.
金属有机骨架(metal-organic frameworks,MOFs)化合物是通过配位键将有机配体和金属中心离子结合而形成的化合物[16-17].MOFs化合物不仅可以选择中心离子,还可以调控功能化的官能团,因此可以根据目的设计合理的化合物结构.MOFs化合物凭借其较大的比表面积、较高的孔隙率及品种的多样性[18-19],引起了各领域研究者的广泛关注.MOFs化合物应用范围包括气体吸附/分离[20-22]、多相催化反应、药物释放和光敏传感器[23-25]等.为了进一步推进MOFs材料的应用进程,采用牺牲模板将其转化为稳定性更高的纳米材料,然后作为能量存储装置中的活性物质.由于有机配体中含有氮等非金属元素,因此将MOFs化合物直接在高温下碳化并去除金属成分后,可以得到具有杂质原子掺杂结构的多孔碳材料[26-27].多孔碳材料有着很多突出的优点,同时也是热门的锂离子电池电极材料研究对象.将氮原子掺杂到材料内部后能进一步提高材料的电荷密度[28-31],通过这样的处理可改变电子在材料内部的传递性能.另外,MOFs含有金属成分,在高温条件下氧化可以得到具有多孔结构的金属氧化物[18].在氧气不足的情况下在高温环境里还会有碳的生成.使用MOFs作为前驱体,通过煅烧、硫化等实验手段制备的过渡金属氧化物或硫化物材料在锂离子电池中表现出了优异的性能.Lin等[32]将制备的[Cu3(btc)2]n在350◦C的空气条件下进行热处理,得到具备多孔表面的Cu2O/CuO复合材料,在250次充放电循环后比容量维持在740 mA·h·g−1,电性能对比单纯CuO有明显提升.Kong等[15]采用微波辅助水热法,合成了一种球形的Ni-MOF结构,将其在空气中高温处理形成了一种核壳状的Ni,中间的NiO核和外面的NiO壳层间存在间隙,该材料凭借独特的结构在储锂方面表现突出.该结构能防止材料在长时间使用后出现大面积的结构变化,从而提高电极材料的使用寿命和安全性.
本工作以β-MnO2纳米线(nanowire,NW)为模板,制备了MnO2@ZIF-8 NWs复合结构,基于牺牲模板的思路在保护气的氛围下煅烧得到MnO2@ZnO/C纳米复合材料,该材料是一种碳包覆的双层金属氧化物结构纳米复合材料.由于有机配体的存在,当在高温条件下煅烧时,有机配体会在热分解的过程中继续阻隔中心金属离子,避免因空间骨架的坍塌而出现团聚现象.因此,合成的复合材料在电化学过程中由于高度分散、粒径均匀而表现出良好的性能.同时,碳的存在可以提供更大的比表面积和更多的锂离子插入活性位点,允许离子/电子的快速扩散,并促进电解质的渗透,从而达到了进一步提升复合材料电化学性能的目的.
1 实验材料的合成
β-MnO2的合成:将375 mL KMnO4水溶液(浓度为10 mol/L)和200 mL C4H8O2放入500 mL容量的圆底烧瓶中,在85◦C的水浴回流条件下至KMnO4粉红色完全消失;然后将上述物质保持在90◦C的水浴锅中,回流120 h,冷却至室温;经过转速6 000 r/min离心,在离心管底部产生棕褐色沉淀,用蒸馏水和甲醇洗涤3次,干燥得到样品.
MnO2@ZIF-8 NWs的合成:首先把0.6g聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)加入50 mL β-MnO2NWs的甲醇溶液(0.4 mol/mL)中,搅拌10 min后不作任何处理;随后将25 mL六水合硝酸锌甲醇溶液(0.1 mol/L)加入上述溶液中,再快速倒入25 mL2-甲基咪唑(methylimidazole,MeIm)的甲醇溶液(0.8 mol/L),在室温条件下磁力搅拌2 h后离心(6 000 r/min,10 min)收集产物,用甲醇洗涤数次;最终,将样品置于冷冻干燥机中干燥48 h.
MnO2@ZnO/C复合材料的合成:取适量MnO2@ZIF-8 NWs棕色粉末放入石英舟中,在氮气保护的条件下置于管式炉中以0.5◦C/min的升温速率将温度升至400◦C,保温2 h;然后转移上述样品到马弗炉中以0.5◦C/min的升温速率升温至400◦C,当温度稳定之后继续保持2 h;取出样品研磨成粉末状,即为MnO2@ZnO/C复合材料.
2 结果表征与讨论
β-MnO2@ZIF-8 NWs合成流程步骤如图1所示.首先,通过超声处理将均匀的MnO2纳米线分散到甲醇溶液中,加入适量的PVP使MnO2纳米线表面被黏连剂均匀涂覆,随后在室温磁力搅拌的条件下向混合溶液中加入Zn(NO3)2·6H2O的甲醇溶液,之后迅速将MeIm的甲醇溶液加入上述混合溶液中,静置2 h,经过离心冷冻干燥等过程后即得到棕色的MnO2@ZIF-8粉末.
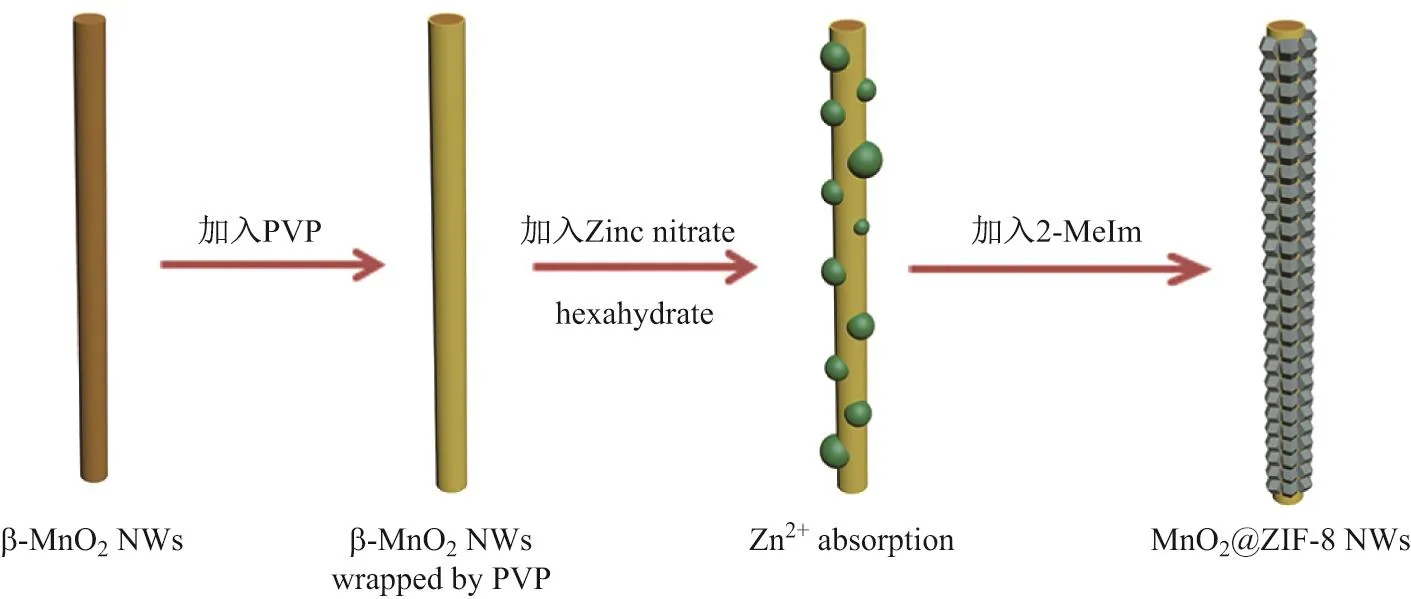
图1 β-MnO2@ZIF-8 NWs合成流程示意图Fig.1 Schematic illustration of the synthetic process of the β-MnO2@ZIF-8 NWs
图2 (a)是 制 备 的β-MnO2NWs、 纯 相ZIF-8和MnO2@ZIF-8的X射 线 衍 射(X-ray dif f raction,XRD)图谱.对于β-MnO2NWs而言, 衍射图谱在2θ=28.68◦,37.32◦,42.80◦,56.65◦和72.3◦的位置有相应的衍射峰,依次是(110),(101),(211),(220)和(112)晶面.得到的MnO2@ZIF-8晶体的衍射峰位置与β-MnO2NWs和ZIF-8的单晶结构衍射图谱对应很好,说明产物具有较高的纯度.傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)进一步证明了ZIF-8的存在(见图2(b)),除MnO2峰外,1 140和754 cm−1处的峰对应咪唑环的弯曲振动信号,位于1 425 cm−1处的峰对应咪唑环的伸缩振动信号,2 925 cm−1处的峰对应芳香族羟基的伸缩振动.这些结果表明MnO2@ZIF-8 NWs前驱体已成功制备.
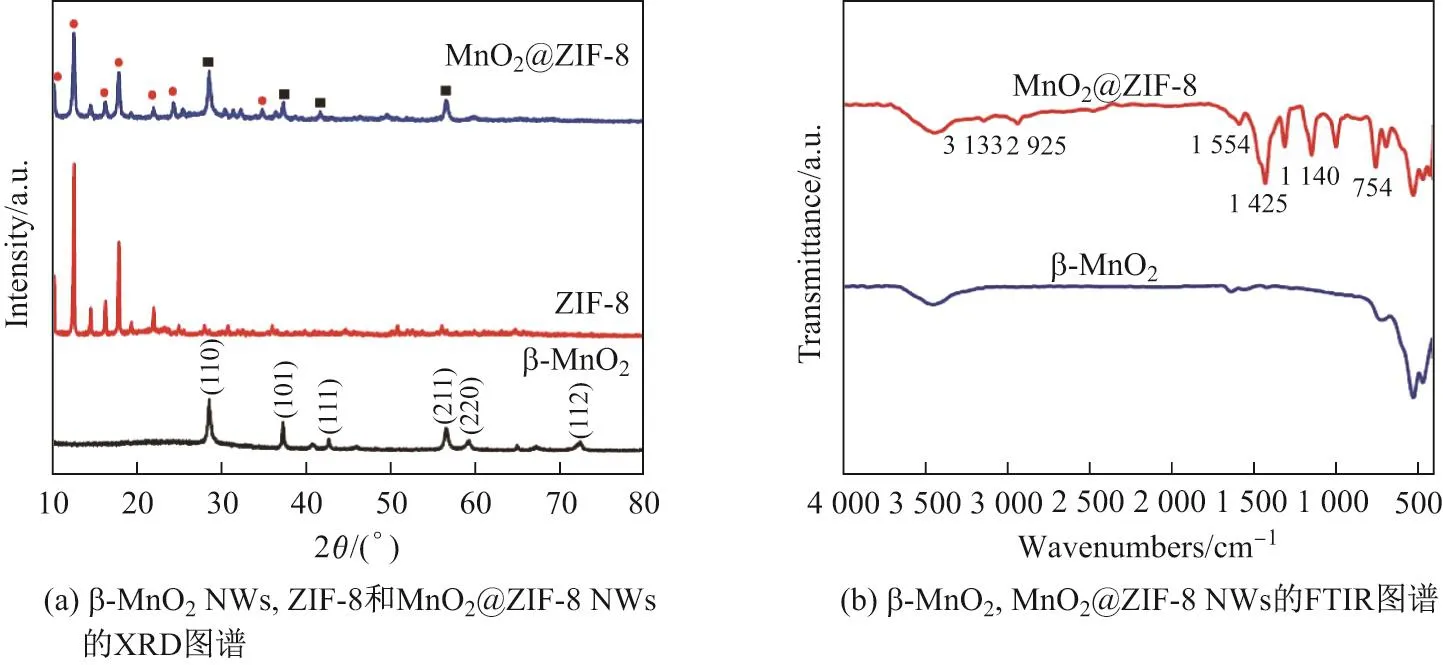
图 2 β-MnO2NWs,ZIF-8和MnO2@ZIF-8 NWs的XRD图谱以及β-MnO2和MnO2@ZIF-8 NWs的FTIR图谱Fig.2 XRD patterns of β-MnO2NWs,ZIF-8 and MnO2@ZIF-8 NWs,and FTIR spectra of β-MnO2and MnO2@ZIF-8 NWs
对所制备的β-MnO2NWs,ZIF-8和MnO2@ZIF-8 NWs利用场发射扫描电子显微镜(field emission scanning electron microscopy,FESEM)和透射电子显微镜(transmission electron microscopy,TEM)测试,结果如图3所示.从图(a)中可以看出,MnO2纳米线表面光滑,平均直径为100 nm,并且未观察到其他形貌的存在;图(b)清楚地表明,ZIF-8是一种多面体结构,尺寸一致;图(c)和(d)分别是MnO2@ZIF-8 NWs的SEM和TEM图,由于Zn2+在β-MnO2纳米线表面被固定,ZIF-8表面的MeIm与Zn2+的相互作用力使得Zn2+被固定,进而只能在β-MnO2纳米线表面成核、生长,从而获得MnO2@ZIF-8 NWs复合结构.在最佳合成条件下,ZIF-8纳米晶体可以被诱导和附着在MnO2NWs的外表面形成纳米纤维结构体.从图(c)和(d)中可以观察到β-MnO2纳米线表面均匀生长着ZIF-8晶体壳,呈糖葫芦状,基本表现出了良好的均一性.但从TEM图中可以看出仍有少数几个单一的ZIF-8晶体存在,原因可能是在第一步合成过程中少数Zn2+没有附着在纳米线的表面,导致最后单独生长成ZIF-8晶体.
图4(a)是MnO2@ZnO/C NWs纳米复合材料的SEM图,可见复合材料直径约1µm,从图中可以看到经退火处理后得到的MnO2@ZnO/C NWs纳米复合材料继承了MnO2纳米线的线形结构,结构并没有遭到明显破坏.图(b)和(c)是MnO2@ZnO/C NWs在不同放大倍数下的TEM图,从图中可以清楚地看出,ZnO/C纳米粒子很好地负载在β-MnO2纳米线上,经退火处理后ZIF-8的有机配体发生分解并产生碳层.碳的存在可以提供更大的比表面积和更多的锂离子插入活性位点,允许离子/电子快速扩散,并促进电解质的渗透.图(d)是MnO2@ZnO/C NWs的XRD图谱,合成的MnO2@ZIF-8纳米线在高温下退火并转化为ZnO/C纳米粒子包覆的MnO2纳米线复合结构,图中的红线和蓝线分别代表MnO2和ZnO的XRD图谱,可以看到两种物质都有着较高的结晶度,分别与标准PDF卡片比对后显示出了高度的重合性,与图(a)和(b)相对应.以上结果表明,本工作成功地通过模板法制备了碳包覆的双层金属氧化物结构纳米复合材料.

图 3 β-MnO2NWs,ZIF-8和MnO2@ZIF-8 NWs的SEM图以及MnO2@ZIF-8 NWs的TEM图Fig.3 SEM images of β-MnO2NWs,ZIF-8 and MnO2@ZIF-8 NWs,and TEM image of MnO2@ZIF-8 NWs
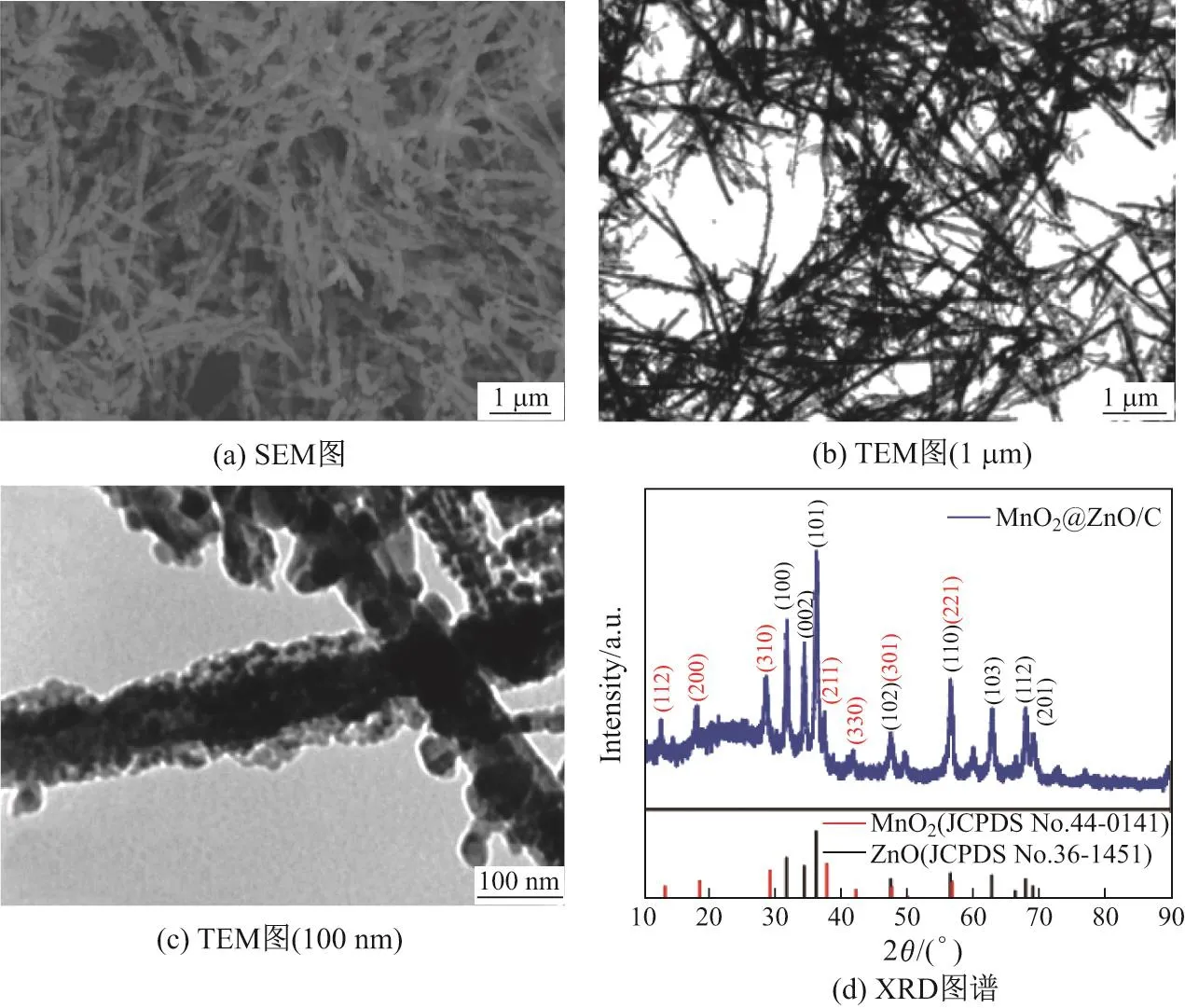
图4 MnO2@ZnO/C NWs的SEM图,不同放大倍数下的TEM图以及XRD图谱Fig.4 SEM image,TEM images at dif f erent magnifications and XRD patterns of MnO2@ZnO/C NWs
为了确定MnO2@ZIF-8 NWs转化为MnO2@ZnO/C NWs的煅烧温度,在氮气条件下进行ZIF-8的热重(thermal gravimetric,TG)分析.如图5(a)所示,250◦C之前的重量损失(约1%)是样品中水分的蒸发,然后初始化ZIF-8的氧化生成ZnO并释放气体.由于ZIF-8的快速分解,在250∼500◦C范围内有明显的重量损失(约48%).当温度达到550◦C时,ZIF-8完全转化为ZnO/C.拉曼光谱进一步证明了MnO2@ZnO/C复合结构中碳的存在.如图(b)所示,在1 312和1 586 cm−1处的特征峰分别代表无序化石墨碳的特征典型D峰和G峰.可以计算出MnO2@ZnO/C的D峰和G峰的峰强比IG/ID=1.2,峰强比IG/ID可以用来表征石墨化碳区域的大小和无序化程度.从拉曼图谱中可以看出,复合材料具有缺陷和无序的结构,可以提供更多的储Li+位点,从而有效提高比容量和循环稳定性.
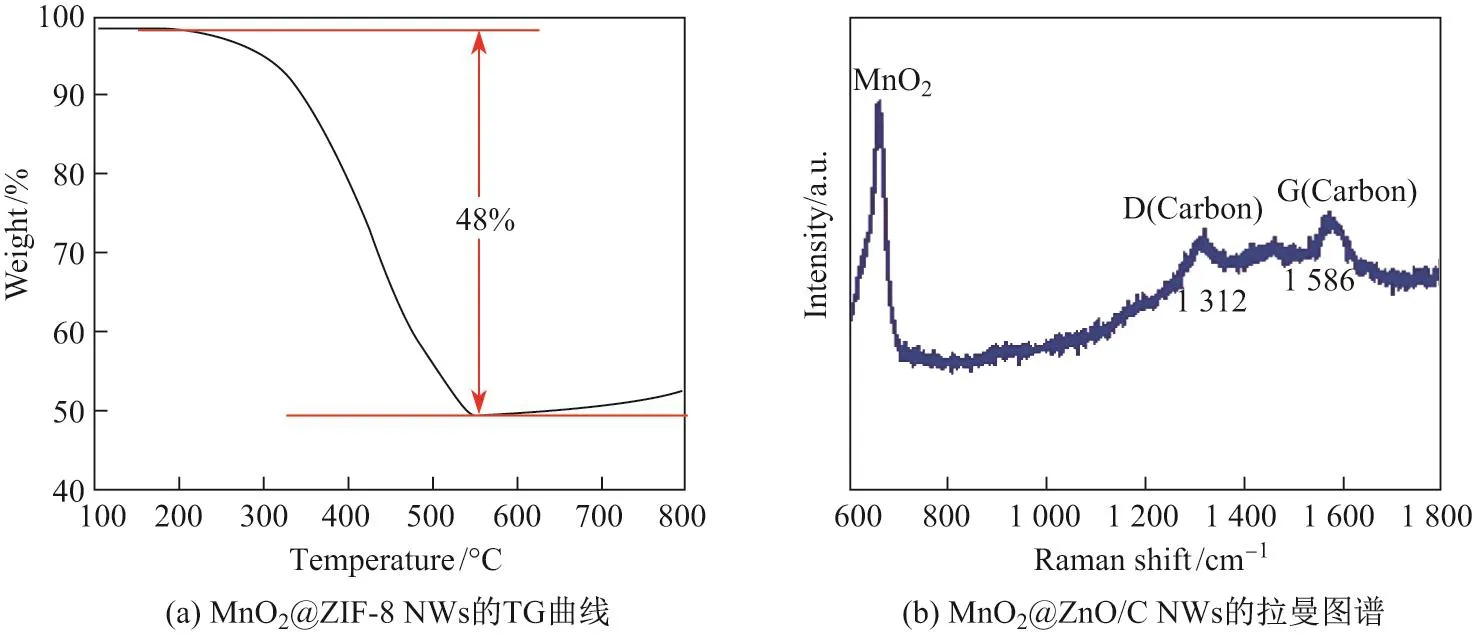
图5 MnO2@ZIF-8 NWs的TG曲线和MnO2@ZnO/C NWs的拉曼图谱Fig.5 TG curve of MnO2@ZIF-8 NWs and Raman spectrum of MnO2@ZnO/C NWs
用MnO2@ZnO/C和MnO2作为锂离子电池的负极材料,对电池进行电化学性能测试,结果如图6∼9所示.从图6中可以观察到,第一次放电比容量为1 873 mA·h·g−1.与其他电极材料一样,MnO2@ZnO/C在初次循环中表现出较低的库仑效率(47.6%),原因是氧化还原过程中固体电解质界面(solid electrolyte interface,SEI)膜的形成. 图7详细列出了MnO2和MnO2@ZnO/C在0.1 A/g电流密度下的循环表现.纯相的MnO2循环性能不够稳定,在电流密度为0.1 A/g下循环100次后比容量降低到200 mA·h·g−1以下.MnO2@ZnO/C则展示出了优异的循环稳定性,在相同电流密度下循环100次后比容量可以保持在658 mA·h·g−1.对比纯相的MnO2,MnO2@ZnO/C充放电循环性能有显著的提升.图8显示了MnO2@ZnO/C前3次充放电的循环伏安(cycle voltammetry,CV)曲线,可以清楚地观察到第一次放电过程中在0.38和1.25 V出现两个还原峰.而在1.25 V处峰的出现对应于复合材料形成了SEI膜,造成了第一次循环中不可逆的容量损失.在随后的两个循环中,两条曲线较好地重合,表现出良好的循环稳定性,而主阴极峰开始转移到较低的电位,表明发生了不可逆的相变过程.图9是MnO2@ZnO/C在不同电流密度下的循环性能,从图中可以看到分别对应986,815,706,565,475和329 mA·h·g−1,当电流密度减小到0.1 A/g时,仍旧能保持在较好的比容量水平(608 mA·h·g−1).
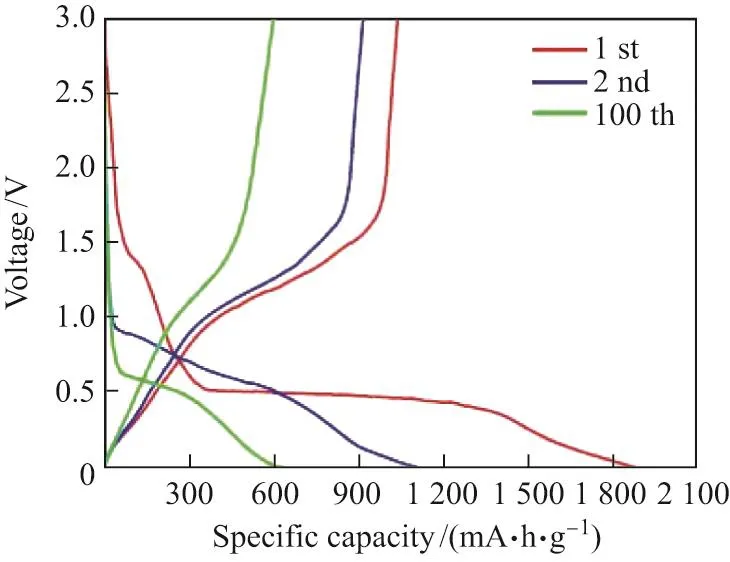
图6 MnO2@ZnO/C的充放电曲线Fig.6 Charge-discharge curves of MnO2@ZnO/C

图7 MnO2和MnO2@ZnO/C在相同电流密度下的循环性能Fig.7 Cycling performance of MnO2@ZnO/C and pure MnO2at same current density
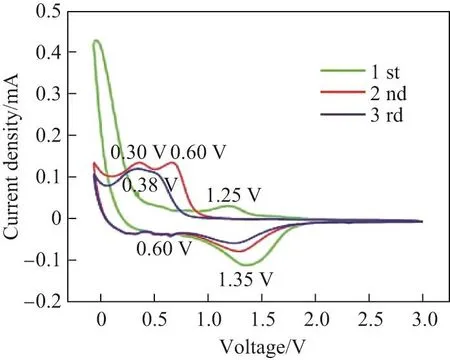
图8 MnO2@ZnO/C在0.01∼3.00 V时的CV曲线Fig.8 CV curves of MnO2@ZnO/C between 0.01 and 3.00 V

图9 MnO2@ZnO/C在不同电流密度下的循环性能Fig.9 Cycling performance of MnO2@ZnO/Cat dif f erent current densities
为了进一步评价MnO2@ZnO/C NWs复合材料作为锂离子电池电极材料的应用前景,进行了国内外相关高能量密度和高功率密度存储装置性能对比的调研.表1列举了几种通过典型的MOFs材料作为前驱体,在不同煅烧温度条件下制备的特殊结构的复合材料用作电极材料的电性能对比,表中CN/CNTs(carbon nanotubes)代表碳纳米管,BTC(benzene-1,3,5-tricarboxylic acid)代表均苯三甲酸,NC(nitrogen-doped carbon)代表氮掺杂碳.这些复合材料和本工作所制备的复合材料类似,都是通过以MOFs化合物为前驱体,制备不同成分和空间结构的多元复合材料.从表中可以看出,本工作制备的MnO2@ZnO/C NWs复合材料相对于其他材料表现出了较高的首次放电比容量,但在长时间循环后,其电性能表现差强人意.因此,MnO2@ZnO/C NWs复合材料在循环稳定性方面还有较大的提升空间.
3 结束语
综上所述,本工作以回流法制备的MnO2纳米线为模板,成功合成了MnO2@ZIF-8纳米复合材料,然后设计了两步煅烧方法来制备糖葫芦结构的MnO2@ZnO/C纳米复合材料,并通过一系列测试手段来表征产物.MnO2@ZnO/C纳米复合材料的首次放电比容量为1 873 mA·h·g−1,在电流密度为100 mA/g条件下完成100次充放电后比容量稳定在658 mA·h·g−1, 并且经过高电流密度循环后仍能保持608 mA·h·g−1的比容量, 呈现出良好的高倍率稳定性能.在高温作用下,配体ZIF-8中的有机成分被分解并产生孔隙,为锂离子的插入/嵌出提供了更多的转移路径.同时,碳的存在可以为电极材料提供更多的锂离子插入活性位点和更大的比表面积,并促进电解质的渗透,而且还具有导电性好、锂离子扩散路径短等特点.这一系列因素使得MnO2@ZnO/C纳米复合材料在电化学方面有良好的表现.同时,制备方法新颖简单,可以为制备其他多孔或功能化先进材料提供借鉴.
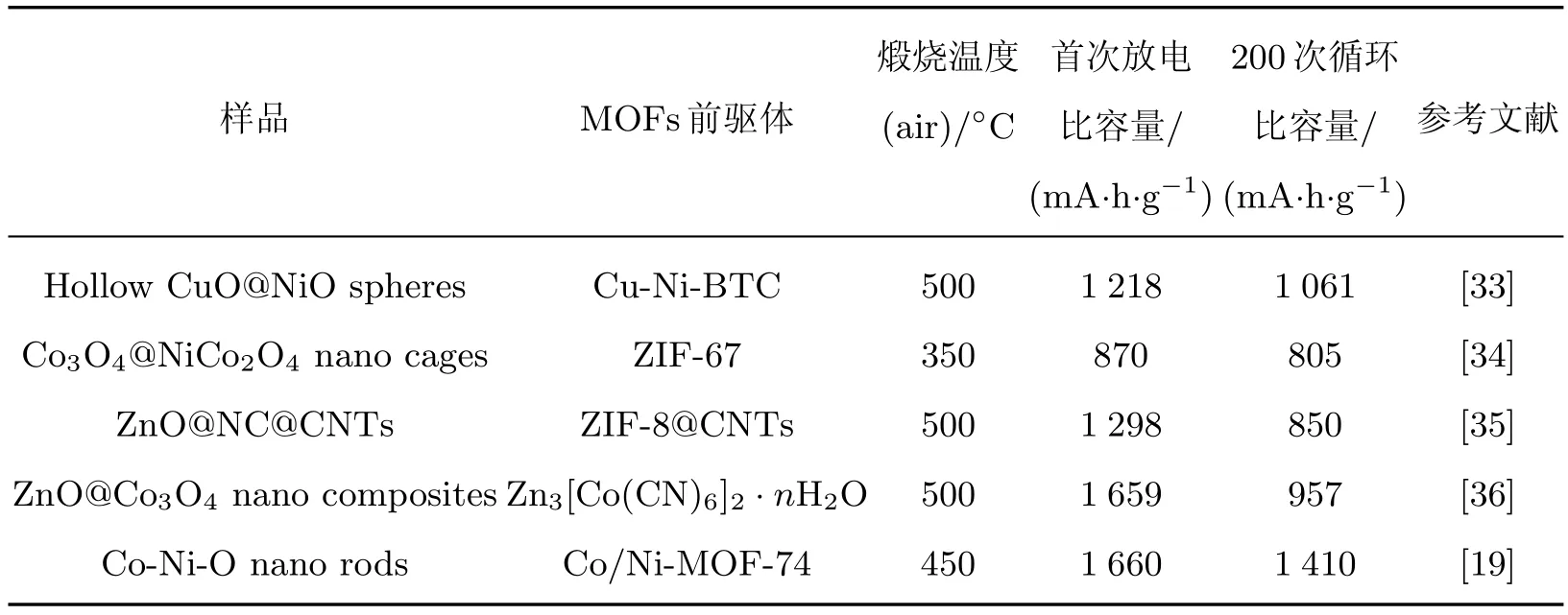
表1 几种典型MOFs前驱体得到的复合材料作为锂电池电极材料的电性能对比Table 1 Comparisons of the electrical properties of several typical MOFs precursors obtained composite material as lithium battery electrode material
