基于高光谱数据的滴灌甜菜叶片全氮含量估算
2020-03-23李宗飞苏继霞李阳阳刘宁宁戴宇祥张开祥王开勇
李宗飞 苏继霞 费 聪 李阳阳 刘宁宁 戴宇祥 张开祥 王开勇 樊 华,* 陈 兵
基于高光谱数据的滴灌甜菜叶片全氮含量估算
李宗飞1苏继霞1费 聪1李阳阳1刘宁宁1戴宇祥1张开祥1王开勇1樊 华1,*陈 兵2,*
1石河子大学农学院, 新疆石河子 832003;2新疆农垦科学院棉花研究所, 新疆石河子 832003
本文旨在明确甜菜叶片全氮含量与高光谱地面植被遥感的定量关系, 建立干旱区甜菜叶片全氮含量精确估测模型, 及时监测甜菜生长状况。本研究选取新疆滴灌甜菜(Beta356)为材料, 利用ASD野外高光谱仪在甜菜叶丛快速生长期、块根膨大期与糖分积累期采集各处理反射光谱, 并同时测定全氮含量, 分析原始光谱反射率及一阶微分光谱反射率与全氮含量的相关性, 并进一步建立光谱特征参数与敏感波段植被指数全氮含量估算模型。结果表明, 光谱特征参数Dr762幂函数下估算模型具有较好估算甜菜叶片全氮含量的能力, 其决定系数2= 0.747, 验证相对误差RE(%)为21.635, 验证均方根误差RMSE为4.914; 通过植被指数与叶片全氮含量建立多种函数估测模型, 其中差值植被指数Dr762–Dr496下一元线性函数具有较好估算甜菜叶片全氮含量的能力, 其决定系数2= 0.794, 验证相对误差RE(%)为23.008, 验证均方根误差为5.372。
全氮; 高光谱; 特征参数; 植被指数; 估算模型
氮素是甜菜生长必不可少的营养元素, 是构成植物体内蛋白质、核酸、叶绿素以及多种酶的主要成分, 直接反映植被营养状况, 在植物光合作用与生长发育中发挥着重要作用[1-2], 因此如何根据作物生长发育状况来判断作物适宜的追肥量, 如何运用不同氮素运筹管理以及氮素水平来合理施肥[3], 快速、无损监测甜菜生长状况, 制定适时适宜施肥方案, 对甜菜生产具有重要意义。
传统氮素营养诊断手段以分析测试为主, 因时效性差, 难以在大面积农业生产中有效应用[4]。与传统方法相比, 高光谱遥感可以得到作物生长发育中生理生态与营养特征等微小特性变化, 实现对目标实时、快速监测[5]。近年来, 国内外学者研究了在不同施氮处理条件下多种作物的光谱反射特性, 发现了作物不同施氮处理条件下光谱反射率的差异性, 并可用具体波段与波段组合来估测氮素含量。Shibayama等[6]在研究水稻叶片光谱特性时发现, 缺氮水稻叶片与正常水稻叶片的光谱特征显著不同。Smith等[7]研究发现对于同一种植物在不同时期氮素的最佳反演波段存在变化。Stone等[8]基于671 nm和780 nm两个波段反射率组合的氮光谱指数对小麦植株的全氮含量进行了估算。Thomas等[9]研究发现550~675 nm波段与氮素含量具有较好相关性, 可用来估测辣椒的氮素含量。Tian等[10]基于不同氮素水平和多个田间试验, 提出3个蓝光波段构建的植被指数R434/(R496×R401)对叶层氮浓度具有较好预测效果。Wang等[11]对归一化植被指数(NDVI)改进, 提出三波段指数(R924–R703+2×R423)/(R924+ R703–2×R423), 有效提高氮素反演精度。Menesatti等[12]利用高光谱数据建立了锦橙LNC的偏最小二乘法估算模型。Zhang等[13]建立了近红外反射光谱与苹果LNC的多元线性回归方程。
在我国, 利用高光谱技术研究作物氮素营养起步较晚, 但发展较快, 目前已经在小麦[14-15]、水稻[16-17]、棉花[18-19]等作物上得到广泛应用, 赵春江等[20]对小麦不同品种、肥水条件下光谱参数变化规律及与植株生化组分关系研究提出, 可用红边振幅和近红外平台振幅来反演小麦叶片全氮含量。王树文等[21]采用回归分析方法对寒地水稻氮素含量建模分析, 发现用特征光谱参数SI (866)、DI (730、715)、DDI (730、715、685)、DDI (866、685、558)可以较好预测氮素含量。陈兵等[22]研究了基于光谱红边参数的棉花黄萎病叶片氮素含量诊断, 发现以Area672为自变量建立的棉叶LNC的诊断模型能较好地诊断黄萎病棉叶LNC。
尽管前人利用光谱变量估测作物农学参数方面已经开展了大量的研究, 但在甜菜上涉及不多, 相关甜菜氮素营养光谱诊断研究较少, 且氮素估算模型方法较为单一。本文以滴灌甜菜为研究对象, 通过筛选甜菜叶片全氮含量敏感波段, 构建叶片全氮含量敏感参数与植被指数, 建立并对比叶片全氮含量的一元线性、二次项、幂函数以及指数函数估算模型, 以期为滴灌甜菜叶片全氮含量监测和氮肥精准管理提供支持。
1 材料与方法
1.1 试验设计
试验于2017年4月至2017年11月在新疆石河子大学农学院试验站(44°31'N, 88°06'E)进行。试验区域耕层土壤为灌溉灰漠土, pH 7.3, 含有机质13.27 g kg-1、全氮0.76 mg kg-1、速效磷22.56 mg kg-1、速效钾157.97 mg kg-1。共设置N0 (0 kg hm-2)、N75 (75 kg hm-2)、N150 (150 kg hm-2)、N225 (225 kg hm-2) 4个施氮水平。施氮比例按照M0 (0∶0∶0)、M1 (10∶0∶0)、M2 (7∶3∶0)、M3 (5∶3∶2) 3种运筹模式, 即分别在甜菜叶丛快速生长期、块根膨大期与块根糖分积累期按比例施入氮肥。采用随机区组设计, 重复3次, 供试甜菜品种为Beta356, 播种日期为4月15日, 试验田内设置30个小区, 小区面积12 m2, 甜菜播种行距50 cm, 株距20 cm。基肥为重过磷酸钙319.5 kg hm-2, 硫酸钾206 kg hm-2。其他按照大田统一管理。
1.2 甜菜冠层光谱数据测定
采用美国Analytical Spectral Device (ASD)公司生产的FileSpecPro FR2500型背挂式野外高光谱辐射仪测定甜菜植株冠层高光谱反射率。该光谱仪波段范围为350~2500 nm, 采样间隔为1 nm, 光谱仪视场角25°, 测量时探头垂直向下, 距离冠层垂直高度约0.5 m, 在测量前均进行白板校正。选择晴朗无云天气, 于当地北京时间12:00—15:00分别在甜菜叶丛快速生长期、块根膨大期、糖分积累期测定光谱反射率, 记录每个光谱测定点5条光谱数据, 每小区测定3次, 取其平均值作为该小区的光谱反射率值。
1.3 全氮含量测定
采用凯氏定氮法测定叶片全氮含量。取光谱测定区域叶片, 105℃杀青30 min后, 调至75℃烘干至恒重, 将烘干样品粉碎过60目筛。用分析天平秤取0.5000 g叶片样品放入消煮管, 采用H2O2-浓H2SO4消化处理后, 将冷却的消煮液置于定氮仪中蒸馏, 利用0.01 mol L-1(1/2H2SO4)标准溶液滴定馏出液由蓝绿色至刚变为紫红色, 记录所用标准酸体积, 根据以下公式计算植株全氮含量。

式中,是0.01 mol L-1(1/2H2SO4)标准溶液浓度,和0分别是滴定试液时所用酸标准溶液的体积与滴定空白时所用酸标准溶液的体积(mL), 0.014为氮的摩尔质量kg mol-1,S为分取倍数, 即定容体积与分取体积之比, 1000为kg与g之间的换算倍数,为烘干株样的质量(g)。
1.4 数据分析
光谱原数据提取和预处理采用FileSpecPro FR2500型背挂式野外高光谱辐射仪自带软件ViewSpec Program, 用Microsoft Excel 2013与SPSS 12.0软件统计分析农学参数数据和光谱数据, 并利用Origin 2018软件制图, 采用MATLAB软件提取甜菜冠层光谱数据的特征参数, 从中提取常用光谱特征“三边”参数; 通过选择已有光谱植被指数作对比, 结合与本试验中全氮含量相关性较好的敏感性波段,构建比值(RVI)、差值(DVI)、归一化比值(NDVI)与红边归一化差异(NDI)光谱植被指数(表1)。
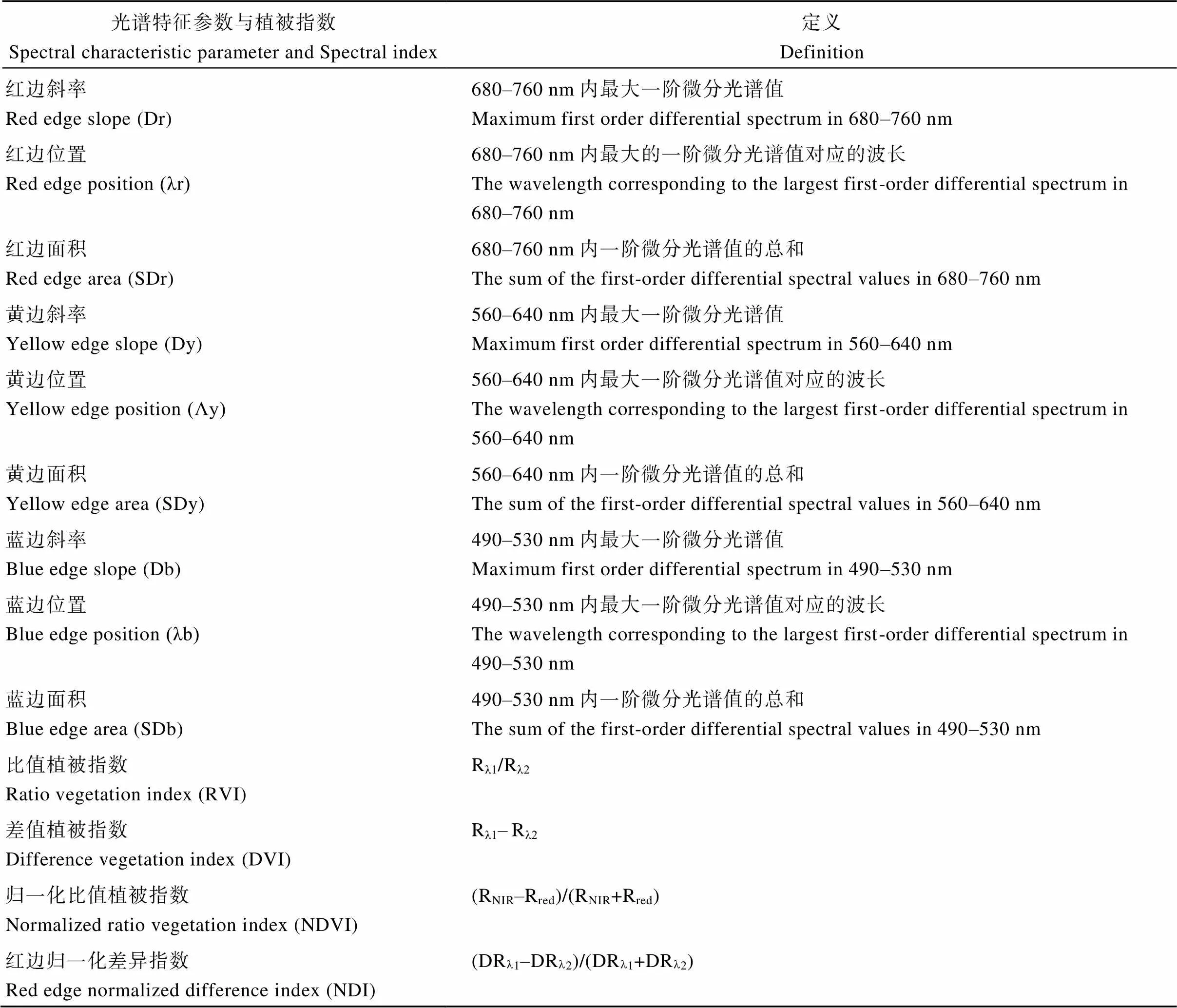
表1 高光谱特征参数及植被指数定义
Rl1与Rl2分别为l1与l2波长处的光谱反射率。
Rl1and Rl2in the equation are the spectral reflectance at wavelengthsl1andl2 .
通过分析光谱特征参数及植被指数与甜菜冠层叶片全氮含量相关性, 建立全氮含量估测模型。本文主要针对甜菜叶丛快速生长期至糖分积累期3个时期进行测定, 甜菜在叶丛快速生长期后基本达到土壤背景全覆盖, 且甜菜自叶丛快速生长期至糖分积累期冠层结构无明显变化, 因此本文选择总样本量用于甜菜叶片全氮含量估算与检验, 根据测定样本数量大小, 将采集样本随机分为2组, 其中建模样本75个, 模型检验样本26个, 通过对比各模型的建模决定系数(2)、均方根误差(RMSE)以及相对误差(RE)筛选出最优模型用以研究新疆滴灌条件下甜菜冠层叶片全氮含量的估算。其中2用以判断模型拟合优度, RE与RMSE用于检验估测模型的可靠程度。
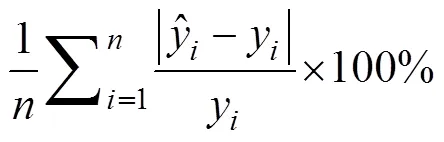
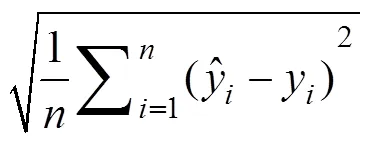
式中,y为试验测定全氮含量真实值,为模型估测全氮含量估测值,为样本数量。
2 结果与分析
2.1 不同氮素水平下甜菜冠层光谱特征分析
通过对不同氮素水平下光谱数据进行平均处理, 由原始光谱曲线图与一阶导数光谱曲线图分析可知(图1), 不同氮素水平下甜菜原始冠层光谱反射率波形趋势相似, 在波段350~670 nm范围内有明显的反射峰与吸收谷, 光谱波形呈现先增高后降低的趋势, 在550 nm附近形成反射小高峰, 均在670 nm附近形成吸收谷, 在波段670~760 nm波段波形变化较为剧烈, 光谱反射率随着波长的增加急剧上升, 形成较大陡坡状波形; 在近红外波段780~1300 nm形成近红外反射平台, 且具有明显的波形变化。施氮处理N75、N150、N225在550 nm处较CK分别降低了7.5%、28.0%、23.0%, 说明各施氮处理相对CK均可提高甜菜植株冠层叶片对红、蓝光的吸收, 提高植株的光合效率, 且施氮处理N150比N75与N225具有更好地提高植株光合效率的作用; 在近红外波段(780~1300 nm)各施氮处理较CK分别增加6.14%~12.6%、14.2%~16.4%、6.82%~18.0%, 各处理之间较容易区分。
由图1可知, 红边与原始冠层光谱图曲线近红外(780~1300 nm)波段基本一致, 各施氮处理之间有明显差异, 且具有“双峰”现象, 说明不同施氮处理对甜菜植株有较大影响, 不同施氮处理除N75红边位置与N0相同, 其他施氮处理均出现“红移”现象, 施氮处理N150、N225较N0均向长波方向移动5 nm, 说明随着施氮量的增加, 甜菜植株冠层单位光合效率有所提高, 但在施氮处理N150后红边位置趋于平稳, 这与原始光谱反射率可见光波段“绿峰”处保持一致。
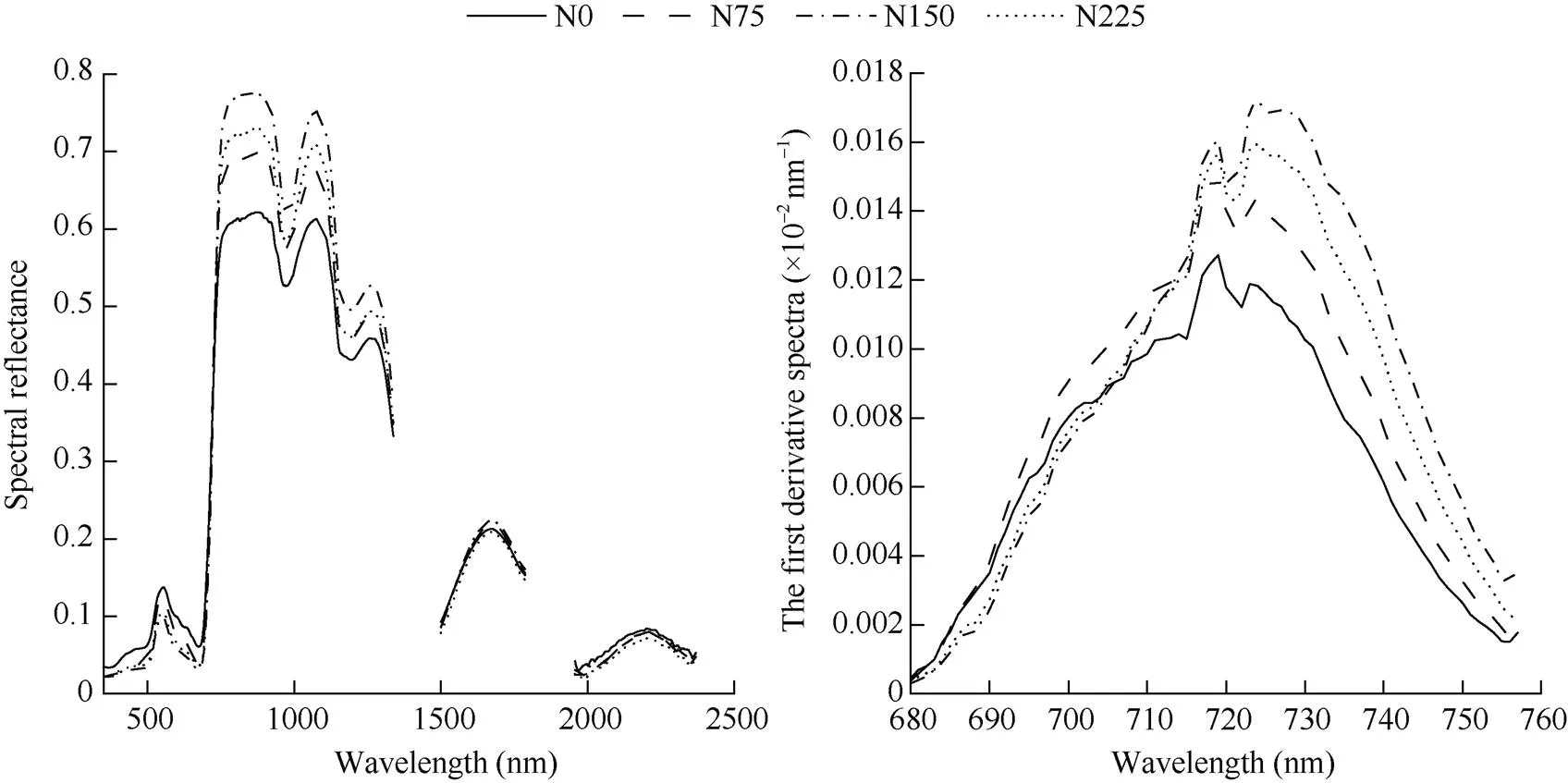
图1 不同氮素水平下高光谱反射率与红边
N0: 施氮0 kg hm–2; N75: 施氮75 kg hm–2; N150: 施氮150 kg hm–2; N225: 施氮225 kg hm–2。
N0: nitrogen application of 0 kg hm–2; N75: nitrogen application of 75 kg hm–2; N150: nitrogen application of 150 kg hm–2; N225: nitrogen application of 225 kg hm–2.
2.2 原始光谱反射率与全氮含量的相关性
结果如图2所示, 冠层光谱反射率与冠层叶片相关性稳定波段主要集中350~1300 nm与1418~ 1809 nm, 由于在1300~2500 nm叶面光谱反射率主要受叶内水含量的控制, 叶内水含量降低, 其光谱反射率升高, 且氮素含量的敏感波段主要集中在短波红外与可见光波段, 所以选择350~1300 nm作为全氮含量估测波段。
由图2可知, 在350~1300 nm范围内, 在可见光波段与冠层叶片全氮含量呈现极显著正相关的波段主要集中在726~780 nm, 且在波段767 nm处达到最大正相关(= 0.609,<0.01), 与全氮含量呈现极显著负相关的波段主要集中在591~615 nm, 且在波段604 nm达到最大负相关(=-0.267,<0.01); 在近红外波段与冠层叶片全氮含量呈现极显著正相关的波段主要集中在780~1300 nm, 且在波段1104 nm处达到最大正相关(= 0.68,<0.01), 但在此波段范围内没有出现与全氮含量的极显著负相关。
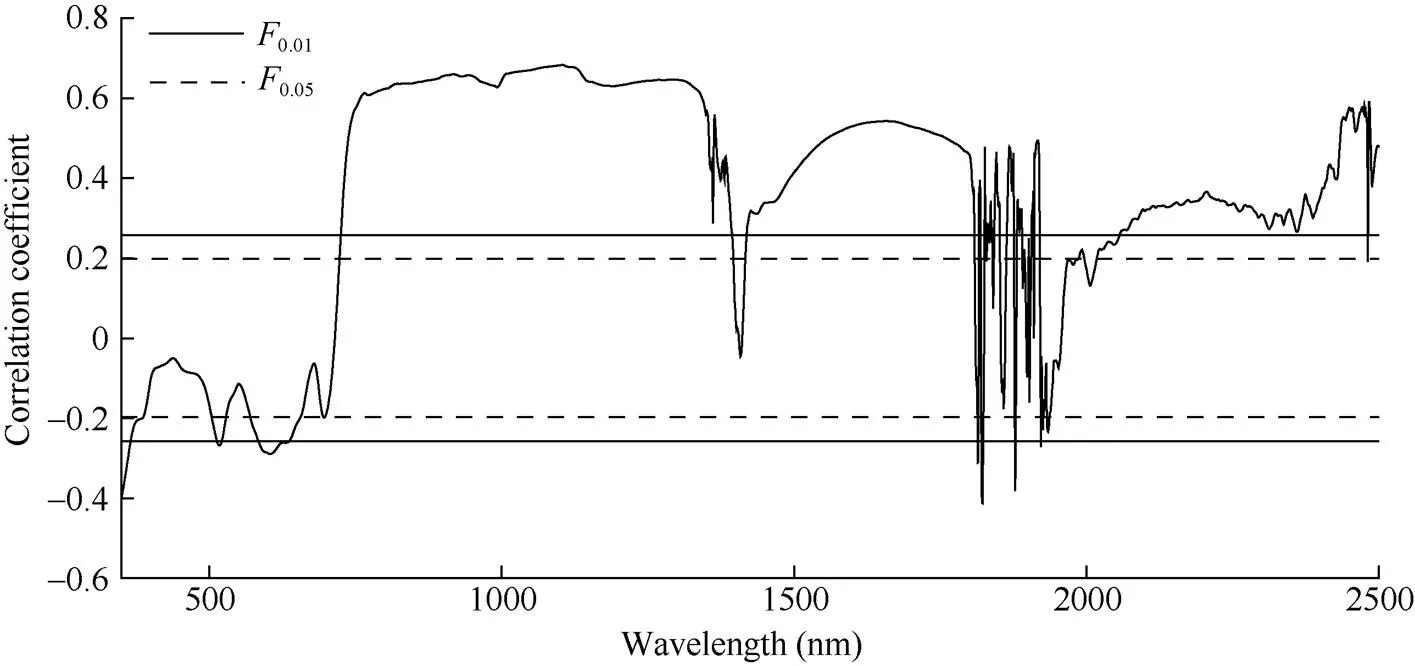
图2 甜菜冠层原始光谱反射率与全氮含量相关性
0.05: 显著相关(< 0.05);0.01: 极显著相关(< 0.01)。
0.05: significant correlation (< 0.05);0.01: extremely significant correlation (< 0.01).
**极显著水平(< 0.01)。R604: 原始光谱最大负相关; R1104: 原始光谱最大正相关; Dr1138: 一阶微分最大负相关; Dr762: 一阶微分最大正相关。缩写同表1。
**means the significance at the 0.01 probability level. R604: maximum negative correlation of original spectrum; R1104: maximum positive correlation of original spectrum; Dr1138: maximum negative correlation of first order differential; Dr762: maximum positive correlation of first order differential. Abbreviations are the same as those given in Table 1.
2.3 一阶微分光谱与全氮含量相关性
叶片全氮含量的敏感波段主要集中在短波红外与可见光波段, 因此选择350~1300 nm一阶导数光谱反射率与叶片全氮含量作相关性分析。由图3可知, 在波段389~403、610~620、638~679、709~766、774~805、995~1073、1200~1252 nm范围内呈现极显著正相关, 且在可见光(380~780 nm)范围内在波长762 nm处达到最大正相关(= 0.703,<0.01), 在近红外(780~1300 nm)范围内在波长1018 nm处达到最大正相关(= 0.633,<0.01); 在波段445~457、486~517、683~693、943~964、1126~1176、1285~1300 nm范围内呈现极显著负相关关系, 且在可见光(380~780 nm)范围内在波长496 nm处达到最大负相关(=-0.545,<0.01), 在近红外波段(780~1300 nm)范围内在波长1138 nm处达到最大负相关(=-0.715,<0.01); 在红边(680~760 nm)范围内, 最大正相关位于波长747 nm处(= 0.646,<0.01), 最大负相关位于波长687 nm处(=-0.332,<0.01)
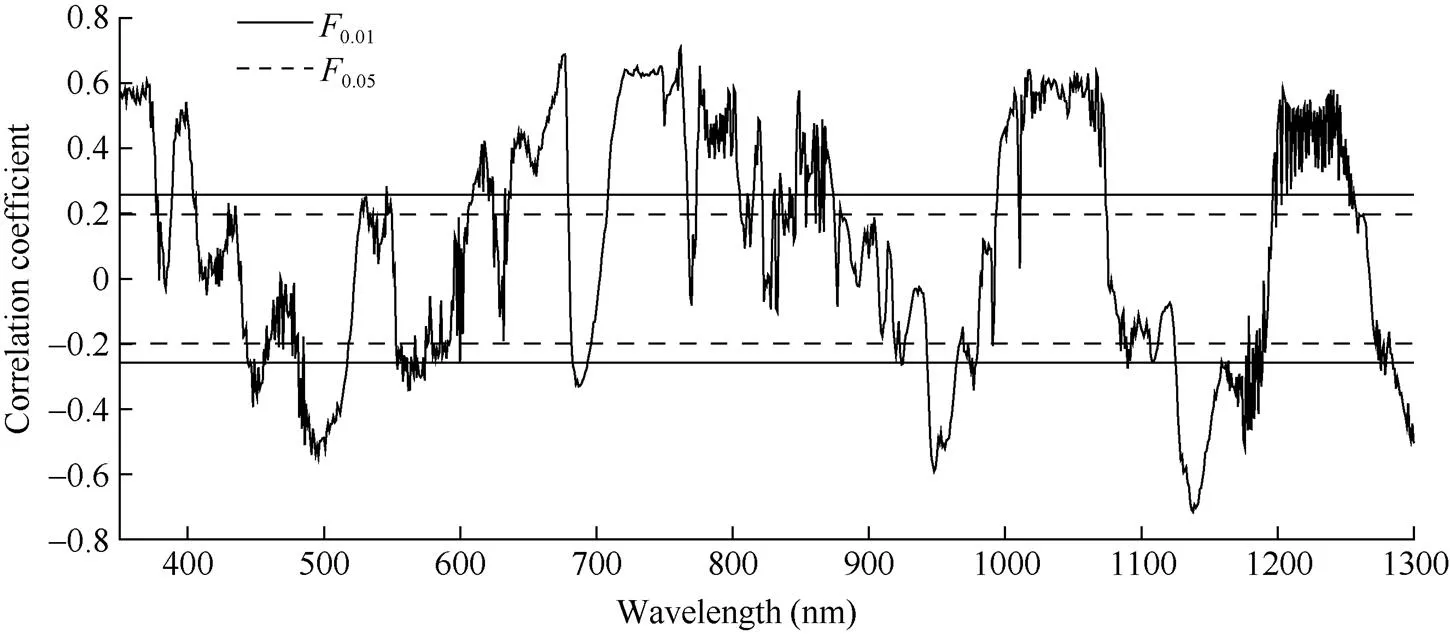
图3 甜菜冠层一阶导数光谱与全氮含量相关性
0.05: 显著相关(< 0.05);0.01: 极显著相关(< 0.01)。
0.05: significant correlation (< 0.05);0.01: extremely significant correlation (< 0.01).
。
2.4 光谱特征参数、敏感波段植被指数与全氮含量相关性
全氮含量与一阶导数光谱的相关性, 在相应波段内选取相关系数最大的对应波段反射率, 构建原始光谱反射率的比值、差值与归一化比值植被指数, 构建一阶微分光谱反射率的比值、差值、归一化比值与红边比值、差值与归一化差异指数。研究并分析三边参数及敏感波段植被指数与全氮含量的相关性(表2)。
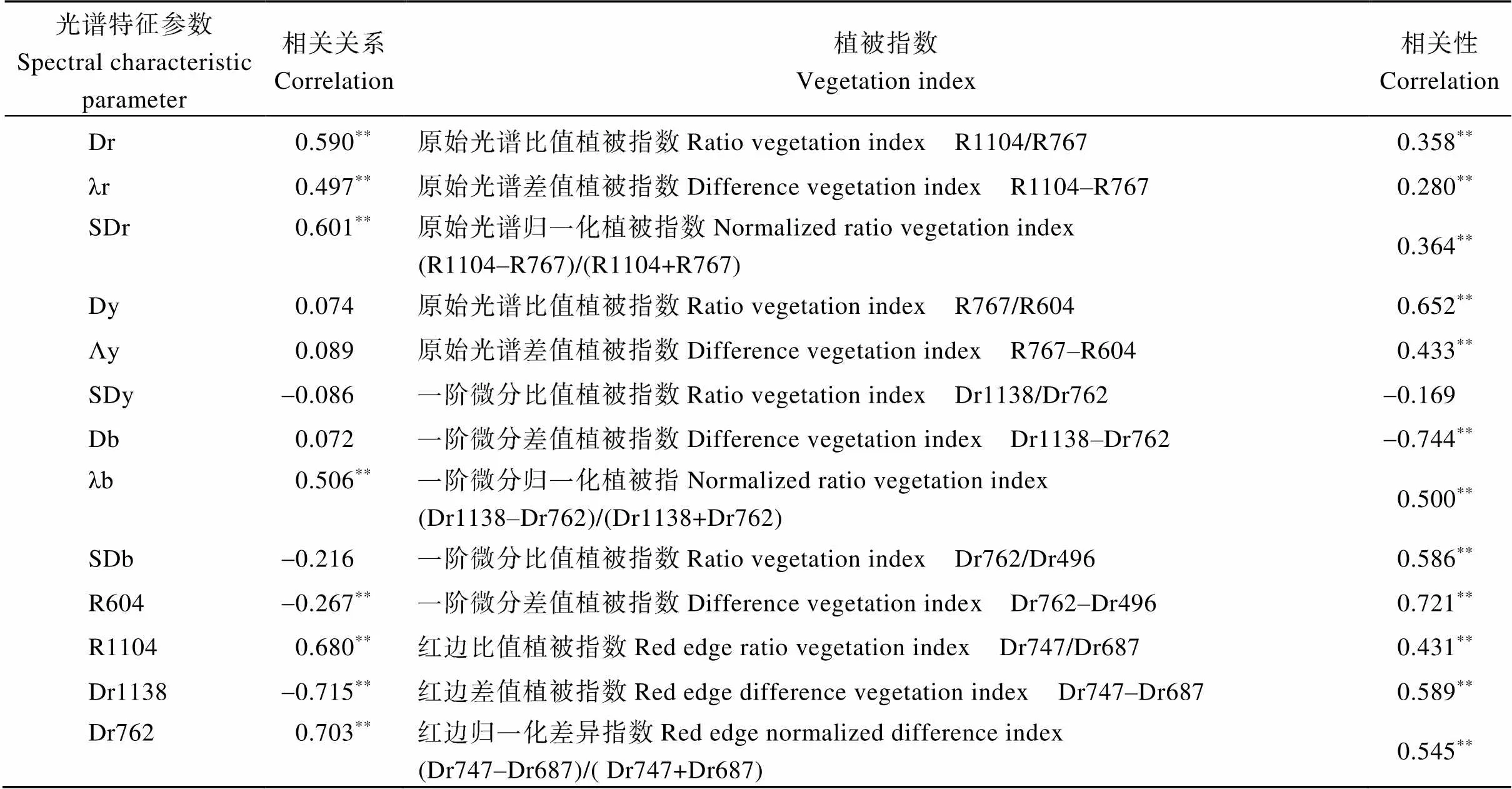
表2 光谱特征参数及敏感波段植被指数与全氮含量相关性
由表2可知, 所选光谱特征参数中红边参数与叶片全氮含量均达到极显著相关, 黄边参数与蓝边参数中只有蓝边位置与叶片全氮含量达到极显著相关, 在三边参数中, 红边振幅、红边面积、蓝边位置与叶片全氮含量均达到0.5以上的极显著相关, 其中红边面积与之达到最大相关(= 0.601,< 0.01); 原始光谱反射率和一阶微分光谱反射率与叶片全氮含量的最大相关性均达到极显著水平, 其中一阶微分最大负相关Dr1138与一阶微分最大正相关Dr762的相关性均达到0.7以上; 所建植被指数与全氮含量的相关性除一阶微分比值植被指数Dr1138/Dr762没有达到极显著水平, 其他植被指数均达到极显著水平, 但整体与叶片全氮含量的相关性较小, 在原始光谱植被指数中, 只有原始比值植被指数R767/ R604与叶片全氮含量的相关性达到了0.6以上; 在一阶微分植被指数与叶片全氮含量的相关性中, 除一阶微分比值植被指数Dr1138/Dr762外均达到0.5以上极显著水平, 其中一阶微分差值植被指数Dr1138–Dr762与一阶微分差值植被指数Dr762– Dr496的相关系数均达到0.7以上; 红边植被指数与叶片全氮含量均达到极显著相关水平, 其中红边差值植被指数Dr747–Dr687与红边归一化差异指数的均达到0.5以上, 且一阶微分光谱植被指数和红边光谱植被指数与叶片全氮含量的相关整体大于原始光谱植被指数的相关性。
2.5 已知高光谱植被指数与全氮含量相关性
在前人研究的基础上, 针对本试验数据对已有植被指数优选, 分析优选高光谱植被指数与全氮含量的相关性, 由表3可知, 所选的15个高光谱植被指数均与全氮含量极显著相关, 其中达到0.5以上相关性的有8个, 植被指数SAVI、OSAVI和MSAVI与全氮含量的相关性均达到0.6以上, 且土壤调节植被指数SAVI与全氮含量达到最大相关性(= 0.692**,<0.01)。
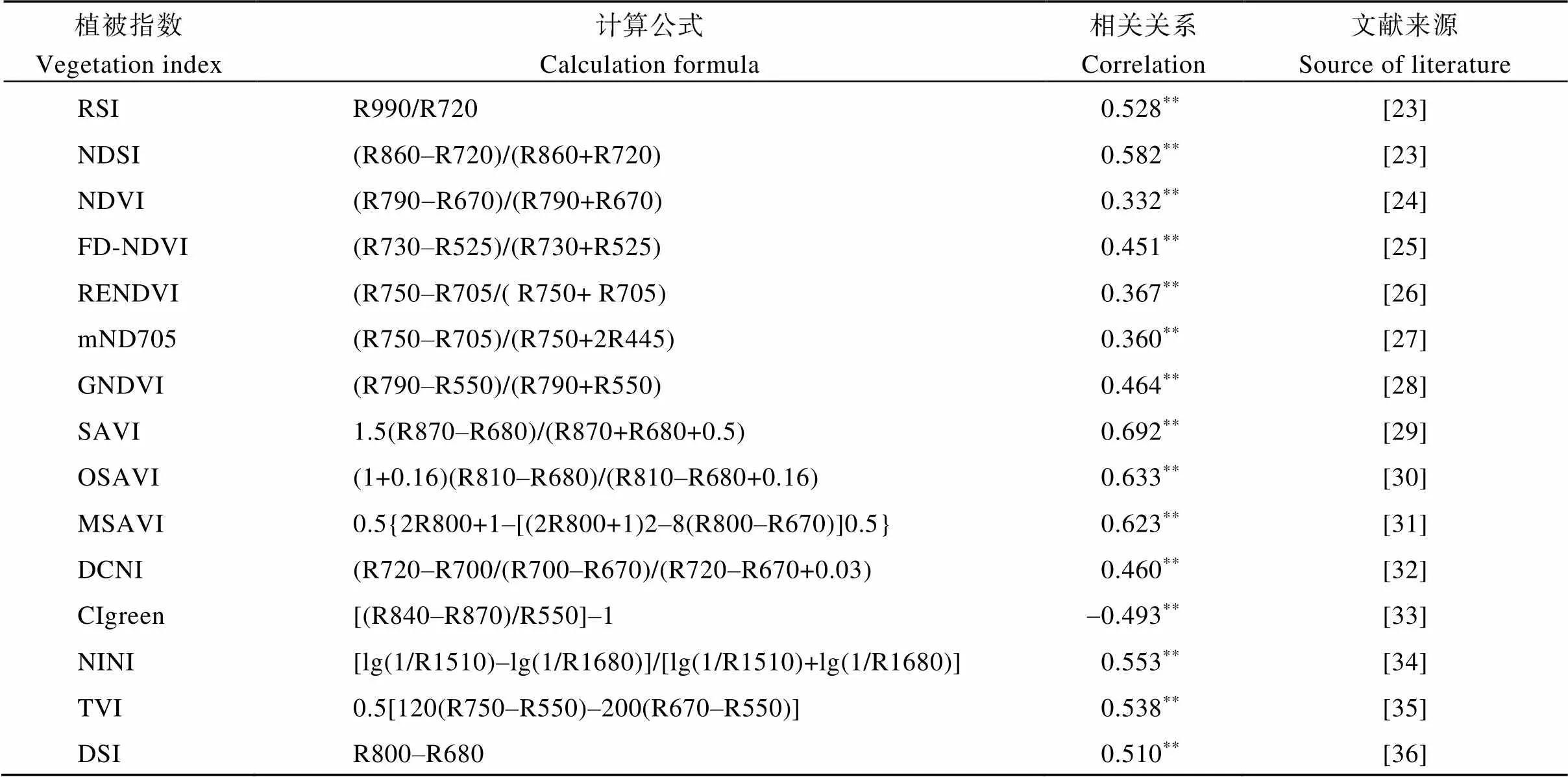
表3 已知高光谱植被指数与全氮含量的相关性
**极显著水平(< 0.01)。RSI: 比值光谱指数; NDSI: 归一化光谱指数; NDVI: 归一化植被指数; FD-NDVI: 微分归一化氮指数; RENDVI: 红边归一化指数; mND705: 修正红边归一化指数; GNDVI: 绿波段归一化植被指数; SAVI: 土壤调节植被指数; OSAVI: 优化土壤调节植被指数; MSAVI: 修正土壤调节植被指数; DCNI: 双峰冠层氮指数; CIgreen: 绿色色素指数; NDNI: 归一化氮素指数; TVI: 三角植被指数; DSI: 差值植被指数。
**means the significance at the 0.01 probability level. RSI: ratio spectral index; NDSI: normalized difference spectral index; NDVI: normalized difference vegetation index; FD-NDVI: normalized difference of nitrogen index; RENDVI: red edge normalized difference vegetation index; mND705: modified red-edge normalized difference vegetation index; GNDVI: green normalized difference vegetation index; SAVI: soil-adjusted vegetation index; OSAVI: optimization of soil-adjusted vegetation index; MSAVI: modified soil adjusted vegetation index; DCNI: double-peak canopy nitrogen index; CIgreen: green chlorophyll index; NDNI: normalized difference nitrogen index; TVI: triangle vegetation index; DSI: difference vegetation index.
2.6 基于高光谱特征参数与敏感植被指数的全氮含量的估算与验证
选取表2、表3相关系数绝对值大于0.65的植被指数用于甜菜叶片全氮含量的估算。其中光谱特征参数与植被指数作为自变量(), 叶片全氮含量作为因变量(), 构建叶片全氮含量的一元线性、二次项、幂函数以及指数函数估算模型。通过对比各模型的建模决定系数(2)、相对误差(RE)以及均方根误差(RMSE)筛选出最优模型用以研究新疆滴灌条件下甜菜叶片全氮含量的估算。其中2用以判断模型拟合优度, RE与RMSE用于检验估测模型的可靠程度。
2.6.1 基于高光谱特征参数的全氮含量的估算与验证 通过对构建光谱特征参数模型与精度检验分析可知(表4), 所选光谱特征参数与全氮含量均具有较好的拟合关系, 同时具有较好的拟合精度(2= 0.49~0.78)。通过比较不同函数估算模型发现, 不同光谱特征参数所建模型均表现为二次项函数模型最优, 其中光谱特征参数Dr1138与Dr762的决定系数均达到0.6以上, 说明在光谱短波近红外波段与红光处参数有较好估算全氮含量的能力。通过比较决定系数发现, 光谱特征参数Dr762在所选参数中表现最优, 不同函数构建估算模型决定系数均达到0.7以上, 且以二次项函数所建模型决定系数最高(2= 0.772), 其次为线性函数(2= 0.770)。
利用检验样本对上述变量建立的估算模型预测精度进行检验, 各模型检验结果如表4所示, 通过对比光谱特征参数Dr762的RE(%)与RMSE发现, 虽然二次项函数估算模型决定系数具有更好优势, 但RE(%)与RMSE较高, 且幂函数与指数函数在验证模型中均表现出较低的RE(%)与RMSE, 难以判定出最优估算模型, 因此对估测值与真实值拟合模型再次验证, 通过对光谱特征参数Dr762下不同函数估测值与真实值拟合分析发现(图4), 幂函数估算模型较其他估算模型具有更高的决定系数, 因此光谱特征参数Dr762下幂函数估算模型具有更好的拟合优度。
2.6.2 基于高光谱植被指数的叶片全氮含量估算与验证 通过对构建光谱植被指数与精度检验分析可知(表5), 所选光谱植被指数与全氮含量均具有较好的拟合关系, 同时具有较好拟合精度(2= 0.415~0.804)。通过比较不同函数估算模型决定系数发现, 不同植被指数所建模型均表现为二次项函数估算模型最优, 其中差值植被指数Dr1138–Dr762与Dr762–Dr496决定系数均达到0.7以上, 且在差值植被指数Dr762–Dr496下二次项估算模型的决定系数达到最高值(2= 0.804), 这说明在短波近红外波段与红光波段组合和红光波段与绿光波段组合具有较好估算叶片全氮含量的能力。
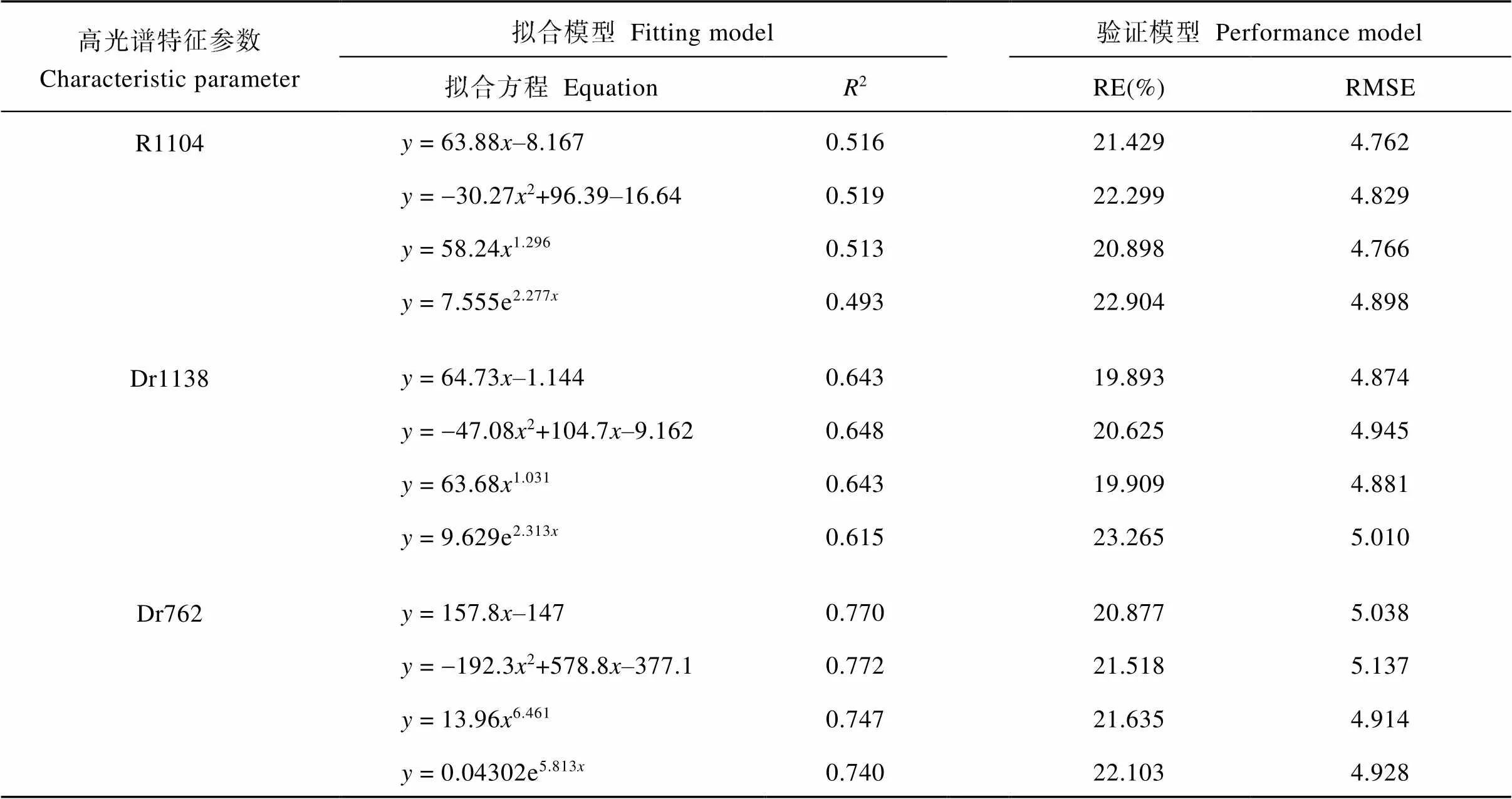
表4 不同光谱特征参数与全氮含量回归关系模型及验证
2: 决定系数; RE(%): 相对误差; RMSE: 均方根误差。缩写同表2。
2: coefficient of determination; RE(%): relative error; RMSE: relative root mean-squared error. Abbreviations are the same as those given in Table 2.
利用检验样本对上述变量建立的估算模型预测精度进行检验, 各模型检验结果如表5所示, 通过对比差值植被指数Dr762–Dr496的RE(%)与RMSE发现, 差值植被指数Dr762–Dr496估算模型与光谱特征参数Dr762表现出相似特征, 虽然二次项函数估算模型决定系数最高, 表现出较高拟合优度, 但在整体函数估算模型中表现最高, 说明偏离真值的程度较大, 虽然差值植被指数Dr1138–Dr762较Dr762–Dr496的决定系数有所降低, 但其表现出较低的RE(%)与较低RMSE, 因此难以对最优全氮估算模型进行判定, 因此对估测值与真实值拟合模型再次验证, 通过对差值植被指数Dr1138–Dr762与Dr762–Dr496下不同函数估测值与真实值拟合分析发现(图5和图6), 在差值植被指数Dr1138–Dr762中指数函数估测值与真实值拟合程度表现最优(2= 0.739), 但与差值植被指数Dr762–Dr496的拟合程度相比表现较低。在差值植被指数Dr762–Dr496下线性函数估测值与真实值拟合决定系数和指数函数估测值与真实值拟合决定系数相同(2= 0.759), 但线性函数估算模型较指数函数估算模型具有较高决定系数与较低RE(%), 因此差值植被指数Dr762–Dr496下线性函数估算模型具有更好的拟合优度。

图4 甜菜光谱特征参数Dr762 (一阶微分最大正相关)下全氮含量估测模型验证
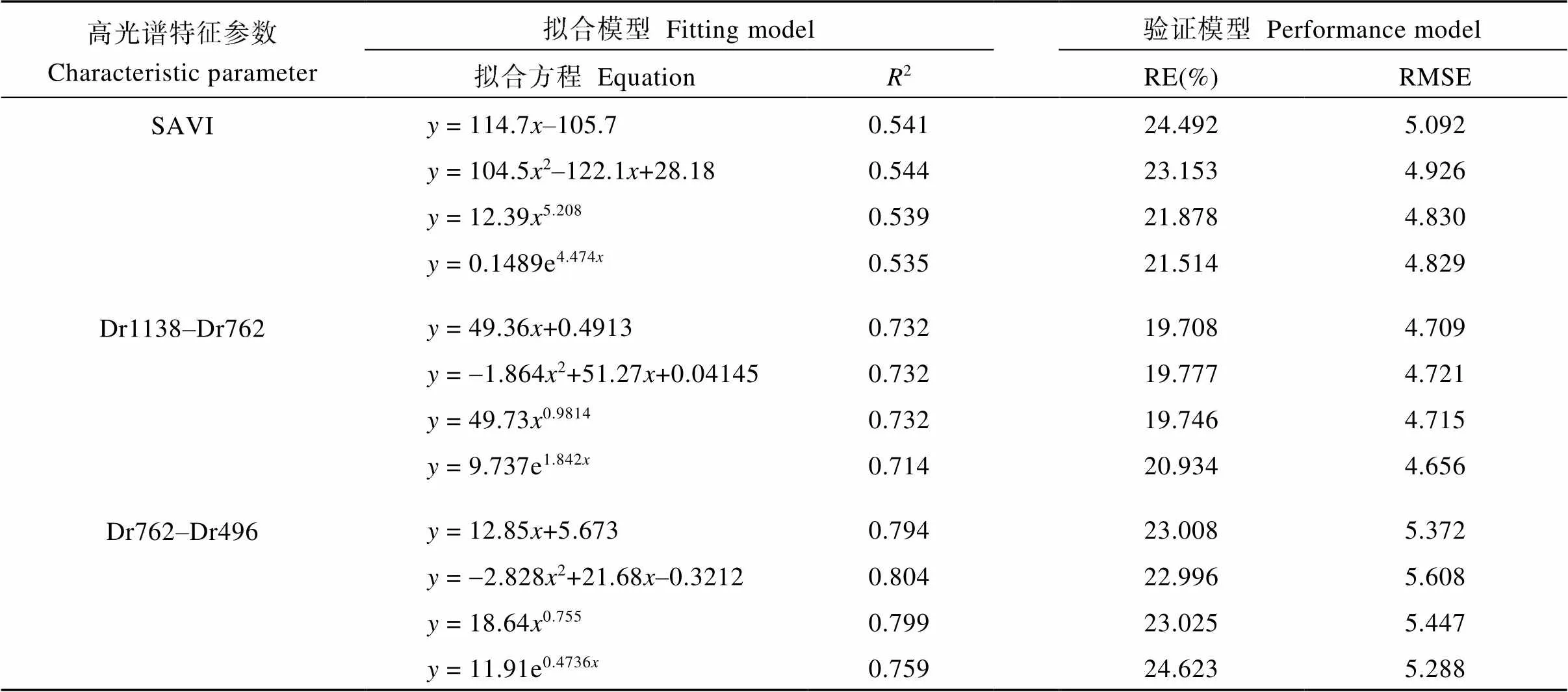
表5 不同植被指数与全氮含量回归关系模型及验证
2: 决定系数; RE(%): 相对误差; RMSE: 均方根误差。缩写同表2和表3。
2: coefficient of determination; RE(%): relative error; RMSE: relative root mean-squared error. Abbreviations are the same as those given in Table 2 and Table 3.

图5 甜菜植被指数Dr1138–Dr762下全氮含量估测模型验证
3 讨论
3.1 不同氮素水平对甜菜全氮含量及冠层光谱反射率影响
在不同氮素水平下甜菜原始冠层光谱反射率波形相似, 在350~670 nm波段范围内有明显的反射峰与吸收谷, 光谱呈现先增高后降低的趋势, 在波段670~760 nm波形变化较为剧烈, 波形呈现为陡然上升趋势, 在近红外波段780~1300 nm处形成近红外反射平台, 且具有明显波形变化, 这与前人研究基本一致[37-38]。施氮处理N75、N150、N225在550 nm较CK分别降低了7.5%、28.0%、23.0%, 说明各施氮处理相对CK均可提高甜菜植株冠层叶片对红、蓝光的吸收, 提高植株的光合效率, 且施氮处理N150比N75与N225具有更好的提高植株光合效率的作用; 在一阶导数光谱图中不同施氮处理除N75红边位置与N0相同, 其他施氮处理均出现“红移”现象, 施氮处理N150、N225较N0均向长波方向移动5 nm, 说明随着施氮量的增加, 甜菜植株冠层单位光合效率有所提高。
3.2 光谱特征参数及植被指数的选择与全氮含量的构建与检验
针对建立光谱特征参数及敏感植被指数进行筛选, 其中“三边”参数中红边面积具有较好估算全氮含量的能力, 在植被指数中R767/R604、Dr1138– Dr762与Dr762–Dr496的相关性均在0.6以上, 其中一阶微分光谱植被指数和红边光谱植被指数与叶片全氮含量的相关性整体大于原始光谱植被指数的相关性, 组合波段相对单一光谱特征参数相关性均有所提高。
通过对光谱特征参数筛选建立全氮含量的多种函数估算模型发现, 不同光谱特征参数所建立模型均表现为二次函数拟合效果最好, 利用检验样本对所建立估测模型预测精度进行检验发现, 虽然光谱特征参数Dr762二次函数估测模型决定系数具有最大决定系数(2= 0.772),但验证模型中RE(%)与RMSE较高, 通过对Dr762估测值与真实值拟合后发现, 光谱特征参数Dr762幂函数下估算模型具有更好的拟合优度。
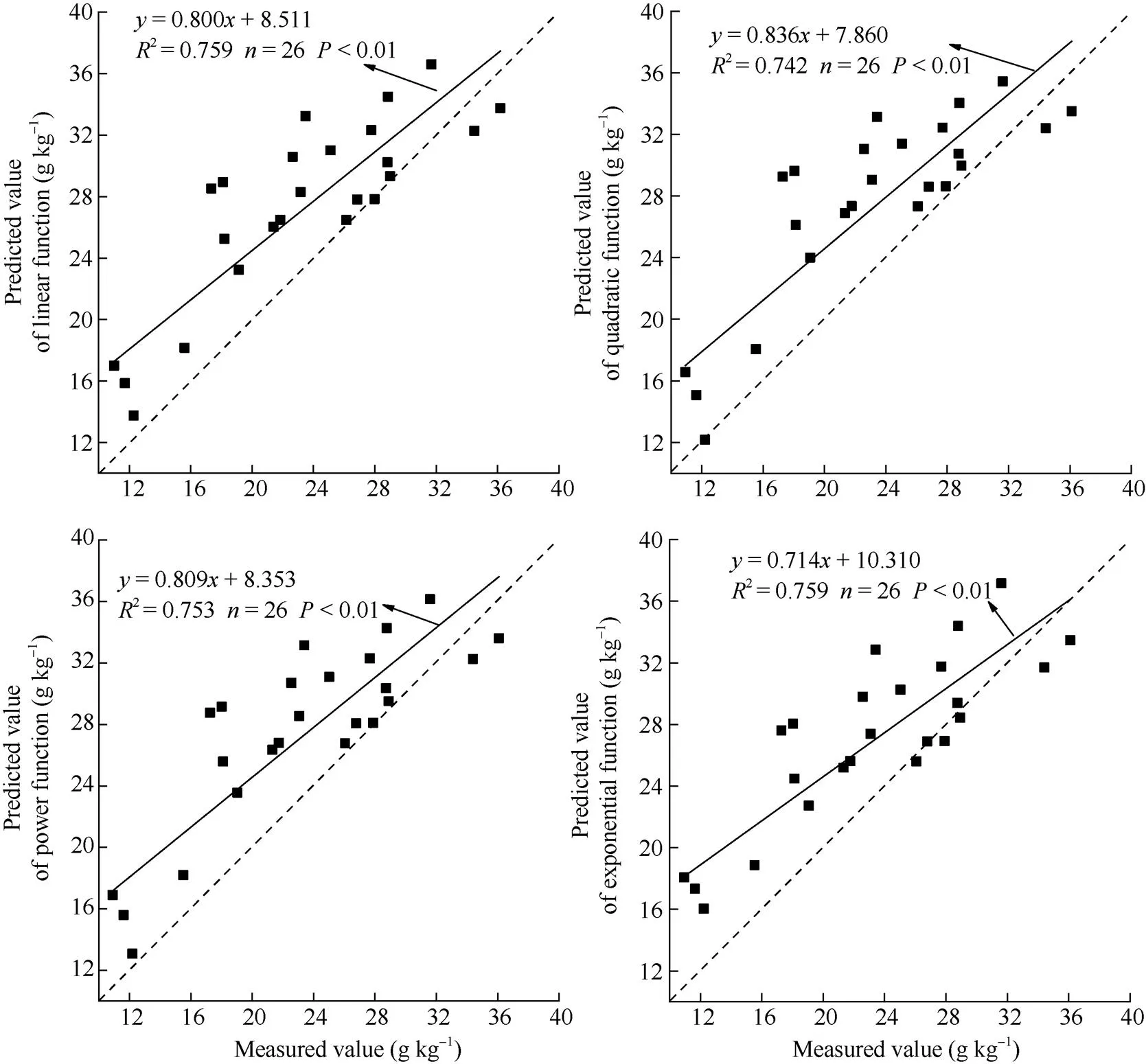
图6 甜菜植被指数Dr762–Dr496下全氮含量估测模型验证
通过对敏感植被指数筛选建立全氮含量的多种函数估算模型发现, 不同植被指数所建模型均表现为二次函数估算模型最优, 其中差值植被指数Dr762–Dr496下二次项估算模型的决定系数达到最高值(2= 0.804), 这说明在短波近红外波段与红光波段组合和红光波段与绿光波段组合具有较好估算叶片全氮含量的能力。利用检验样本对所建模型进行检验发现, 虽然差值植被指数Dr762–Dr496表现出较高拟合优度, 但验证模型中偏离真值的程度较大, 通过建立Dr762–Dr496估测值与真实值拟合后发现, 差值植被指数Dr762–Dr496下一元线性函数具有更好的拟合优度。
作物冠层叶片氮素含量的高光谱遥感估算较为复杂, 受到作物冠层结构、叶片表面以及内部特征、化学和光学特性、土壤背景值等一系列影响。Knyazikhin等[39]研究认为冠层结构及其光学特性是决定光谱反射率的主要因素, 冠层结构组织具有复杂性, 光子在此结构中会产生碰撞、吸收、散射及反射, 只有一小部分会被截获, 因而叶片反射率与叶片氮素含量间无直接相关性。但叶片、冠层以及生态系统之间的复杂联系可能会导致叶片全氮含量与光谱反射率之间的重复相关性, 虽然可以确定冠层光谱反射率的物理驱动因素是必要的, 模拟冠层中作物生化指标可以起到较好作用, 然而这些物理机制在冠层、叶片内部结构及外部结构等和生态系统之间的一系列生态驱动是联动运作的, 而氮素是作物碳氮循环中一最为重要成分, 氮素有效性会较大程度决定植被冠层丰度[40-41]。碳氮循环作为生态系统中运作的关键, 光合作用为植被提供生长及繁殖的能量及物质, 其冠层氮素含量的定量变化提供了关于植被冠层的直接信息[42]。这也说明氮素含量与冠层结构之间的联动, 并较大程度决定冠层结构, 并与冠层光谱反射率呈现直接或间接的影响。因此对作物的生物学和物理学特性不能孤立地评估, 应更好理解光谱处理方法以及工作原理, 在更多波长范围内进行更广泛的模拟。
本文光谱数据测定主要在甜菜叶丛快速生长期至糖分积累期, 在此阶段范围内甜菜冠层基本达到土壤背景全覆盖, 通过对比表明前人建立植被指数与本文全氮含量均具有较好相关性, 均达到极显著相关, 说明不同纬度地区、不同作物与所建立植被指数均可进行全氮含量的估算, 但由于地区与作物的不同, 所建立植被指数与叶片全氮含量的吻合度存在一定的差异。本研究主要基于石河子滴灌甜菜叶片全氮含量估算得到的初步结果, 但在实际工作中利用高光谱遥感数据对甜菜叶片全氮含量估算时,易受不同纬度地区以及冠层结构、叶片角度、结构等因素影响, 因此所得结果还有待进一步验证。
4 结论
通过光谱特征参数与叶片全氮含量建立多种函数估算模型, 其中光谱特征参数Dr762幂函数下估算模型具有较好估算甜菜叶片全氮含量的能力, 其决定系数2= 0.747, 验证相对误差RE(%)为21.635, 验证均方根误差RMSE为4.914。通过植被指数与叶片全氮含量建立多种函数估测模型, 其中差值植被指数Dr762–Dr496下一元线性函数具有较好估算甜菜叶片全氮含量的能力, 其决定系数2= 0.794, 验证相对误差RE(%)为23.008, 验证均方根误差为5.372。
[1] Lee Y J, Yang C M, Chang K W, Shen Y. A simple spectral index using reflectance of 735 nm to assess nitrogen status of rice canopy., 2008, 100: 205–212.
[2] 苏继霞, 王开勇, 费聪, 李阳阳, 樊华. 氮肥运筹对滴灌甜菜产量、氮素吸收和氮素平衡的影响. 土壤通报, 2016, 47: 1404–1407. Su J X, Wang K Y, Fei C, Li Y Y, Fan H. Effects of nitrogen management on sugar beet yield, Nitrogen uptake and soil nitrogen balance under drip irrigation., 2016, 47: 1404–1407 (in Chinese with English abstract).
[3] 费聪, 王维成, 李阳阳, 樊华. 氮素运筹对滴灌甜菜叶片光合特性的影响. 江苏农业科学, 2016, 44(12): 227–229. Fei C, Wang W C, Li Y Y, Fan H. Effects of nitrogen management on photosynthetic characteristics of sugarbeet leaves under drip irrigation., 2016, 44(12): 227–229 (in Chinese).
[4] 高雨茜. 夏玉米叶绿素、叶面积指数高光谱估测研究. 西北农林科技大学硕士学位论文, 陕西杨凌, 2016.Gao Y Q. Chlorophyll and Leaf Area Indexstimation Based on Hyperspectrum of Summer Corn. MS Thesis of Northwest A&F University,Yangling, Shaanxi, China, 2016 (in Chinese with English abstract).
[5] 刘冰峰. 夏玉米不同生育时期生理生态参数的高光谱遥感监测模型. 西北农林科技大学博士学位论文, 陕西杨凌, 2016. Liu B F. Monitoring Models of Physiological and Ecological Parameters of Summer Maize Based on Hyperspectral Remote Sensing at Different Growth Stages. PhD Dissertation of Northwest A&F University, Yangling, Shaanxi, China, 2016 (in Chinese with English abstract).
[6] Shibayama M, Akiyama T. Seasonal visible, near-infra-red and mid-infrared spectra of rice canopies in relation to LAI and above-ground dry biomass., 1989, 27: 119–127.
[7] Smith M L, Ollinger S V, Martin M E, Aber J D, Hallett R A, Goodale C L. Direct estimation of aboveground forest productivity through hyperspectral remote sensing of canopy nitrogen., 2002, 12: 1286–1302.
[8] Stone M L, Soile J B, Raun R. Use of spectral radiance for correcting in-season fertilizer nitrogen deficiencies in winter wheat., 1996, 39: 1623–1631.
[9] Thomas J R, Oerther G F. Estimating nitrogen content of sweet pepper leaves by reflectance measurements., 1972, 64: 11–13.
[10] Tian Y C, Yao X, Yang J, Cao W X, Hannaway D B, Zhu Y. Assessing newly developed and published vegetation indices for estimating rice leaf nitrogen concentration with ground and spacebased hyperspectral reflectance., 2011, 120: 299–310.
[11] Wang W, Yao X, Yao X F, Tian Y C, Liu X J, Ni J, Cao W X, Zhu Y. Estimating leaf nitrogen concentration with three-band vegetation indices in rice and wheat., 2012, 129: 90–98.
[12] Menesatti P, Antonucci F, Pallottino F, Roccuzzo M, Allegra M, Stagno F, Intrigliolo F. Estimation of plant nutritional status by Vis-NIR spectrophotometric analysis on orange leaves., 2010, 105: 448–454.
[13] Zhang G C, Li Z, Yan X M, Cheng C G, Zhou P, Lin G L, Zhou C J, Liu N, Han X R. Rapid analysis of apple leaf nitrogen using near infrared spectroscopy and multiple linear regression., 2012, 43: 1768–1772.
[14] 张潇元, 张立福, 张霞, 王树东, 田静国, 翟涌光. 不同光谱植被指数反演冬小麦叶氮含量的敏感性研究. 中国农业科学, 2017, 50: 474–485. Zhang X Y, Zhang L F, Zhang X, Wang S D, Tian J G, Zhai Y G. Sensitivity of different spectral vegetation index for estimating winter wheat leaf nitrogen., 2017, 50: 474–485 (in Chinese with English abstract).
[15] 王仁红, 宋晓宇, 李振海, 杨贵军, 郭文善, 谭昌伟, 陈立平. 基于高光谱冬小麦氮素营养指数估测. 农业工程学报, 2014, 30(19): 191–198. Wang R H, Song X Y, Li Z H, Yang G J, Guo W S, Tan C W, Chen L P. Estimation of winter wheat nitrogen nutrition index using hyperspectral remote sensing., 2014, 30(19): 191–198 (in Chinese with English abstract).
[16] 田永超, 杨杰, 姚霞, 朱艳, 曹卫星. 利用红边面积形状参数估测水稻叶层氮浓度. 植物生态学报, 2009, 33: 791–801. Tian Y C, Yang J, Yao X, Zhu Y, Cao W X. Estimation of leaf canopy nitrogen concentration with red edge area shape parameter in rice., 2009, 33: 791–801 (in Chinese with English abstract).
[17] 顾清, 邓劲松, 陆超, 石媛媛, 王珂, 沈掌门. 基于光谱和形状特征的水稻扫描叶片氮素营养诊断. 农业机械学报, 2012, 43(8): 170–174. Gu Q, Deng J X, Lu C, Shi Y Y, Wang K, Shen Z M. Diagnosis of rice nitrogen nutrition based on spectral and shape characteristics of scanning leaves., 2012, 43(8): 170–174 (in Chinese with English abstract).
[18] 黄春燕, 王登伟, 闫杰, 张煜星, 曹连莆, 程诚. 棉花叶绿素密度和叶片氮积累量的高光谱监测研究. 作物学报, 2007, 33: 931–936. Huang C Y, Wang D W, Yan J, Zhang Y X, Cao L P, Cheng C. Monitoring of cotton canopy chlorophyll density and leaf nitrogen accumulation status by using hyperspectral data., 2007, 33: 931–936 (in Chinese with English abstract).
[19] 吴华兵, 朱艳, 田永超, 姚霞, 刘晓军, 周治国, 曹卫星. 棉花冠层高光谱参数与叶片氮含量的定量关系. 植物生态学报, 2007, 31: 903–909. Wu H B, Zhu Y, Tian Y C, Yao X, Liu X J, Zhou Z G, Cao W X. Relationship between canopy hyperspectra parameter and leaf nitrogen concentration in cotton., 2007, 31: 903–909 (in Chinese with English abstract).
[20] 赵春江, 黄文江, 王纪华, 杨敏华, 薛绪掌. 不同品种、肥水条件下冬小麦光谱红边参数研究. 中国农业科学, 2002, 35: 980–987. Zhao C J, Huang W J, Wang J H, Yang M H, Xue X Z. Studies on the red edge parameters of spectrum in winter wheat under different varieties, Fertilizer and water treatments., 2002, 35: 980–987 (in Chinese with English abstract).
[21] 王树文, 赵越, 王丽凤, 王润涛, 宋玉柱, 张长利, 苏中滨. 基于高光谱的寒地水稻叶片氮素含量预测. 农业工程学报, 2016, 32(20): 187–194. Wang S W, Zhao Y, Wang L F, Wang R T, Song Y Z, Zhang C L, Su Z B. Prediction for nitrogen content of rice leaves in cold region based on hyperspectrum., 2016, 32(20): 187–194 (in Chinese with English abstract).
[22] 陈兵, 王方永, 韩焕勇, 刘政, 邓福军, 林海, 余渝, 李少昆, 王克如, 肖春华. 基于光谱红边参数的棉花黄萎病叶片氮素含量诊断研究. 棉花学报, 2013, 25: 254–261. Chen B, Wang F Y, Han H Y, Liu Z, Deng F J, Lin H, Yu Y, Li S K, Wang K R, Xiao C H. Monitoring nitrogen contents in leaves of cotton under verticillium wilt stress based on spectra red-edge parameters., 2013, 25: 254–261 (in Chinese with English abstract).
[23] Yao X, Zhu Y, Tian Y C, Cao W X. Exploring hyperspectral bands and estimation indices for leaf nitrogen accumulation in wheat., 2010, 12: 89–100.
[24] Rouse J W, Haas R H, Schell J A, Deering D W. Monitoring vegetation systems in the Great Plains with ERTS., 1974, 351: 309.
[25] 梁亮, 杨敏华, 邓凯东, 张连蓬, 林卉, 刘志霄. 一种估测小麦冠层氮含量的新高光谱指数. 生态学报, 2011, 31: 6594–6605. Liang L, Yang M H, Deng K D, Zhang L P, Lin H, Liu Z X. A new hyperspectral index for the estimation of nitrogen contents of wheat canopy., 2011, 31: 6594–6605 (in Chinese with English abstract).
[26] Gitelson A A, Merzlyak M N. Spectral reflectance changes associated with autumn senescence ofL. andL. leaves. Spectral features and relation to chlorophyll estimation., 1994, 143: 286–292.
[27] Daniel A S, John A G. Relationships between leaf pigment content and spectral reflectance across a wide range of species, leaf structures and developmental stages., 2008, 81: 337–354.
[28] Gitelson A A, Merzlyak M N. Signature analysis of leaf reflectance spectra: algorithm development for remote sensing of chlorophyll., 1996, 148: 494–500.
[29] Huete A R. A soil-adjusted vegetation index (SAVI)., 1988, 25: 295–309.
[30] Rondeaux G, Steven M, Baret F. Optimization of soil-adjusted vegetation indices., 1996, 55: 95–107.
[31] Haboudane D, Miller J R, Pattey E, Zarco P J, Strachan I B. Hyperspectral vegetation indices and novel algorithms for predicting green LAI of crop canopy: monitoring and validation in the context of precision agriculture., 2004, 90: 337–352.
[32] Chen P F, Haboudane D, Trembley N, Wang J H, Vigneault P, Li B G. New spectral indicator assessing the efficiency of crop nitrogen treatment in corn and wheat,, 2010, 114: 1987–1997.
[33] Gitelson A A, Vina A, Ciganda V, Rundquist D C, Arkebauer T J. Remote estimation of canopy chlorophyll content in crops., 2005, 32: 1–4.
[34] Serrano L, Penuelas J, Ustin S L. Remote sensing of nitrogen and lignin in Mediterranean vegetation decomposing biochemical from structural signals., 2002, 81: 355–364.
[35] Broge N H, Leblanc E. Comparing prediction power and stability of broadband and hyperspectral vegetation indices for estimation of green leaf area index and canopy chlorophyll density., 2001, 76: 156–172.
[36] 谌俊旭, 黄山, 范元芳, 王锐, 刘沁林, 杨文钰, 杨峰. 单作套作大豆叶片氮素积累与光谱特征. 作物学报, 2017, 43: 1835–1844. Chen J X, Huang S, Fan Y F, Wang R, Liu Q L, Yang W Y, Yang F. Remote detection of canopy leaf nitrogen status in soybean by hyperspectral data under monoculture and intercropping systems., 2017, 43: 1835–1844 (in Chinese with English abstract).
[37] 杨福芹, 冯海宽, 李振海, 杨贵军, 戴华阳. 基于可见光-近红外光谱特征参数的苹果叶片氮含量预测. 农业机械学报, 2017, 48(9): 143–151. Yang F Q, Feng H K, Li Z H, Yang G J, Dai H Y. Prediction for nitrogen content of apple leaves using spectral features parameters from visible and near infrared lights., 2017, 48(9): 143–151 (in Chinese with English abstract).
[38] 徐道青, 刘小玲, 王维, 陈敏, 阚画春, 李常凤, 郑曙峰. 淹水胁迫下棉花叶片高光谱特征及叶绿素含量估算模型. 应用生态学报, 2017, 28: 3289–3296. Xu D Q, Liu X L, Wang W, Chen M, Kan H C, Li C F, Zheng S F. Hyper-spectral characteristics and estimation model of leaf chlorophyll content in cotton under waterlogging stres., 2017, 28: 3289–3296 (in Chinese with English abstract).
[39] Knyazikhin Y, Mitchell A, Schull, Stenberg P, Mottus M, Rautiaien M, Yang Y, Marshak A, Carmona P L, Kaufmann R K, Lewis P, Disney M I, Vanderbilt V, Davis A B, Baret F, Jacquemoud S J, Lyapustin A, Myneni R B. Hyperspectral remote sensing of foliar nitrogen content., 2013, 110: E185–E192.
[40] Ollinger S V, Reich P B, Frolking S, Lepine L C, Hollinger D Y, Richardson A D. Nitrogen cycling, forest canopy reflectance, and emergent properties of ecosystems., 2013, 110: E2437.
[41] Townsen P A, Serbin S P, Kruger E L, Gamon J A. Disentangling the contribution of biological and physical properties of leaves and canopies in imaging spectroscopy data., 2013, 110: E1704.
[42] Ustin S L. Remote sensing of canopy chemistry., 2013, 110: 804–805.
Estimation of total nitrogen content in sugarbeet leaves under drip irrigation based on hyperspectral characteristic parameters and vegetation index
LI Zong-Fei1, SU Ji-Xia1, FEI Cong1, LI Yang-Yang1, LIU Ning-Ning1, DAI Yu-Xiang1, ZHANG Kai-Xiang1, WANG Kai-Yong1, FAN Hua1,*, and CHEN Bing2,*
1Agronomy College, Shihezi University, Shihezi 832003, Xinjiang, China;2Cotton Institute, Xinjiang Academy of Agricultural and Reclamation Science, Shihezi 832003, Xinjiang, China
The purpose of this paper is to clarify the quantitative relationship between total nitrogen content of sugar beet and high-resolution vegetation remote sensing, to explore the establishment of an optimal estimation model for total nitrogen content of sugar beet, and to monitor the growth of sugar beet. Xinjiang drip-irrigated sugar beet (Beta356) was selected to collect the reflectance spectra of leaf cluster during the leaves rapid growth period, root expansion period and sugar accumulation period by the ASD field hyperspectral apparatus. The total nitrogen content was also measured and the relationship between original spectral reflectance and total nitrogen content was analyzed. According to the correlation between the first-order differential spectral reflectance and total nitrogen content, a total nitrogen content estimation model was established. The model with spectral characteristic parameter Dr762 power function had a good ability to estimate total nitrogen content in leaves of beet, with the determination coefficient, relative error, and root mean square error of 0.747, 21.635, and 4.914, respectively. Various function estimation models were established based on vegetation index and leaf total nitrogen content. The linear function under vegetation index Dr762–Dr496 had better ability to estimate leaf total nitrogen content. Its determinant coefficient, relative error, and root mean square error were 0.794, 23.008, and 5.372, respectively.
total nitrogen; hyperspectral; characteristic parameters; vegetation index; estimation model
2019-03-20;
2019-12-26;
2020-01-17.
10.3724/SP.J.1006.2020.94045
樊华, E-mail: fanhua@shzu.edu.cn; 陈兵, E-mail: zyrcb@126.com
E-mail: shzulizongfei@163.com
本研究由国家自然科学基金项目(31660360, 31771720), 自治区研究生科研创新项目(XJGRI2016039)和石河子大学国际科技合作推进计划(GJHZ201706)资助。
This study was supported by the National Natural Science Foundation of China (31660360, 31771720), the Research and Innovation Projects of Postgraduates in Autonomous Region (XJGRI2016039), and the International Science and Technology Cooperation Promotion Plan of Shihezi University (GJHZ201706).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200117.1006.002.html
