SMI、CDFI和增强CT检查TACE术治疗的原发性肝癌患者癌组织血供显像效果比较*
2020-03-23陈亮段海峰余红星
陈亮,段海峰,余红星
原发性肝癌(primary liver cancer,PLC)属临床常见的恶性肿瘤。据报道,世界范围内PLC的发病率占男性常见恶性肿瘤的第五位,占女性常见恶性肿瘤的第七位,而外科手术治疗5 a生存率为26%~57%。因起病隐匿,被发现者多数已失去了外科手术的机会,仅5% ~15%患者适宜手术治疗[1]。目前,因经肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization,TACE)具有微创、见效快、安全性好等优势,已被认为是无法手术切除的中晚期PLC患者的首选治疗手段,但术后肿瘤完全坏死率仅为22% ~29%,可能与肿瘤双重供血、血管栓塞不完全或栓塞后侧枝血管生成等有关,故TACE术后准确评价栓塞效果尤为重要[2]。现阶段,临床上主要评估方法包括增强电子计算机断层扫描(computed tomography,CT)、彩色多普勒血流成像((color Doppler flow imaging,CDFI)、超微血管成像(superb micro-vascular imaging,SMI)等。既往报道认为,增强CT可评价经TACE治疗的肿瘤是否复发,并可判断是否需要再次行TACE治疗。CDFI可显示肿瘤及其相关血管血流动力学改变,在TACE术后评价疗效优势明显,而SMI作为一项高分辨率的血流显示技术,空间分辨率高,可清晰地显示低血流图像和高帧频成像,在评价TACE术后疗效方面具有较大的潜力[3-5]。我们采用 SMI、CDFI和增强 CT检查,评估了TACE术后肝癌血供显像的改变,旨在为临床诊治提供参考,现报道如下。
1 资料与方法
1.1 一般资料 2016年4月~2019年4月我院收治的PLC患者135例,男93例,女42例;年龄23~75岁,平均年龄为(55.2±13.0)岁。诊断参照《原发性肝癌诊疗规范(2011年版)》的标准[6],具有乙型肝炎病毒和/或丙型肝炎病毒感染证据和肝硬化基础,具有典型的PLC影像学特征,多排CT和(或)动态对比增强MRI显示肝脏占位性病变,动脉期呈快速不均质血管强化,延迟期或静脉期快速消退,血清甲胎蛋白(AFP)水平为400μg/L或以上,且持续1个月以上,或AFP为200μg/L或以上,持续2个月以上,排除生殖系胚胎源性肿瘤、转移性肝癌、活动性肝病、妊娠等其他原因所致的AFP升高。所有患者均首次接受TACE术,符合手术指征,入组前3个月内未接受过化疗、射频消融等治疗,肿瘤直径≤10 cm,肝功能Child-Pugh分级为A级或B级。排除标准:(1)转移性肝癌;(2)肿瘤远处广泛转移,预计生存期小于3个月;(3)伴心、肾、肺等重要器官疾病或精神疾病;(4)凝血功能严重障碍;(5)肝功能Child-Pugh C级;(6)侧支血管形成、胆管癌栓、门静脉主干癌栓形成或下腔静脉癌栓;(7)严重的门脉高压、胃底和食管贲门静脉重度曲张,存在破裂出血的危险;(8)既往有上消化道出血病史、全身性感染或脓毒血症病史;(9)合并高度腹水、黄疸;(10)肿瘤占全肝70%或以上;(11)过敏体质或对本研究应用的造影剂过敏者;(12)妊娠或哺乳期女性。患者及其家属签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 TACE治疗 按照参考文献[7]进行。
1.3 SMI、CDFI和增强CT检查 在TACE术后30 d进行检查。使用Vivid 7型全数字彩色多普勒超声诊断仪(美国GE公司),使用频率为2.0~5.0 MHz的375BT凸阵探头,配有SMI和CDFI成像软件及微血管成像(Commune)软件。患者空腹,取仰卧位,常规切面选择横突下纵和横切面、右肋下斜面、右肋间切面,合理调节仪器,清晰显示肝脏病灶内部血流,确保无伪彩影。设置CDFI量程为9.4~15.7 cm/s,帧频为6~10帧/s,并设置SMI量程为1.2~4.7cm/s,帧频为40~50帧/s。再设置灰阶增益80~100 dB,彩色增益40~50 dB,动态范围为55 dB,滤波为6。训练患者屏气,持续3~5 min,先后启动 CDFI和SMI模式,探查肝脏病灶内部及其周围血供情况,获取图像资料后存于移动硬盘,以便后续阅片分析。当CDFI和SMI显示肝脏病灶内部有点状或条状血流信号,则判断为有血供。使用Aquilion 64排螺旋CT机(日本东芝公司),设置增强扫描参数,管电流为580 mA,管电压为120 kV,层厚为5 mm,层间隔为5 mm,螺距为1.375。应用碘普罗胺注射液(优维显,BayerSchering PharmaAG,注册证号H20030506)为造影剂,获取动脉期、门脉期和延迟期图像,由2名资深放射诊断医师采用双盲法阅读CT片并判断结果。
1.4 统计学方法 应用SPSS 19.0软件处理数据,计数资料以百分率(%)表示,组间行x2检验,计量资料以(±s)表示,组间行t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料情况 在135例PLC患者中,发现病灶168个,其中单发病灶105例,多发病灶30例(63个病灶);病灶大小为0.7~5.0 cm,平均为(2.9±1.2)cm;病灶位于肝右叶108个,肝左叶45个,左右叶交界处15个。
2.2 影像学表现情况 SMI成像显示,受心动周期的影响,病灶伴噪声存在,肿瘤内部存在条状或点状血流信号,病灶周围伴条状或点状血流信号,表现为滋养血管自门静脉或肝动脉发出后,走行弯曲,粗细不均,伸入病灶内部或顺着病灶周围行走;CDFI成像显示,病灶呈等回声,内部回声不均匀,边界不清晰,形状规则,周围未见明显的晕环,病灶周围出现点状血流信号;增强CT成像显示,术后病灶多数为碘油沉积(图1)。
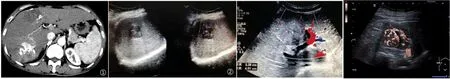
图1 TACE术后PLC患者腹部影像学表现
2.3 SMI、CDFI和增强CT对病灶血供检出情况比较SMI、CDFI和增强 CT病灶血供检出率分别为54.2%(91/168)、25.0%(42/168)和 84.5%(142/168),其中增强CT病灶血供检出率显著高于SMI或CDFI(x2=36.426,P=0.000;x2=120.137,P=0.000),SMI病灶血供检出率显著高于CDFI(x2=29.880,P=0.000)。
2.4 SMI、CDFI和增强CT对不同大小病灶血供的检出情况比较 针对直径<2.0cm或≥2.0cm的病灶,SMI或CDFI病灶血供检出率均显著低于增强CT(P<0.05),SMI病灶血供检出率显著高于CDFI(P<0.05,表1)。
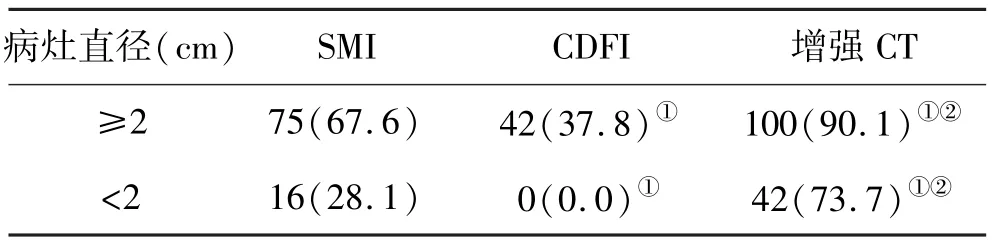
表1 三种方法对不同大小病灶血供检出率(%)比较
3 讨论
据报道,中晚期PLC患者TACE术后1 a、2 a和3 a生存率分别为53%、40%和20%[8]。另有报道显示,TACE术后1 a和3 a生存率分别为63.2%和27.0%[9]。可见,TACE能延长PLC患者生存期,改善其预后。但TACE通常难以使肿瘤完全坏死,肝脏肿瘤受肝动脉-门静脉双重供血,在术后往往肿瘤血管再通,导致病灶内碘油沉积不足,肿瘤难以彻底灭活,具有较高的复发率[10]。因此,寻找高效、快速、准确判断TACE术后疗效的方法,明确肿瘤坏死程度,已成为临床研究的重点。
临床上判断TACE术后疗效主要采用超声造影、数字减影血管造影技术、增强 CT、CDFI、SMI等方法。以往报道认为虽然超声造影能清晰显示肝肿瘤滋养血管分布情况,辨别病灶滋养血管构架、形态、数目,但针对呼吸能力配合较差和肝右叶严重萎缩者,第一肝门和肝静脉往往显示不清,导致最佳造影图像无法获取,影响判断结果;数字减影血管造影技术可清晰显示病灶内部新生血管特征,但其属有创检查,无法清楚显示分化较好的原发性小肝癌病灶;增强CT主要通过分析碘油沉积不完全区内病灶动态增强强化规律来判断肿瘤是否存活,在TACE术后肿瘤复发评价中具有重要的意义[11,12]。CDFI属传统血流检测技术,具有操作方便、无创、可重复多次检查等优势,能清楚显示肿瘤内碘化油沉积类型与肿瘤坏死的关系,根据各器官血流动力学图像和频谱分析肿瘤内、周边搏动血流及其局部血管位置,评估病灶周边或肿瘤内部门脉血流情况,但无法直观显示低速微小血管,在消除组织运动伪影的同时也滤除了病灶本身细微的血流信号,故在显示微细血管方面的灵敏度较差[13]。SMI作为基于彩色多普勒原理基础上发展而来的一项血流显示新技术,主要经智能化计算及测量方法,准确区分低速血流与组织运动形成的多普勒信号,提取并显示传统多普勒超声作为噪声滤掉的低速血流信息,将最细微低速血流信息存储,在无需使用造影剂情况下,清晰、高帧频实现低流速微小血管可视化,反映组织血流灌注情况,目前已被广泛用于诊断甲状腺病变、乳腺病变、颈动脉斑块、淋巴结病变和肝脏病变等疾病[14]。但目前针对TACE术后PLC患者肿瘤血供显像效果方面,鲜有关于使用增强CT、CDFI和SMI的对比报道,故我们针对此方面进行了探讨。
本研究结果显示,SMI和CDFI病灶血供检出率均显著低于增强CT检查,提示增强CT判断病灶血供的能力优于其他检查[15]。肿瘤生长和远处转移依赖于肿瘤病灶新生血管的形成,而新生血管往往以非芽生或芽生方式向病灶内部及周围生长[16]。现行血流检测技术难以检测病灶内部低速微小血管[17]。CDFI检测是经滤波技术清除噪声和伪像,对低速血流信息的采集不够全面,在显示病灶内微小血管和低速血流方面有一定的缺陷[18]。有报道显示,
CDFI仅能清晰显示病灶内管径为0.2 mm以上的小静脉和小动脉血管,无法检测流速低于1cm/s的低速血流[17]。SMI是采用智能化计算及测量方法显示血流信息,分析杂波运动特性,能准确区分组织运动形成的多普勒信号和低速血流的多普勒信号,清晰显示最低流速为0.8cm/s、管径在0.1 mm以上的低速微小血管,运动伪像较少,帧频高,分辨率强,无需造影剂也能清晰显示低速细小血流。
本研究结果显示,针对直径≥2.0cm或<2.0cm的病灶,SMI和CDFI病灶血供检出率均显著低于增强CT检查,与既往报道[19,20]相符。
