QuEChERS-气相色谱-串联质谱法测定葡萄干中的80种农药残留
2020-03-21粟有志李艳美
刘 俊 杨 飞 粟有志 李 芳 李艳美
(1.中华人民共和国乌鲁木齐海关新疆乌鲁木齐 830063;2.新疆维吾尔自治区分析测试研究院新疆乌鲁木齐 830011;3.中华人民共和国伊宁海关新疆伊宁 835000)
葡萄干富含葡萄糖、有机酸、多酚等多种营养成分,对人体的心血管疾病及代谢疾病有一定的保健功效[1]。农药是防治葡萄病虫害的主要技术手段,其伴随葡萄的生产过程而可能残留于葡萄干中。我国国家标准(GB 2763-2016)规定了苯丁锡、虫酰肼、联苯肼酯等17种农药在葡萄干中的最大残留限量(MRLs)[2],同时欧盟、国际食品法典委员会(CAC)、日本、美国等国家或组织也均对葡萄干中的农药残留设定了严格的MRLs[3]。
目前,多农药残留的检测主要采用气相色谱法[4,5]、气相色谱-质谱法[6,7]、气相色谱-串联质谱法[8,9]、液相色谱-串联质谱法[10,11]等方法,常用于分析新鲜果蔬、中草药和茶叶等样品。文献报道的葡萄干中多农药残留的检测方法以液相色谱-串联质谱法为主。李海艳等[12]利用超高效液相色谱-串联质谱法分析了葡萄干中27种农药残留;张婷亭等[13]建立了超高效液相色谱-串联质谱法测定葡萄干等干果果肉中56种农药残留;粟有志等[14]建立了葡萄干中105种农药残留的高效液相色谱-串联质谱分析方法。而采用气相色谱-串联质谱(GC-MS/MS)法分析葡萄干中的多农药残留鲜有报道。本研究采用改进的QuEChERS前处理方法,结合GC-MS/MS法建立了葡萄干中常用80种农药的分析方法。该方法操作简便快捷、精密度和回收率较好,适合于葡萄干中多农药残留的定量测定及确证。
1 实验部分
1.1 仪器与试剂
Agilent 7890A-7000C气相色谱-串联质谱仪(Agilent公司);N-EVAP-112水浴氮吹仪(Organomation公司);Sigma3-18K台式冷冻离心机(Sigma公司);MS3型涡旋振荡器(IKA公司);GM200刀式混合研磨仪(Retsch公司)。
80种农药标准品均购自德国Dr.Ehrenstorfer GmbH公司;乙腈、丙酮、正己烷、乙酸乙酯、乙酸均为色谱纯,其他试剂为分析纯。乙二胺-N-丙基硅烷(PSA)粒径40~60 μm、苯磺酸化聚苯乙烯/二乙烯苯(PCX)粒径40~60 μm、聚苯乙烯/二乙烯苯(PEP)粒径70~90 μm(Agela公司);酸性氧化铝(ALA)、石墨化炭黑(GCB)和C18、氨基(NH2)粉(Agilent公司)。实验用水为Milli-Q(Millipore公司)超纯水。
实验所用葡萄干样品来自市场随机采样和送检样品。
1.2 标准溶液的配制
精密称取各农药标准品10 mg(精确至0.01 mg)于10 mL容量瓶中,用甲醇溶解并定容至刻度,配成质量浓度为1 000 mg/L的标准储备液,储存于-18 ℃冰箱中。分别取上述单标准储备液,用正己烷-丙酮(1∶1,V/V)稀释定容,配制成各农药组分质量浓度均为5.0 mg/L的混合标准工作溶液,储存在4 ℃冰箱中备用。取混合标准工作溶液用正己烷-丙酮(1∶1,V/V)稀释,配制1、2、5、10、20、50、100、200、500 μg/L的系列标准溶液。
1.3 样品前处理
取代表性样品500 g,置于-20 ℃冰箱放置6 h以上,待样品中水分冻成固态冰后,迅速取出用组织捣碎机加工成粉末状,混匀,密封,作为试样,标明标记。称取2 g试样(精确至0.01 g)于50 mL离心管中,加入6 mL水,放置30 min。加入10 mL 1%乙酸乙腈(1∶99,V/V),加入1.5 g NaCl,10 000 r/min均质 1 min,加入2 g NaCl,涡旋30 s,8 000 r/min离心1 min,取上清液6 mL于15 mL具塞离心管中,加入PSA和PEP各100 mg;加入0.2 g无水MgSO4,涡旋30 s,8 000 r/min离心1 min,取5 mL上清液于15 mL试管中,40 ℃水浴氮吹至干,用1 mL丙酮-正己烷(5∶5,V/V)溶解残渣,过0.22 μm有机滤膜,滤液待测。
1.4 仪器条件
1.4.1 色谱条件色谱柱:HP-5MS UI柱(30 m×0.25 mm×0.25 μm);色谱柱升温程序:80 ℃(保持1 min),以25 ℃/min升温至150 ℃,以5 ℃/min速率升温到200 ℃(保持2 min),以10 ℃/min升温至280 ℃(保持6 min)。载气:高纯He(纯度>99.999%);柱流量:1.2 mL/min;进样方式:无分流进样;进样体积:1 μL;进样口温度:260 ℃。
1.4.2 质谱条件电子轰击(EI)电离,电离能量70 eV;离子源温度:230 ℃;传输线温度:280 ℃;碰撞气:氩气(纯度99.999%);扫描方式:多反应监测(MRM)模式检测;溶剂延迟4 min。80种农药的名称、保留时间及质谱参数见表1。

表1 80种农药的保留时间及优化的GC-MS/MS参数Table 1 Retention times and optimized GC-MS/MS conditions for 80 pesticides
(续表1)
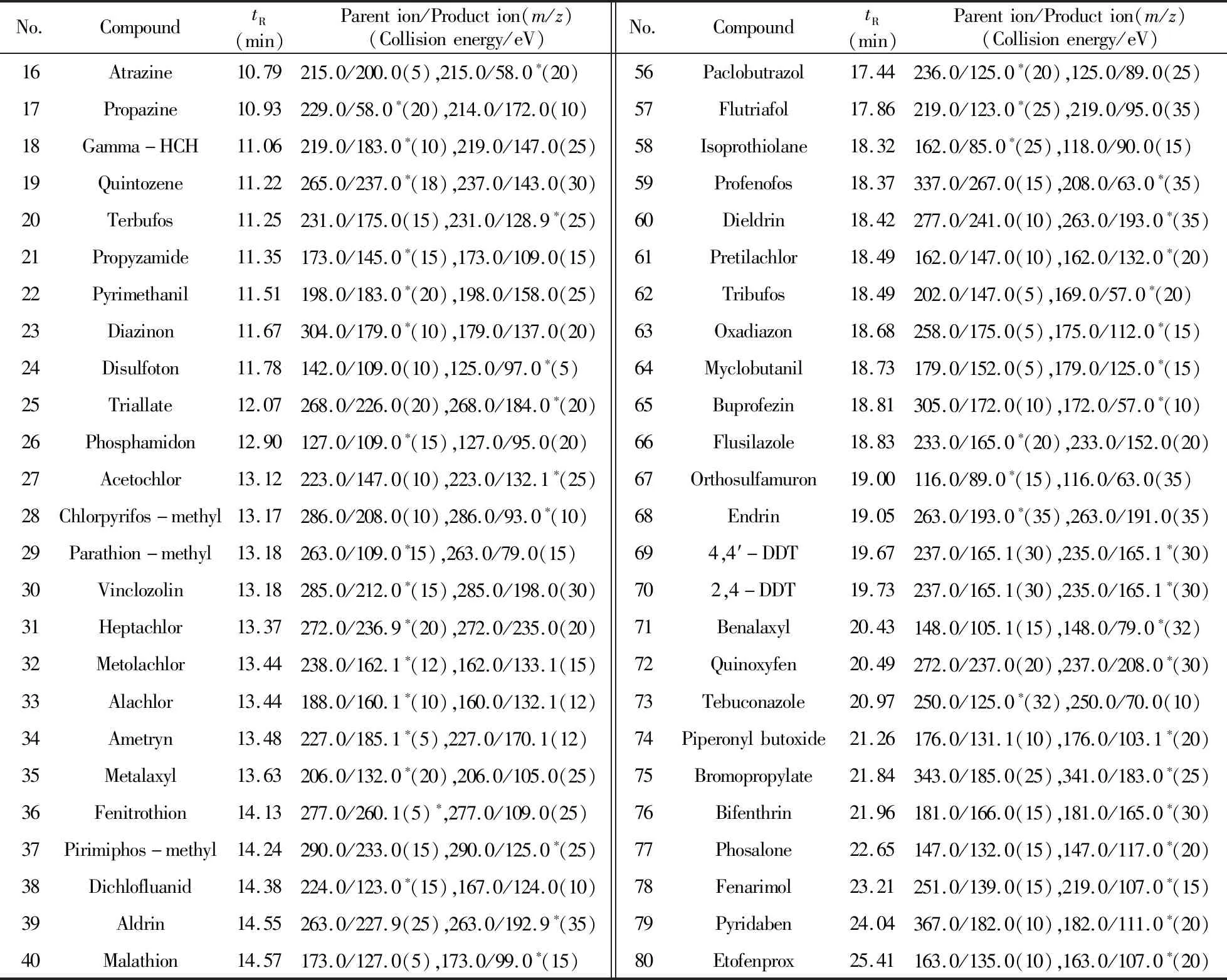
No.CompoundtR(min)Parention/Production(m/z)(Collisionenergy/eV)No.CompoundtR(min)Parention/Production(m/z)(Collisionenergy/eV)16Atrazine10.79215.0/200.0(5),215.0/58.0∗(20)56Paclobutrazol17.44236.0/125.0∗(20),125.0/89.0(25)17Propazine10.93229.0/58.0∗(20),214.0/172.0(10)57Flutriafol17.86219.0/123.0∗(25),219.0/95.0(35)18Gamma-HCH11.06219.0/183.0∗(10),219.0/147.0(25)58Isoprothiolane18.32162.0/85.0∗(25),118.0/90.0(15)19Quintozene11.22265.0/237.0∗(18),237.0/143.0(30)59Profenofos18.37337.0/267.0(15),208.0/63.0∗(35)20Terbufos11.25231.0/175.0(15),231.0/128.9∗(25)60Dieldrin18.42277.0/241.0(10),263.0/193.0∗(35)21Propyzamide11.35173.0/145.0∗(15),173.0/109.0(15)61Pretilachlor18.49162.0/147.0(10),162.0/132.0∗(20)22Pyrimethanil11.51198.0/183.0∗(20),198.0/158.0(25)62Tribufos18.49202.0/147.0(5),169.0/57.0∗(20)23Diazinon11.67304.0/179.0∗(10),179.0/137.0(20)63Oxadiazon18.68258.0/175.0(5),175.0/112.0∗(15)24Disulfoton11.78142.0/109.0(10),125.0/97.0∗(5)64Myclobutanil18.73179.0/152.0(5),179.0/125.0∗(15)25Triallate12.07268.0/226.0(20),268.0/184.0∗(20)65Buprofezin18.81305.0/172.0(10),172.0/57.0∗(10)26Phosphamidon12.90127.0/109.0∗(15),127.0/95.0(20)66Flusilazole18.83233.0/165.0∗(20),233.0/152.0(20)27Acetochlor13.12223.0/147.0(10),223.0/132.1∗(25)67Orthosulfamuron19.00116.0/89.0∗(15),116.0/63.0(35)28Chlorpyrifos-methyl13.17286.0/208.0(10),286.0/93.0∗(10)68Endrin19.05263.0/193.0∗(35),263.0/191.0(35)29Parathion-methyl13.18263.0/109.0∗15),263.0/79.0(15)694,4′-DDT19.67237.0/165.1(30),235.0/165.1∗(30)30Vinclozolin13.18285.0/212.0∗(15),285.0/198.0(30)702,4-DDT19.73237.0/165.1(30),235.0/165.1∗(30)31Heptachlor13.37272.0/236.9∗(20),272.0/235.0(20)71Benalaxyl20.43148.0/105.1(15),148.0/79.0∗(32)32Metolachlor13.44238.0/162.1∗(12),162.0/133.1(15)72Quinoxyfen20.49272.0/237.0(20),237.0/208.0∗(30)33Alachlor13.44188.0/160.1∗(10),160.0/132.1(12)73Tebuconazole20.97250.0/125.0∗(32),250.0/70.0(10)34Ametryn13.48227.0/185.1∗(5),227.0/170.1(12)74Piperonylbutoxide21.26176.0/131.1(10),176.0/103.1∗(20)35Metalaxyl13.63206.0/132.0∗(20),206.0/105.0(25)75Bromopropylate21.84343.0/185.0(25),341.0/183.0∗(25)36Fenitrothion14.13277.0/260.1(5)∗,277.0/109.0(25)76Bifenthrin21.96181.0/166.0(15),181.0/165.0∗(30)37Pirimiphos-methyl14.24290.0/233.0(15),290.0/125.0∗(25)77Phosalone22.65147.0/132.0(15),147.0/117.0∗(20)38Dichlofluanid14.38224.0/123.0∗(15),167.0/124.0(10)78Fenarimol23.21251.0/139.0(15),219.0/107.0∗(15)39Aldrin14.55263.0/227.9(25),263.0/192.9∗(35)79Pyridaben24.04367.0/182.0(10),182.0/111.0∗(20)40Malathion14.57173.0/127.0(5),173.0/99.0∗(15)80Etofenprox25.41163.0/135.0(10),163.0/107.0∗(20)
*quantification transition.
2 结果与讨论
2.1 农药种类的选择
本文选择食品安全国家标准(GB 2763-2014)《食品中农药最大残留限量》所规定的葡萄干中的限量农药,以及葡萄生产过程中经常使用的农药作为分析对象,最后选择适宜于GC-MS/MS分析的80种农药作为研究对象。
2.2 仪器条件的优化
首先对农药单一标准溶液(浓度为10 mg/L)在m/z50~500之间进行全扫描,确定分析物一级质谱图和保留时间。从一级质谱图中选择灵敏度高、质荷比较大(m/z>100)的离子初步定为母离子。对选定的母离子用子离子扫描的方式,确定二级质谱图,从中选择信号较高的离子作为子离子。对每一组母离子/子离子,分别选择碰撞能量为5、10、15、20、25、30、35、40 eV进行扫描,以响应信号强弱为依据对碰撞能量进行优化;以此优化的碰撞能量为基础进行微调,得到最优的碰撞能量。根据分析物的保留时间将扫描分为9个扫描窗口,调整每个时间段内的离子对扫描时间,保证每个分析物色谱峰的采集点数量在20个点左右,并且响应值满足要求。80种农药标准品的母离子、子离子及碰撞能量见表1。
2.3 前处理条件的优化
2.3.1 提取溶剂的选择由于葡萄干水分含量较少,用提取溶剂直接提取样品中农药时,回收率较差。本文选择先用水浸泡样品,使样品基质分散从而保证回收率。本文考察了正己烷-丙酮(1∶1,V/V)、正己烷、乙酸乙酯、丙酮、乙腈、乙酸-乙腈(1∶99,V/V)、10 mL乙酸-乙腈7种提取溶剂对80种农药的提取效果,结果见表2。由表2可知乙酸-乙腈+NAc体系的提取效果较好。

表2 不同提取溶剂对葡萄干中80种农药的添加回收率结果(n=3)Table 2 The recoveries of 80 pesticide residues in raisin by using different extraction solvents
2.3.2 吸附剂的选择传统的QuEChERS前处理一般选择PSA、C18和GCB作为吸附剂净化样品。本文比较了C18、GCB、NH2、PCX、PEP、PSA、ALA 7种吸附剂对样品的净化效果。7种吸附剂的用量均为200 mg,结果表明C18净化时,四氯硝基苯、甲基嘧啶磷、丁苯吗啡、氟菌唑、噻嗪酮5种农药的回收率小于60%;GCB净化时,四氯硝基苯、西玛津、五氯硝基苯等17种农药的回收率小于60%;NH2净化时,苯氟磺胺、恶草酮回收率小于60%;PCX净化时,四氯硝基苯、二苯胺、西玛津等21种农残回收率不能满足要求;ALA净化时,乙拌磷、氯苯嘧啶醇的回收率小于60%;PEP和PSA时,80种农药的回收率均可满足方法学的要求。故本文将传统QuEChERS前处理的PSA、C18和GCB填料改为PEP和PSA,选择二者共同净化样品。经净化的空白葡萄干、空白葡萄干加标样品的色谱图见图1。

图1 空白葡萄干样品(A)和空白葡萄干样品中添加20 μg/kg农药标准(B)的总离子流色谱图Fig.1 Total ion current chromatograms of a negative raisin sample(A)and a negative raisin sample spiked mixed pesticide standard solution at 20 μg/kg(B)Nos.1-80 are the same as Table 1.
2.4 线性关系、检出限和定量限
实验发现,样品基质对大部分的农药有一定的抑制或增强作用,而采用基质匹配标准曲线可有效消除样品基质效应。空白样品按照1.3前处理,配制质量浓度为1、2、5、10、20、50、100、200、500 μg/L的基质匹配混合标准溶液。以峰面积(y)对农药的质量浓度(x)作线性回归,绘制标准曲线,80种农药在葡萄干基质中的相关系数均大于0.991。按照信噪比(S/N)≥3确定方法的检出限(LOD),其范围为0.2~6.2 μg/kg;以S/N≥10确定方法的定量限(LOQ),其范围为0.6~20.5 μg/kg。80种农药的基质匹配标准曲线线性范围、相关系数、检出限和定量限详见表3。
2.5 加标回收率和精密度
选择葡萄干空白样品,以20、50、100 μg/kg为加标水平进行回收率实验。添加了农药混合标准溶液的空白样品,静置60 min,然后按照1.3和1.4进行前处理和仪器测定,每个水平重复6次。回收率和相对标准偏差见表3。从表3可以看出,80种农药的回收率在62.5%~116.6%之间,相对标准偏差(RSD)为3.3%~15.4%。该方法的准确度高,精密度好,通用性强。

表3 80农药在葡萄干基质中的标准曲线线性范围、相关系数、回收率、相对标准偏差、检出限和定量限(n=6)Table 3 Linear ranges,correlation coefficient(r2),recoveries,relative standard deviations(RSDs),limits of detection(LOD) and limits of quantification(LOQ) of 80 pesticides in raisin(n=6)
(续表3)

CompundLinearrange(μg/L)r220μg/kg50μg/kg100μg/kgRecovery(%)RSD(%)Recovery(%)RSD(%)Recovery(%)RSD(%)LOQLODTetraconazole5-5000.998194.98.976.14.095.98.11.44.5Cyprodinil10-5000.998894.49.775.86.678.67.72.99.8Pendimethalin10-5000.9995114.77.781.311.088.34.62.89.4Penconazole10-5000.999185.96.381.57.8108.34.31.96.3Phenthoate5-5000.9993112.44.669.13.4101.19.71.13.8Procymidone5-5000.999594.811.081.310.8106.84.81.44.8Triflumizole20-5000.998693.410.5105.05.280.310.46.020.1Methidathion5-5000.999576.24.081.011.4114.36.91.55.0Paclobutrazol5-5000.9991106.13.4104.06.986.76.91.65.3Flutriafol5-5000.9991112.514.699.06.689.68.61.44.5Isoprothiolane10-5000.9995105.910.497.64.885.610.32.68.7Profenofos2-5000.997998.710.8101.14.195.18.70.92.9Dieldrin2-5000.9991101.012.4103.33.4104.66.90.82.8Tribufos2-5000.999198.67.297.17.1103.810.31.03.3Pretilachlor10-5000.999299.014.598.05.4101.47.42.99.8Oxadiazon2-5000.9993105.814.0105.24.8116.612.50.51.5Myclobutanil20-5000.9989100.911.199.49.487.76.24.515.0Buprofezin5-5000.998775.69.279.67.983.47.71.54.9Flusilazole5-5000.998997.57.696.36.392.411.21.44.5Orthosulfamuron10-5000.999082.33.682.15.984.36.72.99.5Endrin20-5000.999186.14.279.35.492.68.26.220.54,4′-DDT10-5000.996595.74.992.810.082.15.42.99.62,4-DDT5-5000.999794.27.194.09.686.78.11.54.9Benalaxyl20-5000.9995100.110.6105.46.080.15.95.518.3Quinoxyfen10-5000.998891.28.795.36.467.09.92.99.6Tebuconazole20-5000.998190.76.893.54.676.07.85.919.6Piperonylbutoxide20-5000.995599.08.582.29.587.54.14.816.0Bromopropylate5-5000.999498.43.394.010.182.97.11.55.0Bifenthrin20-5000.9989102.73.583.710.385.43.55.518.2Phosalone20-5000.9981102.55.195.17.685.14.45.618.5Fenarimol20-5000.9979102.05.879.37.098.07.15.317.8Pyridaben20-5000.9952106.45.699.24.168.06.65.919.7Etofenprox20-5000.999487.45.891.13.681.36.86.120.3
2.7 样品的测定
利用本文建立的分析方法对市售的50份葡萄干样品进行检测,农药的检出率为14.0%。5种农药被检出:戊菌唑(2批)、甲霜灵(2批)、氯苯嘧啶醇(1批)、特丁硫磷(1批)、马拉硫磷(1批),但均未超出国内外最大允许残留限量值。
3 结论
本文建立了QuEChERS前处理,结合气相色谱-串联质谱(GC-MS/MS)法测定葡萄干中80种农药残留的分析方法。该方法的准确度和精密度符合残留分析的方法学要求,基本满足欧盟及美国、日本等国的限量要求,适用于葡萄干中多农药残留的检测。
