荧光聚多巴纳米粒子在血红蛋白检测中的应用
2020-03-20路普亮赵艳芳
常 超 路普亮 赵艳芳*
(1.青岛农业大学化学与药学院山东青岛266109;2.青岛中维安全检测有限公司山东青岛 266111)
在临床诊断中准确快速的测定血红蛋白含量对于评估贫血程度及相关疾病至关重要。常用的血红蛋白的检测方法主要有荧光法[1-3]、比色法[4]、电化学法[5-7]等。然而这些方法中有的需要昂贵的试剂,有的探针制备方法复杂,有的需要进行繁琐的电极修饰,有的抗干扰能力差,故而开发简单、灵敏、成本低的血红蛋白检测方法具有实际意义。随着纳米材料制备技术的引入,荧光分析法得到了迅猛发展。量子点、碳纳米点、荧光金属纳米簇、稀土掺杂上转换发光纳米材料等新材料作为新型荧光探针,拓展了荧光分析法在食品、环境、生物检测等方面的应用[8-10]。荧光聚合物纳米粒子(Fluorescent Organic Nanoparticles,FONPs)因其具有稳定的形态结构,良好光稳定性和生物安全性而引起人们的广泛关注[11]。制备FONPs通常是以包埋、掺杂或共价键合的方式,将疏水性荧光有机染料结合进聚合物纳米粒子中,但这种制备方法往往存在染料泄露、合成步骤复杂、分散性差等不足[12]。
多巴胺(4-(2-氨基乙基)-1,2-苯二酚)可在碱性有氧条件下自聚合生成具有强粘附特性的聚多巴胺而被广泛应用于材料表面改性、催化、药物输送、传感检测等领域[13]。2012年,Zhang等[14]首次报道了用H2O2氧化聚多巴胺制备了荧光聚多巴胺纳米粒子,该材料表现出良好的荧光性能、优异的水溶性和生物相容性。自此,各种荧光聚多巴胺材料被广泛报道[15-17]。多巴胺是多巴(3,4-二羟基-L-苯基丙氨酸)的脱羧产物,多巴有与多巴胺类似的结构和性质,多巴亦可通过自聚反应制得各种功能性材料[18]。然而,目前对于荧光聚多巴材料的研究还很少。我们曾报道[19]了采用一种在碱性乙醇条件下一步合成荧光聚多巴纳米粒子的新方法,该方法无需高温加热及强氧化性试剂处理,所制备的聚多巴纳米粒子表现出良好的荧光特性、单分散性及稳定性。本实验发现血红蛋白可以灵敏的猝灭聚多巴纳米粒子的荧光,基于血红蛋白对聚多巴纳米粒子荧光的猝灭现象发展了一种快速、灵敏的检测血红蛋白的荧光分析方法。与其它测定血红蛋白的方法相比,发展的方法具有探针合成简便、成本低及线性范围宽、灵敏度高的优点。
1 实验部分
1.1 仪器与试剂
FL-4600荧光仪(日本,日立公司);TU-1900双光束紫外-可见分光光度仪(北京普析通用公司);KQ-400KT数控超声仪(中国曙峰公司);Milli-Q净水器(美国,密理博公司)。
血红蛋白(Hb)、人血清蛋白(HSA)、细胞色素c(Cyt c)、肌红蛋白(Mb)购自沃辛顿生化公司;多巴(L-Dopa)购自阿拉丁公司;NaOH、NaHCO3、NaCl、MgCl2、CaCl2、KCl、NaH2PO4、Na2HPO4、葡萄糖(Glu)、抗坏血酸(Vc)、无水乙醇均为分析纯,购自上海国药公司。实验用水为二次蒸馏水。
1.2 荧光聚多巴纳米粒子的制备
参照文献方法[19]制备荧光聚多巴纳米粒子:准确称取10.0 mg多巴,10.0 mg NaOH加入到15 mL离心管中,随后加入10 mL无水乙醇,常温下超声反应1 h,将得到的溶液在高速离心机中分别以10 000、12 000 r/min离心两次,每次15 min,除去颗粒较大的聚合物,将上清液冷冻干燥后,即得。
1.3 血红蛋白的检测
将聚多巴纳米粒子分散于20 mmol/L的磷酸盐缓冲溶液(PBS,pH=3.0)中,配制成1.0 mg/mL的储备溶液待用。在离心管中分别加入50 μL荧光聚多巴纳米粒子分散液,20 μL不同浓度的血红蛋白,以及930 μL PBS(pH=3.0,20 mmol/L),混合均匀后避光反应2 min,在310 nm激发波长和490 nm发射波长下进行荧光检测,激发和发射狭缝宽度均为5 nm。
1.4 实际样品测定
将采集的10 μL指尖血样用二次水稀释至5 mL并孵育振荡20 min,从而释放出血红蛋白。然后将该样品溶液以3 000 r/min离心分离10 min,取10 μL的上清液加入940 μL PBS和50 μL聚多巴纳米粒子溶液,按1.3节方法进行检测。
2 结果与讨论
2.1 聚多巴纳米粒子的性质
分别将聚多巴纳米粒子分散于酸性(pH=3.0)和碱性(pH=8.0)缓冲溶液中,在酸性条件下聚多巴粒子呈球形且分布均匀,尺寸在20~30 nm间,如图1A所示。聚多巴纳米粒子在酸性条件表现出良好的稳定性和荧光增强现象,这与文献报道一致[19]。聚多巴粒子在碱性条件下稳定性较差,并且荧光会随着时间增长而逐渐降低,这可能是由于在碱性条件下聚多巴纳米粒子间会继续发生聚合反应,尺寸持续增大并发生聚集现象而引起的(图1B)。故后续的实验中,考察聚多巴纳米粒子的光学特性及应用时都是将其分散于PBS(pH=3.0)中进行的。

图1 荧光聚多巴纳米粒子分散在pH=3.0(A)和pH=8.0(B)的磷酸盐缓冲溶液中的透射电镜(TEM)图Fig.1 TEM images of ploy(DOPA) nanoparticles in phosphate buffer with different pH(A) pH=3.0;(B) pH=8.0.
由聚多巴纳米粒子的红外光谱(图2A)可见,在3 600~3 100 cm-1处出现的宽峰为O-H和N-H 的伸缩振动吸收峰,在1 630 cm-1与1 430 cm-1处出现的吸收带则表明存在-COO-与-NH基团,1 140 cm-1处为苯环上的C-O伸缩振动吸收,860 cm-1为苯环上的C-H弯曲振动吸收。聚多巴纳米粒子的紫外-可见光谱和荧光发射光谱如图2B所示。聚多巴纳米粒子在280 nm和350 nm处有两个紫外吸收峰。其荧光发射光谱范围约为400~600 nm,当激发波长从300 nm变化到380 nm,其荧光强度随激发波长的增加先增大后减小,在激发波长为310 nm时达到最大值,此时最大发射波长为490 nm。在可见光下聚多巴纳米粒子溶液呈无色透明状,而在365 nm波长紫外灯下则发出明亮的绿色荧光(图2B内插图),表明所制备的聚多巴纳米粒子具有良好的光致发光特性,并以硫酸奎宁为参比计算其荧光量子产率为23.2%。
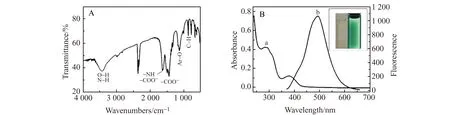
图2 (A)聚多巴纳米粒子红外光谱图;(B)紫外-可见吸收(a)及荧光发射(b)光谱(内插图为聚多巴纳米粒子在可见光(左)和紫外灯(右)下的照片)Fig.2 (A) Infrared spectrum of play(DOPA) nanoparticles;(B) UV-Vis absorption(a) and fluorescence emission(b) spectra of ploy(DOPA) nanoparticles(Insets show the photographs of prepared ploy(DOPA) nanoparticles under visible light(left) and 365 nm UV lamp light(right))
聚多巴纳米粒子也表现出良好的抗光漂白性和盐稳定性。如图3A所示,用氙灯连续照射荧光聚多巴纳米粒子30 min后,材料的荧光强度仅有略微下降;在不同盐浓度下材料的荧光强度无明显变化(图3B),表明聚多巴纳米粒子有良好的盐稳定性,可适用于复杂的生物体系检测;聚多巴纳米粒子的荧光强度随pH值的增大逐渐降低(图3C),当pH=3.0时荧光强度最强并且在此pH值及避光条件下聚多巴纳米粒子的荧光强度在30 d内无明显变化。
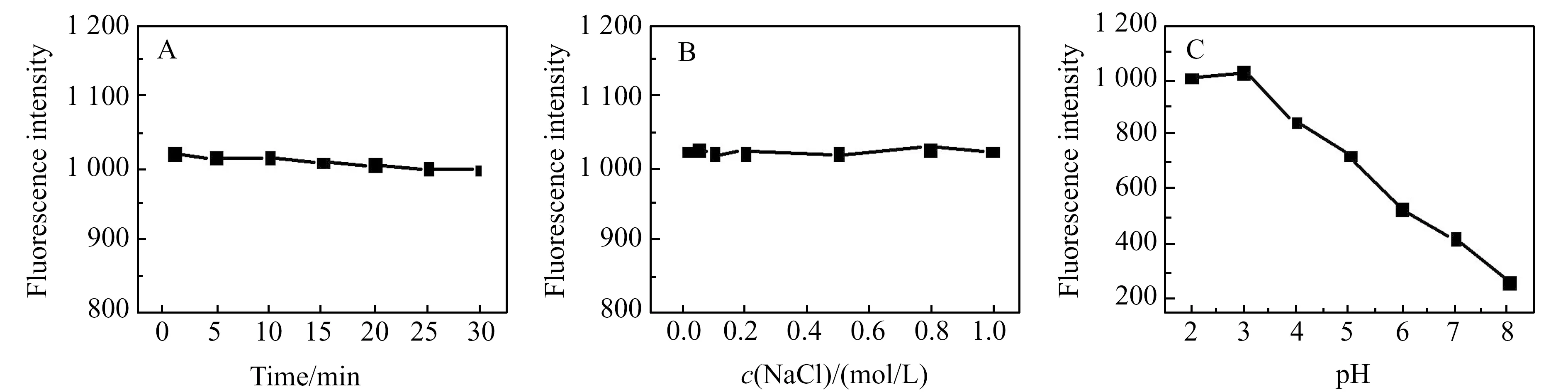
图3 聚多巴纳米粒子的光稳定性(A)、盐稳定性(B)和不同pH(C)下的荧光强度Fig.3 The stability of ploy(DOPA) nanoparticles during continuous excitation with a UV beam(A),in a salt medium(B) and fluorescence intensity changes at different pH values(C)
2.2 血红蛋白检测
实验分别采用磷酸盐、柠檬酸盐和乙酸盐缓冲体系,在pH=3.0~6.0范围内考察了缓冲体系及pH对聚多巴纳米粒子荧光猝灭效率的影响。实验结果表明,在pH=3.0的磷酸盐缓冲体系中的荧光猝灭效率达到最大值。体系中聚多巴纳米粒子浓度(0.01~0.1 mg/mL)对荧光猝灭效率也存在影响,实验发现随着聚多巴纳米粒子浓度的增大,猝灭效率逐渐增大,但当聚多巴纳米粒子浓度超过0.05 mg/mL时,猝灭效率反而下降,故选择聚多巴纳米粒子最佳浓度为0.05 mg/mL。实验又考察了反应时间对测定的影响,结果发现将探针与血红蛋白溶液混合均匀后,2 min即可达到到稳定的荧光强度值,并且30 min内荧光强度保持不变,这说明基于聚多巴纳米粒子的荧光探针具有快速响应特征。如图4A所示,聚多巴纳米粒子的荧光随着血红蛋白浓度的增加逐渐降低,当血红蛋白浓度增加到650 mg/L时其荧光几乎完全消失。血红蛋白的吸收光谱与聚多巴纳米粒子的激发和发射光谱均有部分重叠,可能是由于内滤效应的作用导致聚多巴纳米粒子发生荧光猝灭现象[20]。在优化条件下,血红蛋白对聚多巴纳米粒子的荧光猝灭效率(F0-F)/F0(F0、F分别为加入血红蛋白前后聚多巴纳米粒子的荧光强度)在0.065~5.9 mg/L和6.5~65 mg/L浓度范围内表现出了良好的线性关系(图4B),其线性方程分别为:Y=0.0026X+0.0446(R2=0.9961)和Y=0.0004X+0.3531(R2=0.9904),检出限(S/N=3)为0.0098 mg/L。
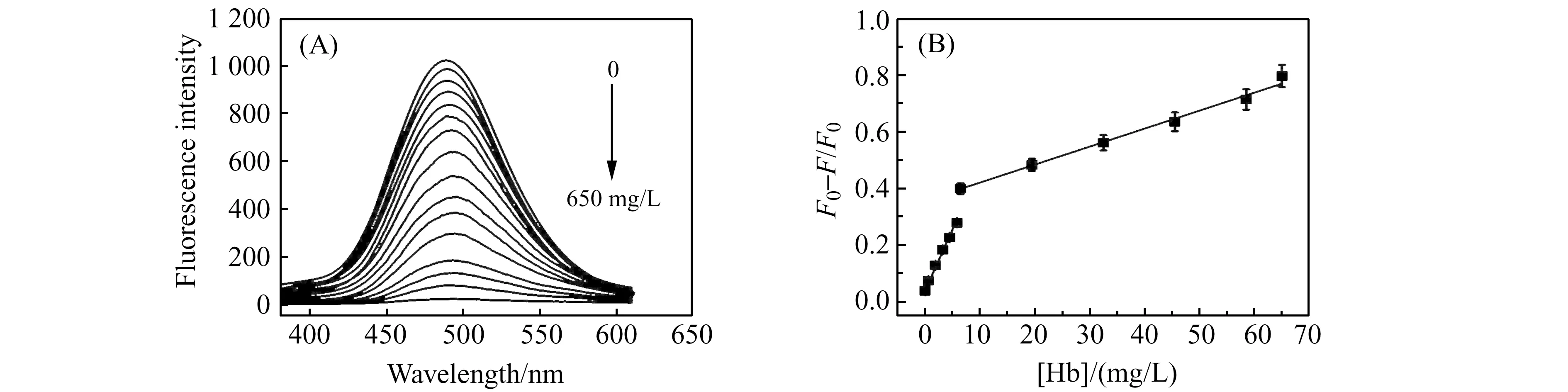
图4 (A)血红蛋白浓度对聚多巴纳米粒子荧光发射光谱的影响;(B)不同浓度血红蛋白与荧光强度线性拟合曲线Fig.4 (A)Fluorescence quenching of ploy(DOPA) nanoparticles upon addition of hemoglobin at different concentrations;(B) Linear fitting curve of the fluorescence intensity towards the concentration of hemoglobin
2.3 方法的选择性
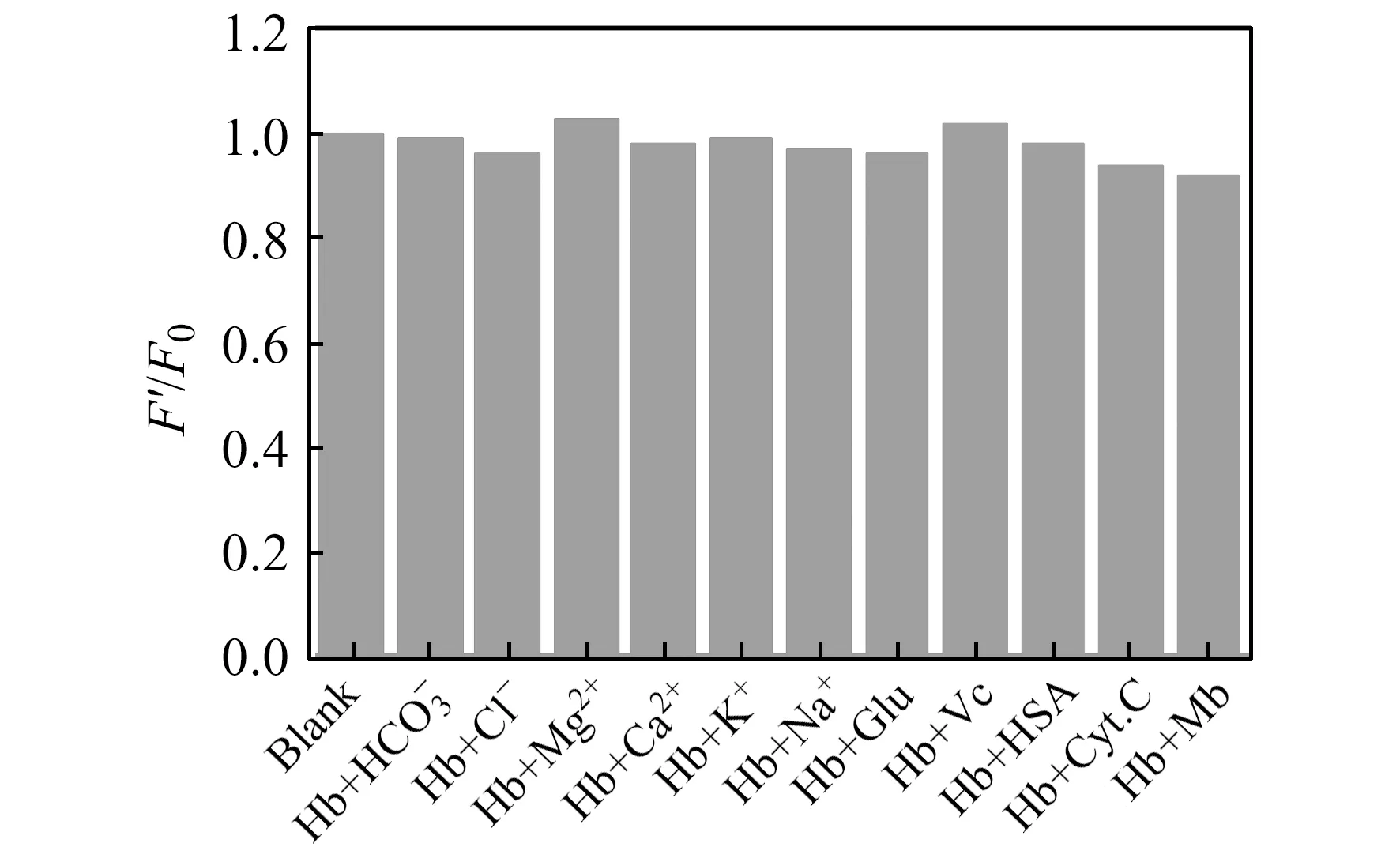
图5 检测血红蛋白的选择性Fig.5 Selectivity of the fluorescence quenching assay using ploy(DOPA) nanoparticles for hemoglobinConcentration of ploy(DOPA) nanoparticles is 0.05 mg/mL;concentration of each metal ion,Glu and Vc is 1 μmol/L,respectively;concentration of HAS,Cyt c and Mb is 3.3 mg/L、0.60 mg/L、0.84 mg/L,respectively.
虽已有众多文献采用不同的荧光纳米材料实现了血红蛋白的荧光测定(表1),但文献[1]和[20]中柠檬酸碳点、丙三醇碳点的合成需要长时间高温水热反应,而本文所使用的聚多巴纳米粒子反应条件温和,无需复杂的仪器设备,无需高温及强氧化试剂,后处理简单;与文献[2]相比,聚多巴纳米粒子合成步骤简便;与文献[21]和[22]采用金纳米点和金纳米簇相比,聚多巴纳米粒子成本低廉,易于推广。此外本方法具有较高的灵敏度和较宽的线性范围,适用于血红蛋白的快速测定。
2.4 实际样品测定
为了评价所构建的荧光检测方法对实际血样中血红蛋白的检测性能,对两份志愿者的血样进行了检测,并进行了加标回收实验。由表2可知,方法加标回率在94.6%~106.8%之间,相对标准偏差(RSD)小于3.67%。说明本方法有良好的准确度和精密度,可用于实际血样的测定。
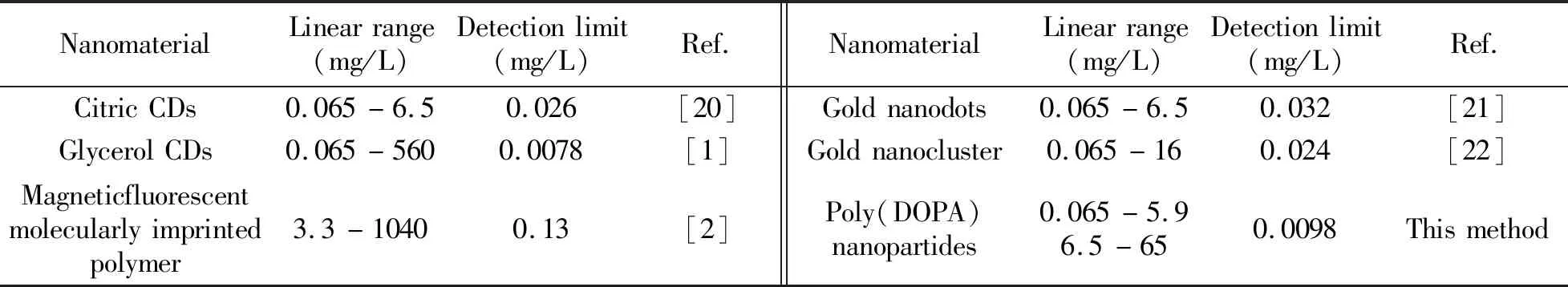
表1 基于不同材料的荧光法检测血红蛋白的性能比较Table 1 Comparison of fluorescence methods for the determination of hemoglobin

表2 血样中血红蛋白的测定Table 2 Detection of hemoglobin in human blood samples
3 结论
本实验采用简单的一步法在室温下合成了性能优异的荧光聚多巴纳米粒子,并且将其用于血红蛋白的快速测定,回收率和选择性良好。该方法合成步骤简单、成本低廉、绿色环保,拓展了新型荧光聚多巴纳米粒子在分析检测中的应用。
