Fe3O4-SiO2-氧化石墨烯-氨基酸离子液体复合材料磁性固相萃取-电感耦合等离子体发射光谱法分离分析环境水样中痕量Cd(Ⅱ)
2020-03-20朱霞石
顾 颖 李 萌 朱霞石*
(1.扬州大学广陵学院江苏扬州 225002)(2.江苏捷通检验认证有限公司江苏扬州 225009)
镉是一种剧毒元素,其生物蓄积性强,当人体对镉的摄入达到一定值,人体内各个器官会发生不同程度的损伤,可造成免疫系统及心血管系统紊乱,诱发疾病。Cd(Ⅱ)污染来源一般分为两种,一是在矿石开采过程中的废水;二是镍镉电池厂的工业废水[1]。由于Cd(Ⅱ)在环境水样中浓度较低,难以通过电感耦合等离子体发射光谱法(ICP-OES)直接检测,因此,测定前需要对Cd(Ⅱ)进行预富集。本文采用磁性固相萃取(MSPE)对环境水样中Cd(Ⅱ)进行预富集。与传统的固相萃取技术相比,MSPE具有萃取速度快、操作简便、可通过外加磁场进行分离等优点。因此,自21世纪被发现以来,MSPE被广泛应用于环境科学、食品科学等方面。Fe3O4具有磁性强、廉价易得、易于制备等优点,是最常见的磁性固相萃取剂。但裸露的Fe3O4易团聚、易氧化、表面羟基少,很多研究者在其表面进行修饰[2-7],以弥补其缺陷。
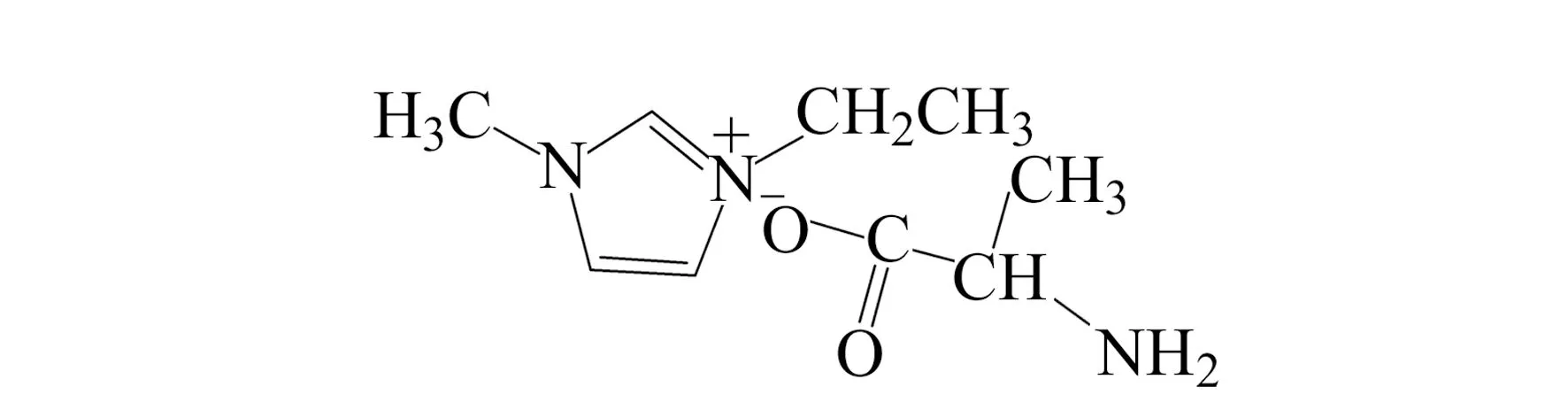
图1 1-甲基咪唑丙氨酸离子液体结构式Fig 1 Structure of 1-methyl imidazole alanine
离子液体(IL)是一种在室温下呈现液态,由有机或无机阴离子和有机阳离子组成的绿色溶剂。由于其具有非极性,极低的蒸气压和极高的热稳定性,常被作为溶剂用于催化、环境化学及电化学等领域。将传统IL的阴离子换成氨基酸后,可以合成氨基酸离子液体(Amino Acid Ionic Liquid,AAIL)。与传统IL相比,AAIL具有无毒性及更好的生物相容性等优点。氧化石墨烯(GO)是石墨烯的衍生物,具有更优秀的物理和化学性质,它的表面含有大量含氧基团,氧化石墨烯的复合材料可作为性能优良的新型吸附剂。
本研究将1-甲基咪唑丙氨酸离子液体(图1)负载在GO上,合成了Fe3O4-SiO2-GO-AAIL复合材料,将该复合材料作为磁性固相萃取剂,并与ICP-OES法联用,分离分析测定环境水样中痕量Cd(Ⅱ)。将该方法用于实际样品检测,获得较好的结果。
1 实验部分
1.1 仪器与试剂
Optima 8300电感耦合等离子体发射光谱仪(美国,铂金埃尔默公司);Zeiss Supra 55场发射扫描电镜(德国,卡尔蔡司公司);DZF-6020真空干燥箱(上海精宏实验设备有限公司);SHA-C恒温振荡器(国华)。
Cd(Ⅱ)单元素标准溶液购自国家有色金属及电子材料分析测试中心。以1%HNO3稀释定容Cd(Ⅱ)单元素标准溶液,得到Cd(Ⅱ)储备溶液。FeCl3、FeSO4·7H2O、聚乙二醇、氨水、正硅酸四乙酸、N-羟基丁二酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺乙酸盐、N,N-二甲基甲酰胺、水合肼85%、(3-氨丙基)三乙氧基硅、1-溴代己烷、甲基咪唑、乙腈、甲醇等试剂均为分析纯,购于国药集团化学试剂有限公司;多层GO(苏州恒球科技公司生产)。实验用水由Synergy纯水机(德国默克密理博公司)制备。
1.2 Fe3O4-SiO2-GO -AAIL复合材料制备
Fe3O4-SiO2-GO参照文献[8]的方法制备。1-甲基咪唑丙氨酸离子液体(AAIL)参照文献[9]的方法制备。将0.10 g AAIL溶于10.0 mL甲醇,并向其中加入0.10 g Fe3O4-SiO2-GO,间歇超声2 h后,用甲醇洗涤3次,真空干燥,得到Fe3O4-SiO2-GO-AAIL复合材料。
1.3 实验方法
1.3.1 样品采集分别采集工厂附近河流水样、污水站处理过的污水水样和风景区周围水质较差河流水样,经0.45 μm微孔滤膜过滤后,4 ℃避光储存,备用。
1.3.2 磁性固相萃取准确移取1.0 mL 0.5 μg/mL Cd(Ⅱ)标准溶液于离心管中,加入0.5 mL (NH4)2SO4溶液,定容至40 mL,加入15 mg Fe3O4-SiO2-GO-AAIL复合材料。室温振摇50 min后,外加磁铁分离,取上层清液用ICP-OES法测定。向吸附了Cd(Ⅱ)的Fe3O4-SiO2-GO-AAIL复合材料中,加入9 mL 0.5 mol/L HCl,室温振摇50 min后,外加磁铁分离,取上层清液用ICP-OES法测定。
2 结果与讨论
2.1 Fe3O4-SiO2-GO -AAIL表征
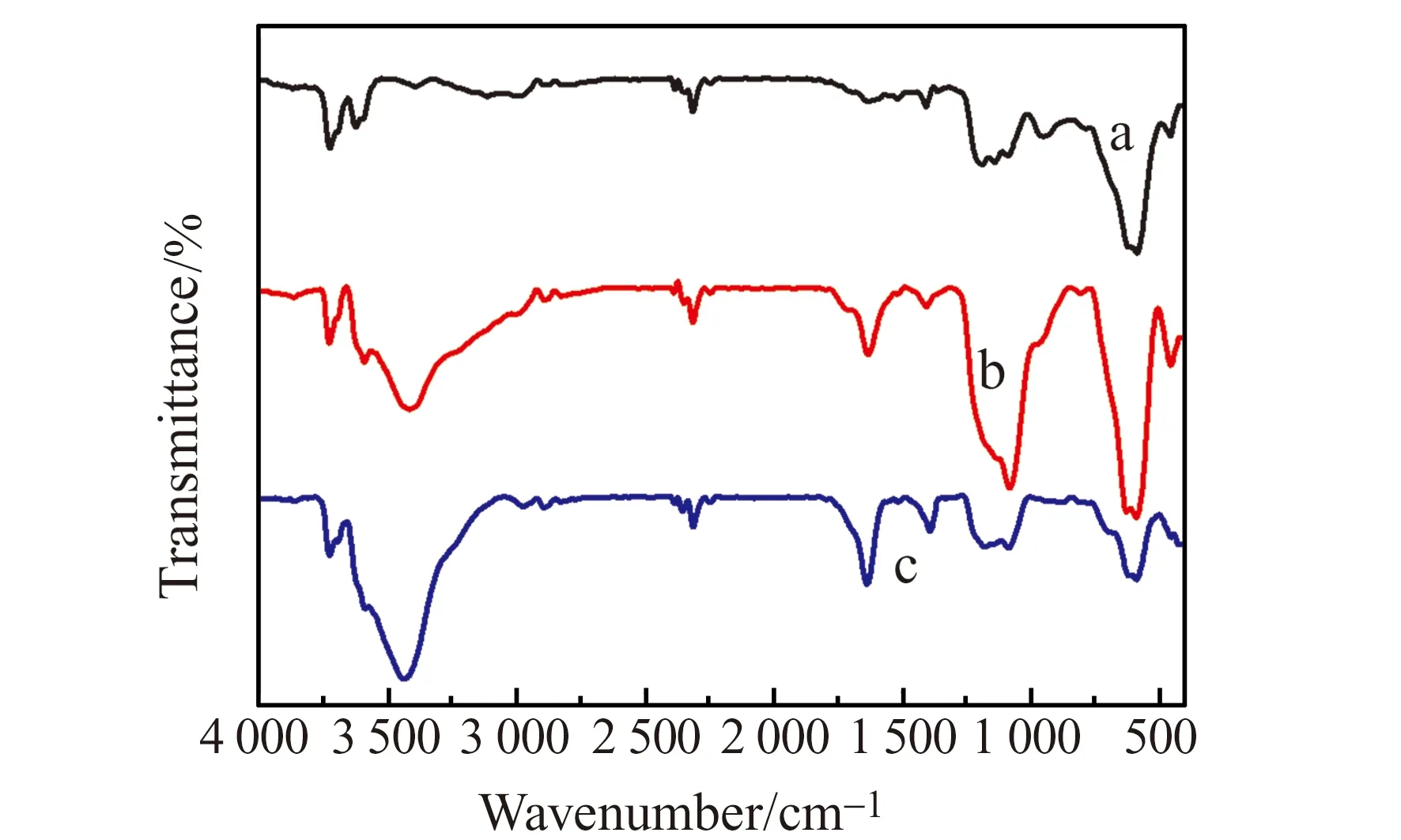
图2 Fe3O4-SiO2(a)、Fe3O4-SiO2-GO(b)和Fe3O4-SiO2-GO-AAIL(c)的红外(IR)光谱Fig.2 IR spectra of Fe3O4-SiO2(a),Fe3O4-SiO2-GO(b) and Fe3O4-SiO2-GO-AAIL(c)
2.1.1 红外光谱Fe3O4-SiO2、Fe3O4-SiO2-GO和Fe3O4-SiO2-GO-AAIL的红外光谱曲线分别对应图2中a、b、c。曲线a中585 cm-1处峰为Fe3O4中Fe-O特征吸收峰,1 090 cm-1处峰为SiO2中Si-O-Si伸缩振动峰[10],这表明SiO2成功负载到Fe3O4表面。曲线b中1 630 cm-1处峰为GO中类苯环结构中C=C伸缩振动峰,3 400 cm-1处峰是O-H键伸缩振动峰[11],表明GO已成功包覆在Fe3O4-SiO2表面。曲线c与曲线a、b相比,在1 300 cm-1处有明显出峰现象,说明Fe3O4-SiO2-GO-AAIL复合材料中存在更多的氨基,从而可知AAIL已成功包覆在Fe3O4-SiO2-GO表面。
2.1.2 扫描电镜图3为Fe3O4-SiO2-GO和Fe3O4-SiO2-GO-AAIL复合材料扫描电镜(SEM)图。由图3a可知,球状Fe3O4-SiO2已成功负载在GO片层结构上。由图3b可知,材料表面凹凸不平,粗糙富有立体感,这表明AAIL已成功包覆在Fe3O4-SiO2-GO表面。AAIL的加入使得材料具有更大的比表面积,增大了复合材料与样品中Cd(Ⅱ)的接触面积,更有利于进行磁性固相萃取[12]。

图3 Fe3O4-SiO2-GO(A)和Fe3O4-SiO2-GO-AAIL(B)的扫描电镜(SEM)图Fig.3 SEM images of Fe3O4-SiO2-GO(A) and Fe3O4-SiO2-GO-AAIL(B)
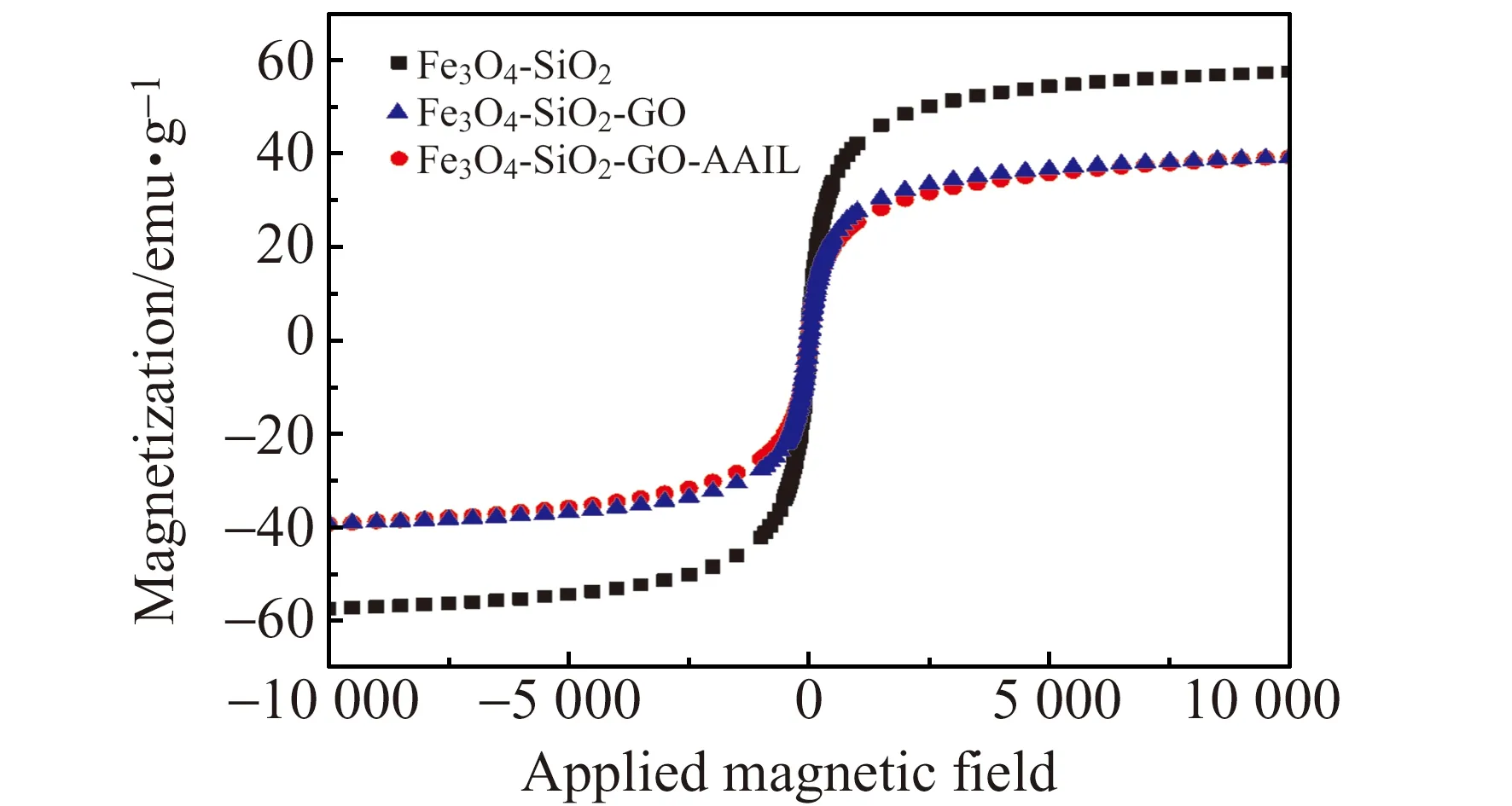
图4 Fe3O4-SiO2、Fe3O4-SiO2-GO和Fe3O4-SiO2-GO-AAIL的磁滞回线Fig.4 Magnetic hysteresis loops of Fe3O4-SiO2,Fe3O4-SiO2-GO and Fe3O4-SiO2-GO-AAIL
2.1.3 磁滞回线表征磁滞回线是铁磁性物质的一个重要特征。由图4可知,Fe3O4-SiO2-GO的饱和磁化强度比Fe3O4-SiO2低,这说明GO已经成功包覆在Fe3O4-SiO2表面。同样,Fe3O4-SiO2-GO-AAIL饱和磁化强度比Fe3O4-SiO2-GO低,说明AAIL成功包覆在Fe3O4-SiO2-GO表面。
2.2 萃取剂选择
实验比较Fe3O4-SiO2、Fe3O4-SiO2-GO、Fe3O4-SiO2-GO-AAIL 3种复合材料对Cd(Ⅱ)的萃取率。实验结果如图5所示,Fe3O4-SiO2-GO-AAIL复合材料对Cd(Ⅱ)萃取率最高,所以选择Fe3O4-SiO2-GO-AAIL作为萃取剂。
2.3 萃取条件优化
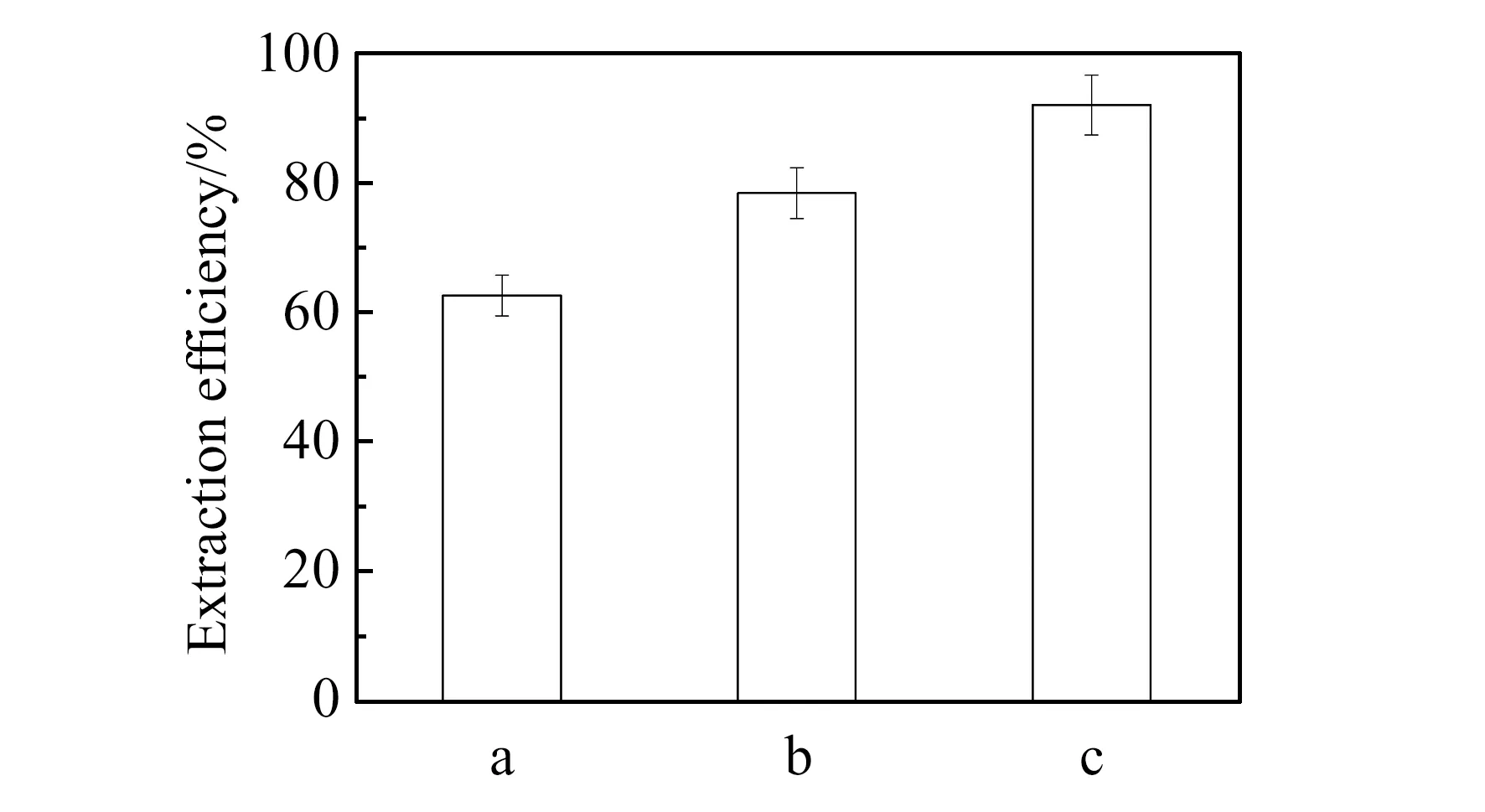
图5 Fe3O4-SiO2(a)、Fe3O4-SiO2-GO(b)和Fe3O4-SiO2-GO-AAIL(c)对Cd(Ⅱ)的萃取率Fig.5 Extraction efficiencies of Fe3O4-SiO2(a),Fe3O4-SiO2-GO(b) and Fe3O4-SiO2-GO-AAIL(c) for Cd(Ⅱ)

图6 pH对Cd(Ⅱ)萃取率的影响Fig.6 Effect of pH on extraction efficiency of Cd(Ⅱ)
2.3.2 离子强度影响为了探讨离子强度对磁性固相萃取过程的影响,研究浓度0%~25%NaCl对Cd(Ⅱ)萃取率的影响。Fe3O4-SiO2-GO-AAIL复合材料萃取率随着NaCl浓度上升明显下降。这是因为Fe3O4-SiO2-GO-AAIL复合材料作为萃取剂和Cd(Ⅱ)之间存在静电作用,NaCl的加入增强了溶液中的离子强度,减弱了它们之间的静电作用。
2.3.3 萃取时间选择为了探讨萃取时间对Cd(Ⅱ)萃取率的影响,对1~60 min萃取时间进行了研究。随着萃取时间的增加,Fe3O4-SiO2-GO-AAIL复合材料对Cd(Ⅱ)萃取率上升,50 min时萃取率达到最大值,所以选择最佳萃取时间为50 min。
2.3.4 萃取剂用量选择为研究Fe3O4-SiO2-GO-AAIL复合材料用量对磁性固相萃取过程的影响,对Fe3O4-SiO2-GO-AAIL用量为1~25 mg进行了研究。随着萃取剂用量的增加,萃取率逐渐上升,萃取剂用量为15 mg时,萃取率达到最大并保持平衡。因此,在磁性固相萃取过程中,Fe3O4-SiO2-GO-AAIL复合材料最适宜的用量为15 mg。
2.3.5 样品体积增大样品体积,Fe3O4-SiO2-GO-AAIL复合材料对Cd(Ⅱ)萃取率升高,并在40 mL处获得最大萃取率,之后增加萃取体积,萃取率下降。所以选择最大萃取体积为40 mL。
2.4 萃取容量
萃取容量是指1 g萃取剂可以萃取样品溶液中Cd(Ⅱ)的最大量,即Fe3O4-SiO2-GO-AAIL材料的萃取能力。实验结果如图7所示。1 g Fe3O4-SiO2-GO-AAIL复合材料可以萃取Cd(Ⅱ)的最大量为5.5 mg。
2.5 洗脱条件优化
为了选择最适宜的洗脱剂,对0.01、0.05、0.1、0.5 mol/L HCl进行探讨。当HCl浓度为0.5 mol/L时,洗脱率达到100%。所以,选择0.5 mol/L HCl作为洗脱剂。
为了选择最适宜的洗脱剂体积,用1~10 mL 0.5 mol/L HCl对复合材料吸附的Cd(Ⅱ)进行洗脱,洗脱率随着洗脱剂体积的增加而上升,并在9.0 mL时完全洗脱。所以,选择9.0 mL作为磁性固相萃取过程中最适宜的洗脱剂体积。
为了探讨洗脱时间对洗脱率的影响,对1~60 min洗脱时间进行研究,结果随着洗脱时间增加,洗脱率逐渐上升,并在50 min达到最大值。因此,选择50 min为洗脱时间。
2.6 Fe3O4-SiO2-GO -AAIL复合材料重复利用次数
固定Cd(Ⅱ)的用量为0.5 μg,Fe3O4-SiO2-GO-AAIL复合材料的用量为15 mg,pH=9.0,振摇50 min,外加磁铁分离,再用9 mL 0.5 mol/L HCl溶液洗脱50 min,外加磁铁分离,上清液用ICP-OES法检测。洗涤Fe3O4-SiO2-GO-AAIL复合材料,烘干后,重复利用,从图8的实验结果可以看出,重复利用9次以后,Fe3O4-SiO2-GO-AAIL复合材料的萃取率仍可以达到90%以上,第10次之后,萃取率下降到79.2%。这是因为Fe3O4-SiO2-GO-AAIL复合材料在多次重复利用后,表面的AAIL脱落,所以第10次萃取过程实际是Fe3O4-SiO2-GO对Cd(Ⅱ)的萃取,萃取率也和2.2中实验结果一致。所以,Fe3O4-SiO2-GO-AAIL复合材料可以重复利用9次。
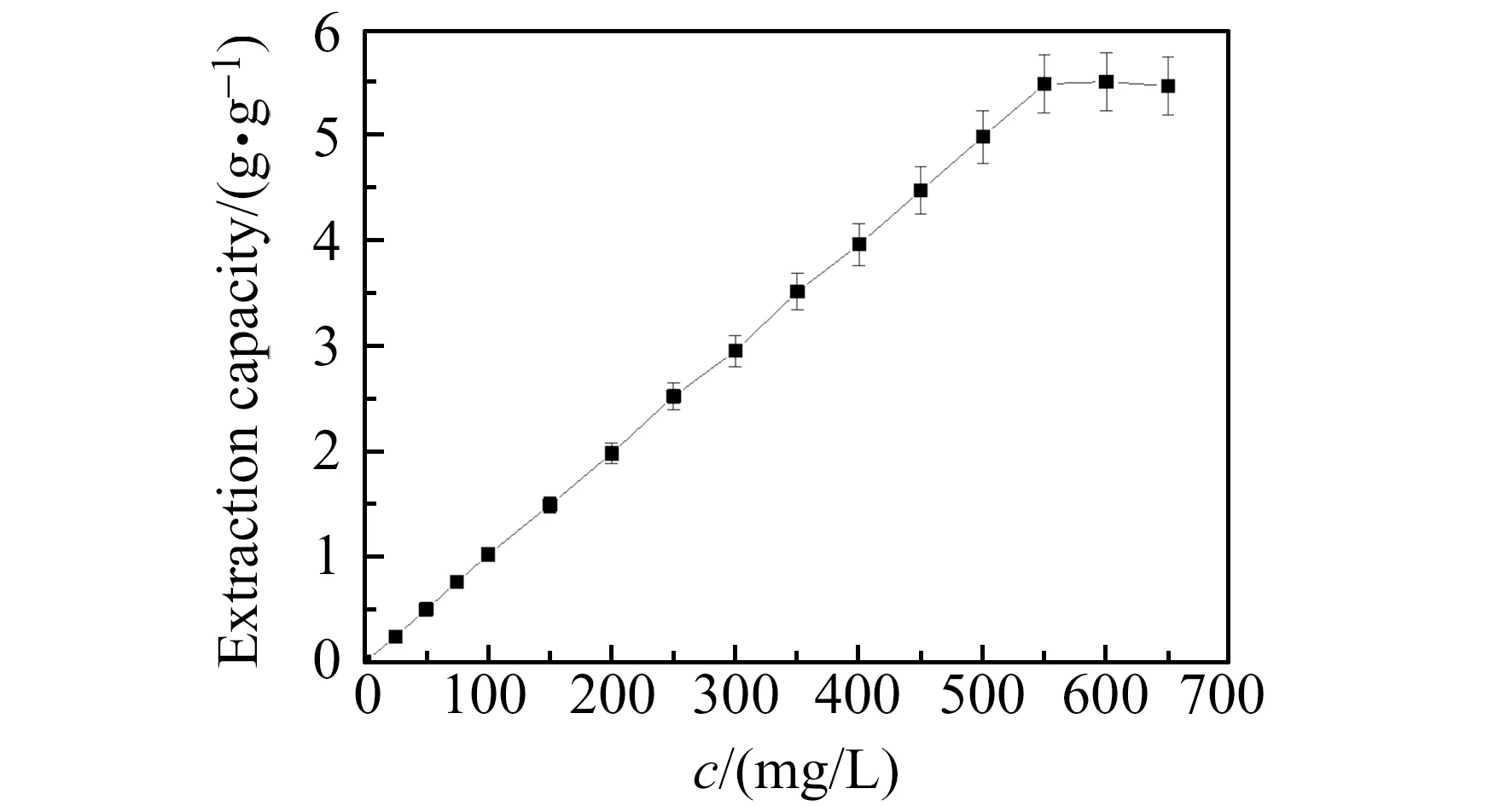
图7 Fe3O4-SiO2-GO-AAIL材料的萃取容量Fig.7 Extraction capacity of Fe3O4-SiO2-GO-AAIL

图8 Fe3O4-SiO2-GO-AAIL材料的重复利用率Fig.8 Reusability of Fe3O4-SiO2-GO-AAIL
2.7 共存离子的影响
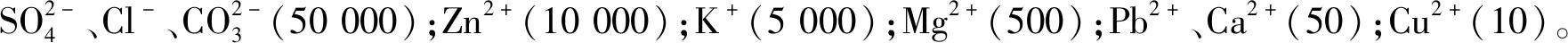
2.8 分析性能
根据实验方法,改变体系中Cd(Ⅱ)浓度(c,ng/mL)并绘制工作曲线,其线性方程为:I=89 181.1c+4 014,线性范围为0.005~100.0 ng/mL,相关系数R2=0.997。对11份空白试样进行测定,测得检出限为4.7×10-4ng/mL。相对标准偏差(RSD)为1.41%(n=11,c=4.5 ng/mL)。
2.9 环境水样的测定
应用本方法成功测定了环境标准水样(GBW08612),回收率为97.0%~99.0%。同时测定了3种实际水样(工厂附近河流水样,污水站处理过的污水水样和风景区周围水质较差河流水样)。其中,工厂排放污水的河流和污水厂处理过的污水中均有不同程度Cd(Ⅱ)污染。
在最佳实验条件下进行加标回收实验,结果见表1,3种实际水样的回收率分别为98.2%~99.3%、99.4%~99.5%和98.5%~99.4%。与已有文献报道方法相比(表2),结果较好。

表1 环境实际水样Cd(Ⅱ)的测定结果(n=3)Table 1 The determination results of environmental water samples(n=3)
ND:not detected.
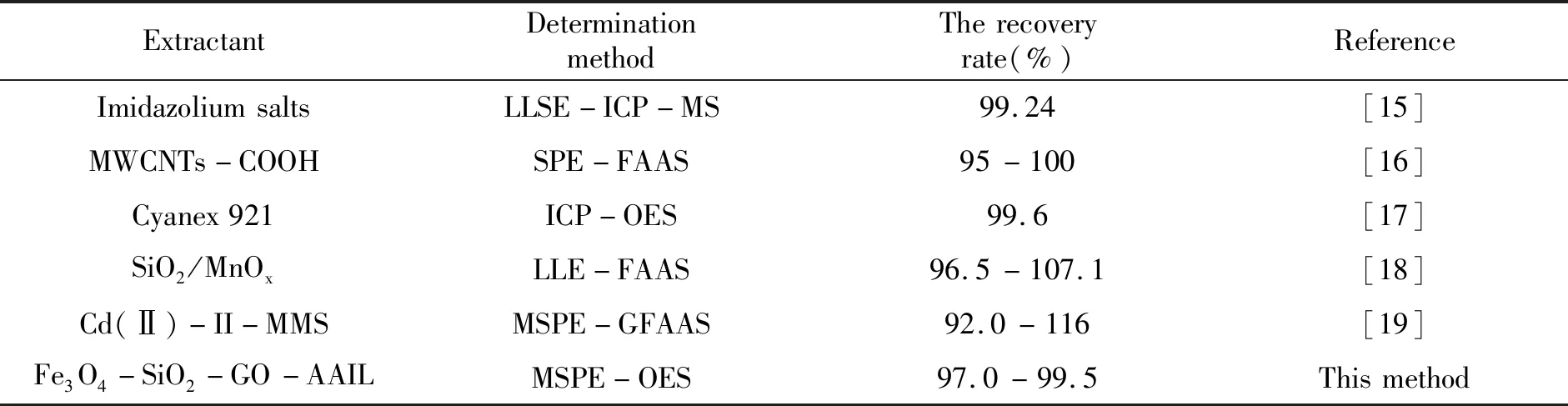
表2 环境水样中Cd(Ⅱ)测定方法的比较Table 2 Comparison of determination methods of Cd(Ⅱ) in environmental water samples
3 结论
本实验将AAIL插入GO片层,合成了Fe3O4-SiO2-GO-AAIL复合材料,将其作为磁性固相萃取剂萃取环境水样中Cd(Ⅱ)。室温下,pH=9.0,萃取率为93.2%。萃取剂可重复利用9次。将此复合材料应用于实际水样中Cd(Ⅱ)含量的检测,回收率在98.2%~99.5%范围。
